Abstrak
Krisis COVID-19 telah menentukan perlunya pendekatan baru untuk manajemen langsung kondisi pandemi dan epidemi. Di sini, pendekatan berdasarkan penginderaan elektronik RNA virus diusulkan untuk deteksi virus dan pelacakan varian. Strategi penginderaan Transistor Efek Medan Termodulasi Muatan Organik (OCMFET) digunakan untuk pengembangan platform multi-penginderaan, yang mampu mengevaluasi referensi kontrol dan sampel yang diselidiki secara paralel. Deteksi RNA genom virus tanpa PCR ditunjukkan pada konsentrasi target yang berbeda, dengan diskriminasi optimal sehubungan dengan kontrol negatif. Selain itu, pendekatan yang sama dapat dilakukan untuk pelacakan varian virus, sebagai strategi penyaringan untuk deteksi mutasi dalam sampel yang diperkuat PCR: pendekatan tersebut dapat digunakan untuk rasionalisasi prosedur pengurutan RNA, yang sulit dilakukan pada fase akut pandemi, tetapi sangat penting untuk manajemen pandemi yang efektif. Hasilnya membuka jalan bagi strategi baru untuk meningkatkan efektivitas biaya, kemudahan penggunaan yang dikombinasikan dengan selektivitas dan sensitivitas dalam deteksi virus selama kondisi pandemi yang parah, dan pelacakan varian yang lebih efektif dengan mengoptimalkan akses ke sumber daya pengurutan bahkan selama fase akut pandemi.
1 Pendahuluan
Pada tanggal 5 Mei 2023, Organisasi Kesehatan Dunia secara resmi mengumumkan berakhirnya pandemi COVID-19. Dengan lebih dari 7 juta kematian di seluruh dunia (hingga Desember 2024 [ 1 ] ) dan konsekuensi sosial-ekonomi yang tak terhitung, peristiwa ini mengungkap semua keterbatasan program medis dan teknologi yang tersedia untuk manajemen darurat, dan pentingnya investasi dalam biologi dan bioteknologi untuk pengembangan pendekatan terapeutik dan diagnostik di luar keadaan terkini saat ini.
Penanganan pandemi COVID-19 bergantung pada deteksi dini virus dalam sampel biologis (kebanyakan usapan nasofaring dan air liur), dan pada kemampuan melacak penyebaran varian untuk mengadaptasi terapi dan alat diagnostik terhadap evolusi virus. Deteksi terutama melibatkan dua pendekatan berbeda: imunosensing dengan uji aliran lateral, berdasarkan penangkapan SARS-CoV-2 dengan mengikat protein lonjakannya dengan antibodi spesifik, dan deteksi genetik RNA virus. Pendekatan pertama memastikan biaya yang lebih rendah bagi pengguna dan waktu yang lebih singkat untuk mendapatkan hasil, tetapi efektivitasnya dalam deteksi maksimal setelah gejala muncul. Selain itu, karena spesifisitas sangat bergantung pada deteksi imunologis protein lonjakan, bahkan perubahan kecil dalam strukturnya dapat sangat memengaruhi spesifisitas dan keakuratan tes, sehingga menghasilkan kemungkinan negatif palsu yang lebih tinggi. Deteksi molekuler memastikan kinerja terbaik dalam hal sensitivitas dan spesifisitas awal, tetapi kebutuhan pemrosesan virus untuk mengekstraksi RNA-nya dan, terutama, amplifikasinya dengan Reaksi Berantai Polimerase (PCR) secara signifikan meningkatkan waktu untuk mendapatkan hasil. [ 2 ]
Pelacakan varian virus merupakan aktivitas mendasar untuk manajemen pandemi yang tepat, karena dampak varian baru dapat berdampak signifikan pada sistem kesehatan masyarakat. Pada kondisi terkini, penemuan dan pelacakan varian baru terutama didasarkan pada teknologi Sanger sequencing atau Next Generation Sequencing (NGS) dari RNA virus yang diekstraksi dari sampel air liur dan usapan nasofaring, yang kemudian diselaraskan secara in silico dengan urutan yang diketahui sebelumnya. Selain itu, karena amplifikasi RNA virus sangat penting untuk memastikan pengurutan yang benar, laboratorium harus berbagi sumber daya PCR untuk deteksi dan pelacakan virus: selama pandemi COVID-19, hal ini sebenarnya mengakibatkan pelacakan yang terbatas, karena diagnosis sering dianggap lebih penting dalam manajemen dampak sosial-ekonomi jangka pendek. [ 3 ]
Kemungkinan signifikan dari pandemi berikutnya dalam abad ini [ 4 ] mendorong komunitas ilmiah untuk mempertimbangkan secara menyeluruh pengalaman COVID-19 dan menghasilkan pendekatan inovatif untuk mengurangi dampak sosial, medis dan ekonomi. Mengenai diagnosis, ini melibatkan teknologi baru yang dapat menggabungkan biaya rendah dan hasil cepat dari pengujian imunologi dengan akurasi dan sensitivitas tinggi deteksi RNA sejak tahap awal infeksi (yaitu, bahkan sebelum gejala muncul), [ 5 ] dan ini sebagian besar menyiratkan penghindaran amplifikasi PCR. Dalam hal pelacakan, karena pengurutan tidak dapat dihindari untuk mendapatkan urutan varian baru yang benar, pengembangan pendekatan yang lebih mudah dan lebih cepat yang dapat digunakan untuk penyaringan sampel akan sangat bermanfaat.
Bahasa Indonesia: Untuk memenuhi tujuan-tujuan ini, komunitas ilmiah telah mempertimbangkan biosensor sebagai solusi yang berharga sejak awal pandemi COVID-19. Biosensor mengintegrasikan deteksi biokimia dan transduksi sinyal dalam banyak bentuk, yang berpotensi memungkinkan pengembangan instrumentasi yang ringkas, hemat biaya, dan mudah digunakan untuk deteksi biomolekuler dalam berbagai skenario aplikasi. [ 6 , 7 ] Deteksi virus bebas PCR telah ditunjukkan dalam biosensor elektrokimia [ 8 – 12 ] dan elektronik: khususnya, teknologi terbaru menghasilkan daya tarik karena potensi miniaturisasi yang tinggi, fabrikasi yang hemat biaya, dan amplifikasi sinyal intrinsik. [ 13 ] Hingga saat ini, transistor efek medan berbasis grafena (GFET) telah ditunjukkan cocok untuk penginderaan RNA virus bebas PCR, [ 14 – 17 ] tetapi hanya dalam beberapa contoh berdasarkan pendekatan fabrikasi skala rendah, yang tidak sepenuhnya memenuhi persyaratan teknologi berbiaya rendah yang cocok untuk platform penginderaan sekali pakai. Dalam hal ini, elektronik fleksibel organik merupakan pendekatan yang berharga untuk fabrikasi biosensor berbasis FET, yaitu bioFET, melalui proses produksi yang hemat biaya dan berskala besar: [ 18 ] meskipun demikian, teknologi ini sebagian besar telah dieksplorasi untuk deteksi imunologis SARS-CoV-2, [ 19 – 21 ] dan hingga saat ini belum ada contoh dalam literatur mengenai deteksi molekuler bebas PCR dan pendekatan untuk pelacakan varian.
Dalam makalah ini, kami melaporkan penggunaan struktur bioFET, yaitu Organic Charge-Modulated FET (OCMFET) untuk deteksi RNA virus bebas PCR, dan pengenalan varian pada amplikon yang diamplifikasi PCR berdasarkan selektivitas sensor terhadap polimorfisme, tanpa perlu pengurutan. Prinsip kerja OCMFET telah dieksplorasi secara menyeluruh untuk pengenalan hibridisasi DNA, [ 22 – 25 ] menghasilkan kinerja sensitivitas dan selektivitas rekor dunia di antara biosensor berbasis semikonduktor organik. [ 23 ] Baru-baru ini, penggunaannya untuk deteksi biomarker epigenetik bebas PCR dalam sampel genom telah dilaporkan untuk skrining kanker kolorektal. [ 25 ] Dalam percobaan dalam makalah ini, SARS-CoV-2 dan variannya digunakan sebagai tolok ukur yang signifikan untuk menunjukkan kelayakan potensial dari pendekatan yang diusulkan pada tingkat bukti konsep. Berkat penggunaan probe Peptide Nucleic Acid (PNA), fragmen RNA virus dalam rentang femtomolar telah terdeteksi. Selain itu, berkat ketahanan pendekatan OCMFET, selektivitas terhadap varian nukleotida tunggal ditingkatkan dengan penggunaan probe PNA dibandingkan dengan probe yang didasarkan pada asam nukleat standar. Dalam percobaan yang dilakukan dengan amplikon yang diperoleh dari dua wilayah berbeda dari kerangka ORF1 genom virus, sekuens SARS-CoV-2 berhasil dibedakan dari varian spesifik SARS-CoV-2 VOC-202012/01 (varian Alfa). Dalam kedua kasus, deteksi RNA terjadi dalam 20–40 menit, sehingga lebih cepat daripada pendekatan molekuler umum dan sebanding dengan deteksi imunologis. Oleh karena itu, pendekatan ini memenuhi dua peran yang berbeda: deteksi molekuler virus yang sangat sensitif dan bebas PCR dengan teknologi yang hemat biaya, harga yang kompetitif dengan penginderaan imunologis, dan pengenalan varian spesifik melalui amplifikasi sampel tetapi tanpa perlu pengurutan. Meskipun masih dalam tahap awal dan memerlukan penyelidikan lebih lanjut, hasil yang diusulkan berpotensi membuka jalan bagi penerapan pendekatan yang diusulkan dalam alat skrining cepat berbiaya rendah generasi berikutnya untuk pelacakan mutasi virus.
2 Hasil dan Pembahasan
2.1 Evaluasi Bukti Konsep Strategi Deteksi
Gambar 1a menunjukkan prinsip kerja deteksi RNA virus berbasis OCMFET. Seperti yang dibahas secara menyeluruh di tempat lain, [ 26 ] OCMFET adalah sensor muatan berbasis transistor gerbang mengambang, yang mampu mentransduksi variasi muatan di dekat bagian gerbang mengambang yang secara langsung terpapar ke lingkungan (selanjutnya, area penginderaan) menjadi variasi tegangan ambang batas. Memang, muatan pada area penginderaan memengaruhi distribusi muatan di dalam gerbang mengambang, yang melibatkan jumlah muatan yang tersedia dalam struktur transistor untuk menginduksi pembentukan saluran pada antarmuka semikonduktor-isolator. Variasi pembawa muatan di area penginderaan, Δ Q , dan variasi tegangan ambang batas yang sesuai, Δ V TH , dihubungkan oleh total kapasitansi dalam tata letak, C SUM , melalui Persamaan ( 1 )
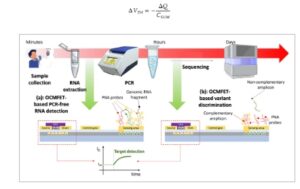
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Deteksi virus berbasis OCMFET dan pelacakan varian versus prosedur terkini: a) Deteksi RNA virus genomik bebas PCR berbasis OCMFET melalui probe PNA yang mampu menangkap fragmen RNA dari permukaan penginderaan; b) deteksi amplikon untuk pengenalan varian sebagai pendekatan penyaringan yang mendukung pemilihan sampel untuk pengurutan RNA: probe PNA spesifik mengenali urutan RNA dari versi virus yang ditentukan. Muatan negatif dari target yang ditangkap memodulasi distribusi muatan dalam transistor, yang menentukan variasi arus keluaran yang proporsional dengan konsentrasi target.
Karena tegangan ambang bervariasi, arus keluaran transistor bervariasi sesuai dengan itu. Persamaan terbaru juga menghubungkan kinerja perangkat dan fitur geometri tata letak melalui C SUM , sehingga memungkinkan penyesuaian yang tepat dari kemampuan penginderaan melalui aturan desain yang ditentukan. [ 23 ] Spesifisitas sensor bergantung pada fungsionalisasi area penginderaan melalui reseptor yang khusus untuk analit yang diselidiki. Untuk deteksi RNA virus, pengikatan komplementer antara urutan target dan lapisan reseptor (selanjutnya, lapisan probe) digunakan untuk menjangkarkan RNA virus ke permukaan penginderaan. Karena RNA adalah molekul bermuatan negatif, pergeseran tegangan ambang terjadi, dan akibatnya terjadi variasi arus keluaran.
Dalam aplikasi ini, probe PNA, yang tulang punggung fosfat deoksiribosanya telah digantikan oleh ikatan tak bermuatan, dipilih karena stabilitas pengikatan heliks ganda yang lebih tinggi dengan RNA dibandingkan dengan hibrida DNA-RNA dan karena ketahanannya terhadap nuklease dan protease. Selain itu, PNA menjamin spesifisitas yang lebih tinggi dibandingkan dengan probe DNA atau RNA, karena keberadaan satu non-pairing membuat heliks ganda hibrida jauh kurang stabil daripada heliks ganda RNA-RNA, DNA-DNA atau RNA-DNA. [ 27 ] Karakterisasi awal kinerja probe PNA dibandingkan dengan DNA dievaluasi melalui analisis optik pada target berlabel fluoresen: hasilnya dijelaskan dalam Informasi Pendukung (Gambar S2 , Informasi Pendukung dan teks terkait).
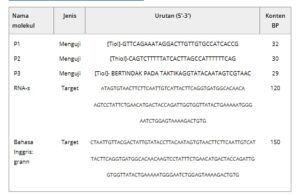
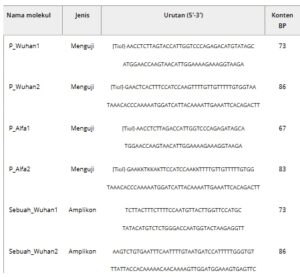
Tiga sekuens PNA, yaitu P1, P2, dan P3 disintesis untuk melengkapi sekuens sepanjang 150 bp di wilayah ORF3a RNA virus, yang secara spesifik ditujukan untuk virus SARS-CoV-2 dibandingkan dengan virus korona lainnya. Ketiga probe tersebut telah dirancang (detailnya ada di bagian Eksperimen) untuk mengikat area ini di tiga titik berbeda, sehingga meningkatkan efisiensi penangkapan oligonukleotida RNA panjang. Sekuens probe dilaporkan dalam Tabel 1 .
Tabel 1. Molekul untuk uji deteksi RNA virus.
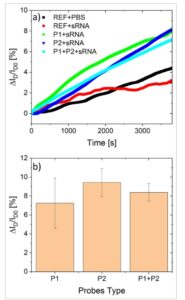
Uji pendahuluan dilakukan untuk memverifikasi efektivitas prosedur fungsionalisasi, dan fungsionalitas sensor yang benar dalam mendeteksi fragmen RNA yang panjang. Untuk tujuan ini, probe yang dilengkapi dengan pewarna fluoresensi sianin-3 (Cy3) dibeli, yang memungkinkan validasi optik dari protokol fungsionalisasi (Gambar S3 , Informasi Pendukung). Validasi deteksi dilakukan dengan menggunakan target RNA sintetis (sRNA) dengan panjang 120 bp, yang merupakan panjang maksimum yang dapat dijamin oleh pabrikan dengan tingkat kemurnian yang tinggi. Hasil deteksi target dilaporkan dalam Gambar 2 , dalam bentuk persentase variasi arus dalam waktu nyata (a) dan rata-rata di antara tiga eksperimen independen (b). Persentase variasi arus adalah 100·ΔI D /I D0 , dengan ΔI D = I D -I D0 , dan khususnya I D adalah arus keluaran transistor, sementara I D0 adalah nilai stabilnya sebelum penambahan molekul target. Tahap stabilisasi dilakukan untuk memastikan bahwa setiap pergeseran residual dalam I D0 dapat diabaikan dalam jangka waktu yang relevan (Gambar S4 , Informasi Pendukung). Larutan yang mengandung target RNA dengan konsentrasi akhir 1 µ m dititikkan pada area penginderaan perangkat pada t = 0. Rincian lebih lanjut tentang kondisi pengukuran tersedia di bagian Eksperimen. Karena setiap sensor menampung tiga OCMFET yang berbeda, uji validasi dimungkinkan: khususnya, untuk setiap perangkat, dua OCMFET tidak difungsikan (perangkat referensi, REF), sedangkan yang ketiga difungsikan dengan satu probe (P1 dan P2) atau dengan kombinasi probe (P1+P2). Dalam percobaan ini, hanya probe P1 dan P2 yang dipertimbangkan, karena urutan P3 dirancang untuk mengikat target 150 bp di ujung 5′, sehingga pada dasarnya tidak dapat digunakan dalam target sintetis sepanjang 120 bp. Seperti yang ditunjukkan pada Gambar 2a , perangkat REF menunjukkan peningkatan arus dengan dinamika yang sama ketika terpapar pada PBS murni dan pada urutan target (konsentrasi 1 µM): variasi arus ini menunjukkan pergeseran intrinsik sensor, mungkin terkait dengan bias-stres residual, yaitu, penangkapan pembawa muatan secara terus-menerus pada antarmuka semikonduktor-isolator. Eksperimen ini memungkinkan pendefinisian margin noise untuk evaluasi respons spesifik sensor. Faktanya, ketika perangkat yang difungsikan terpapar pada urutan target komplementer, respons yang jauh lebih besar diperhatikan, dengan dinamika yang dapat dibedakan dengan jelas sehubungan dengan pergeseran. Ini diperoleh pada perangkat yang difungsikan dengan probe tunggal dan dengan lapisan probe P1+P2. Dalam eksperimen berulang (Gambar 2b), ketiga konfigurasi berbeda yang diuji tidak bervariasi secara signifikan, meskipun P2 menghasilkan sedikit lebih efisien dalam hal amplitudo dan reproduktifitas sinyal, dan P1+P2 memiliki kinerja yang serupa. Ini dapat koheren dengan posisi titik penahan P2 dalam urutan target, yaitu, di dekat ujung 3′ dan dengan demikian mendekati permukaan penginderaan, sementara P1 bersifat komplementer terhadap sebagian molekul yang mendekati ujung 5′: ketika probe P1 digunakan sendiri, efisiensi hibridisasi mungkin lebih rendah karena beban bagian target yang tersisa. Meskipun demikian, dalam semua konfigurasi yang diadopsi, fungsionalitas sensor sepenuhnya ditunjukkan.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Karakterisasi awal sensor RNA berbasis OCMFET dengan target sintetis: a) persentase variasi arus representatif dalam waktu untuk referensi kosong yang terpapar PBS (hitam), referensi kosong yang terpapar molekul target (merah) dan sensor fungsional yang terpapar molekul target pada konsentrasi 1 µM dengan konfigurasi lapisan probe yang berbeda (probe tunggal P1– hijau– dan P2– biru– dan lapisan probe gabungan P1+P2– cyan). b) Rata-rata variasi arus untuk konfigurasi lapisan probe yang berbeda dievaluasi dalam tiga eksperimen berbeda.
2.2 OCMFET sebagai Deteksi RNA Virus Bebas PCR
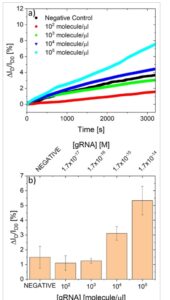
Setelah pengujian pendahuluan ini, deteksi RNA genomik dipertimbangkan. RNA genomik yang berasal dari sampel positif standar untuk validasi usap tenggorokan dan dari pasien negatif difragmentasi menjadi target RNA genomik (gRNA) 150 bp, disiapkan seperti yang dijelaskan dalam Bagian Eksperimen; pengujian hibridisasi dilakukan dengan mengikuti prosedur yang sama dari pengujian yang dilaporkan sebelumnya. Gambar 3 melaporkan contoh variasi arus waktu nyata (a) dan hasil rata-rata selama tiga pengulangan pengujian yang independen (b). Sampel negatif digunakan sebagai referensi untuk menentukan pita toleransi respons sensor: juga dalam kasus ini, penyimpangan aspesifik dicatat, tidak melebihi (rata-rata) 1,5% variasi arus selama percobaan. Konsentrasi sampel positif yang berbeda diuji, berkisar dari 10 2 hingga 10 5 molekul per mikroliter, yaitu, nilai tipikal dari respons positif rendah hingga respons positif penuh. Dimungkinkan untuk mengamati bahwa untuk konsentrasi yang lebih rendah (10 2 -10 3 molekul per mikroliter, setara dengan 10 −17 -10 −16 M), respons sensor tidak dapat dibedakan dengan jelas dari kontrol negatif, sedangkan untuk konsentrasi yang lebih besar (10 4 -10 5 , yaitu, 10 −15 -10 −14 m ) respons sensor jelas berada di luar kontrol negatif, yang rata-rata dua hingga empat kali lebih besar. Akuisisi kurva karakteristik statis memungkinkan verifikasi bahwa variasi arus benar-benar terkait dengan pergeseran tegangan ambang batas, mengikuti prinsip kerja OCMFET (Gambar S5 , Informasi Pendukung). Meskipun masih awal, hasil ini dengan jelas menunjukkan potensi OCMFET sebagai sensor RNA genomik, yang dideteksi pada kondisi yang berharga tanpa perlu amplifikasi PCR dan dengan persiapan sampel minimum. Patut dicatat bahwa kinerja perangkat dalam hal sensitivitas beberapa kali lipat lebih besar daripada yang sebelumnya diperoleh dalam deteksi hibridisasi DNA oleh OCMFET (konsentrasi terukur 1 pM, batas deteksi yang diekstrapolasi sebesar 100 fM [ 23 ] ): sensitivitas yang ditingkatkan ini dapat dikaitkan dengan penggunaan probe PNA, yang memungkinkan penghindaran tolakan muatan antara probe dan target dan dengan demikian membuat hibridisasi lebih efisien juga pada konsentrasi yang lebih rendah. Selain itu, kinerja ini dapat ditingkatkan lebih lanjut mulai dari hasil awal ini, memanfaatkan aturan desain OCMFET, yang memungkinkan meramalkan batas deteksi yang lebih rendah dengan mengoptimalkan tata letak pada konsentrasi yang diminta. [ 23 ]Misalnya, mengurangi luas total gerbang mengambang (dan dengan demikian luas kapasitor kontrol), bersama dengan meningkatkan rasio luas penginderaan/luas gerbang mengambang, akan menghasilkan kinerja sensitivitas yang lebih tinggi.
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Deteksi RNA virus genomik bebas PCR berbasis OCMFET. a) Persentase variasi arus representatif dalam waktu untuk perangkat fungsional yang diekspos ke kontrol negatif (hitam) dan peningkatan konsentrasi target, dinyatakan dalam molekul·µl −1 , dari 10 2 (merah), 10 3 (hijau), 10 4 (biru) dan 10 5 (sian). b) Rata-rata persentase variasi arus yang diperoleh dalam tiga eksperimen berbeda dan independen untuk setiap konsentrasi; sumbu x atas melaporkan konsentrasi molar target yang sesuai.
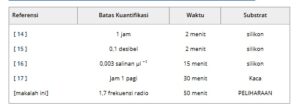
Tabel 2 membandingkan kinerja sensor yang diusulkan dengan sensor berbasis efek medan lainnya. [ 14 – 17 ] Konsentrasi minimum yang diuji (batas kuantifikasi) memang sebanding dengan sebagian besar state-of-the-art, serta waktu untuk mendapatkan hasil. Perlu dicatat bahwa hasil referensi diperoleh pada penyangga padat (kaca atau silikon) dengan graphene yang disiapkan dalam suspensi dan kemudian dikumpulkan pada penyangga. Sebaliknya, kinerja yang dilaporkan di sini diperoleh dalam proses teknologi yang umum untuk elektronik organik fleksibel, yang lebih cocok untuk ditingkatkan ke proses produksi massal area besar yang hemat biaya. Oleh karena itu, hasil ini relevan untuk pengembangan kit penyaringan massal yang terjangkau di masa mendatang. Selain itu, langkah-langkah pengoptimalan yang dibahas sebelumnya dalam hal dimensi tata letak berpotensi lebih meningkatkan kemampuan penginderaan perangkat, sehingga membuatnya lebih kompetitif dalam hal sensitivitas.
Tabel 2. Perbandingan pendekatan yang diusulkan dengan literatur yang relevan.
2.3 OCMFET untuk Diskriminasi Varian
Mekanisme deteksi RNA virus oleh OCMFET dapat diadaptasi untuk diskriminasi varian tanpa perlu mengurutkan seluruh genom virus. Pendekatan ini, dijelaskan dalam Gambar 1b , bergantung pada ketahanan deteksi OCMFET terhadap polimorfisme, yang ditunjukkan secara menyeluruh dalam sistem DNA/DNA: [ 22 , 23 ] jika amplikon dihasilkan oleh PCR, perangkat OCMFET yang disediakan dengan probe spesifik berpotensi mampu membedakan antara sekuens virus yang berbeda dengan jumlah mutasi yang terbatas. Oleh karena itu, strategi ini dapat digunakan untuk melakukan penyaringan sampel untuk mengoptimalkan pengurutan mutasi: tidak hanya sejumlah kecil sampel (yaitu, yang dipilih sebagai virus yang mungkin bermutasi oleh penyaringan OCMFET) akan diurutkan, tetapi pemilihannya (pada keadaan terkini, murni statistik) akan dipandu oleh data pengukuran yang kuat.
Untuk menunjukkan fungsionalitas lebih lanjut ini, dua virus SARS-CoV-2 yang serupa, yaitu Wuhan-Hu-1 asli dan varian SARS-CoV-2 VOC-202012/01 (Alpha) dipertimbangkan. Varian terbaru berbeda dari virus asli dari beberapa delesi di wilayah ORF3a protein lonjakan (lihat detail di bagian Eksperimen): amplikon telah dirancang sebagai oligonukleotida 73 dan 86 bp termasuk area dengan mutasi kuat. Secara khusus, jenis amplikon pertama dirancang di wilayah yang mengandung delesi 6 bp (selanjutnya, Del69) dalam varian Alpha sehubungan dengan Wuhan, sehingga menghasilkan konten polimorfik ≈ 8%, sementara amplikon kedua mencakup delesi maksimum 3 bp (Del114, konten polimorfik 3,7%). Dengan cara ini, empat amplikon didefinisikan: dua untuk virus Wuhan asli (A_Wuhan1 dan A_Wuhan2) dan dua untuk varian Alpha (A_alpha1 dan A_alpha2). Probe PNA dirancang untuk melengkapi masing-masing target ini: semua urutan dilaporkan dalam Tabel 3 .
Tabel 3. Probe dan Amplikon yang digunakan untuk uji deteksi varian.
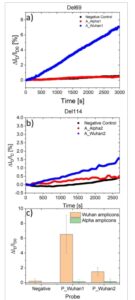
Gambar 4 melaporkan pengukuran waktu nyata yang representatif untuk deteksi amplikon (a,b) dan persentase rata-rata variasi arus selama tiga eksperimen independen (c). Setiap eksperimen menggunakan platform OCMFET yang difungsikan dengan satu probe (P_Wuhan1 atau P_Wuhan2), dengan satu perangkat yang diekspos ke kontrol negatif, perangkat yang diekspos ke amplikon komplementer dan yang terakhir diekspos ke padanannya yang bermutasi. Jika perangkat difungsikan dengan probe P_Wuhan1 untuk diskriminasi Del69 (Gambar 4a ), adalah mungkin untuk mengamati bahwa respons positif hanya diperoleh untuk amplikon komplementer A_Wuhan1, sementara A_alpha1 menghasilkan respons yang hampir tidak ada, sebanding dengan kontrol negatif. Juga untuk Del114 (Gambar 4b ), P_Wuhan2 menghasilkan hasil yang lebih efektif dalam mendeteksi A_Wuhan2 daripada A_alpha2 (yang memiliki respons yang tidak dapat dibedakan dari kontrol negatif), tetapi dalam kasus ini margin noise yang lebih rendah umumnya diperoleh. Hal ini dapat dikaitkan dengan karakter polimorfik yang lebih rendah dari urutan bermutasi sehubungan dengan urutan asli Wuhan, sementara tingkat respons yang lebih rendah sehubungan dengan percobaan sebelumnya telah dikaitkan dengan konten virus yang lebih rendah dalam sampel yang digunakan untuk ekstraksi templat, seperti yang juga diverifikasi oleh analisis probe TaqMan pada hasil PCR. Hasil rata-rata (Gambar 4c ) mengonfirmasi bahwa diskriminasi mutasi yang benar dapat direproduksi dengan baik melalui eksperimen independen, yang menunjukkan bahwa platform multi-sensor memungkinkan identifikasi yang jelas dari kemungkinan varian virus yang akan dieksplorasi lebih lanjut dengan pengurutan. Sebagai konfirmasi lebih lanjut pada hasil yang diperoleh, percobaan yang sama telah dilakukan dengan menggunakan probe yang melengkapi urutan bermutasi (P_Alpha1 untuk Del69 dan P_Alpha2 untuk Del114): hasil, dilaporkan pada Gambar S6 (Informasi Pendukung), pada dasarnya sama dengan percobaan sebelumnya, bahkan jika amplitudo respons sedikit lebih rendah, mungkin karena sifat termodinamika yang lebih rendah dari probe bermutasi karena area hibridisasi sendiri dari urutan tersebut.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Diskriminasi varian berbasis OCMFET: a) Persentase representatif variasi arus dalam waktu untuk perangkat yang difungsikan dengan probe P_Wuhan1 yang terpapar pada kontrol negatif (hitam), amplikon bermutasi A_Alpha1 dengan delesi Del69 (merah) dan amplikon komplementer A_Wuhan1 (biru). b) Persentase representatif variasi arus dalam waktu untuk perangkat yang difungsikan dengan probe P_Wuhan2 yang terpapar pada kontrol negatif (hitam), amplikon bermutasi A_Alpha2 dengan delesi Del114 (merah) dan amplikon komplementer A_Wuhan2 (biru). c) Rata-rata variasi arus yang diperoleh dalam tiga eksperimen independen untuk setiap konfigurasi probe-amplikon.
3 Kesimpulan
Dalam makalah ini, deteksi elektronik RNA virus dengan menggunakan sensor berbasis elektronik organik telah dibahas. Strategi yang diusulkan cocok untuk pengenalan RNA genomik yang diekstrak dari sampel manusia tanpa perlu amplifikasi PCR, mengintegrasikan analisis uji antigenik yang mudah digunakan dan cepat dengan selektivitas dan sensitivitas pengenalan molekuler. Kombinasi sensor hibridisasi DNA yang sangat sensitif dan selektif dengan probe PNA memungkinkan demonstrasi deteksi RNA genomik dalam rentang femtomolar, yang sebanding dengan kekuatan virus khas positif yang terdeteksi dini dengan pendekatan berbasis PCR. Pendekatan yang sama menghasilkan hasil yang efektif dalam membedakan varian berdasarkan ketahanan sistem sensor-PNA terhadap polimorfisme. Dua sekuens SARS-CoV-2 yang berbeda, dengan konten polimorfik terbatas, berhasil dikenali, sehingga menunjukkan potensi pendekatan yang diusulkan dalam bertindak sebagai prosedur penyaringan untuk memilih sampel yang akan dieksplorasi lebih lanjut untuk pengurutan lengkap guna pelacakan varian yang efektif. Perlu dicatat bahwa hasil yang diusulkan menunjukkan fungsionalitas pendekatan yang diusulkan pada tingkat pembuktian konsep. Namun, analisis yang lebih mendalam tentang kinerja sensor, termasuk ukuran sampel yang signifikan secara statistik dan eksperimen kontrol, diperlukan untuk mengkarakterisasi fitur perangkat secara lengkap. Meskipun ada keterbatasan saat ini, penerapan biosensing elektronik yang inovatif dalam deteksi dan pelacakan virus yang dilaporkan di sini dapat menginspirasi strategi baru untuk manajemen pandemi dan krisis epidemi yang lebih efektif dan mudah, mengoptimalkan efektivitas biaya dan kesederhanaan persiapan dan penanganan sampel dengan deteksi dini yang cepat dan selektif serta pelacakan varian.
4 Bagian Eksperimen
Pembuatan Perangkat
Platform penginderaan berbasis OCMFET telah dibuat pada substrat polietilena tereftalat (PET, Goodfellow) setebal 175 µm dalam struktur gerbang bawah dan kontak bawah. Setiap platform menampung tiga OCMFET independen, yang digunakan untuk uji diferensial. Substrat telah dibersihkan dengan aseton, isopropil alkohol, dan air deionisasi, sebelum pengendapan lapisan aluminium setebal 100 nm melalui penguapan termal pada tekanan 10 −5 Torr. Struktur gerbang apung pertama-tama ditentukan oleh proses fotolitografi standar, dan kemudian diawetkan pada suhu 50 °C selama 12 jam untuk memperoleh lapisan permukaan aluminium oksida. Kemudian, deposisi uap kimia dari lapisan Parylene C (Specialty Coating Systems) setebal 170 nm dilakukan: dielektrik hibrida aluminium-Parylene C memiliki kapasitansi per satuan luas sebesar 15 nFcm −2 , yang memastikan pengoperasian tegangan rendah pada perangkat. Struktur transistor, kapasitor kontrol, dan area penginderaan dibuat dengan penguapan termal emas (tekanan 10 −5 Torr) dan pola fotolitografi: khususnya, proses penyelarasan sendiri digunakan untuk mengurangi tumpang tindih sumber/drainase dengan gerbang mengambang untuk sensitivitas OCMFET yang lebih baik. [ 28 ] Fitur geometris tata letak akhir dilaporkan dalam Tabel S2 (Informasi Pendukung). Transistor diselesaikan dengan pengecoran tetes larutan 1 wt.% 6,13-Bis(triisopropylsilylethynyl)pentacene ≥99% (TIPS pentacene, Sigma Aldrich) dalam anisol anhidrat (Sigma Aldrich), dibiarkan kering pada suhu ruangan dan kondisi sekitar. Ruang fluida akrilonitril butadiena stirena (ABS, Innofil) yang dicetak 3D (menggunakan Makerbot Replicator 2x, Makerbot) direkatkan pada area penginderaan menggunakan lem berbasis poli(dimetilsiloksan) (PDMS, Sylgard 186, Dow Corning). Bagian atas ruang fluida ditutup dengan lapisan PDMS transparan (Sylgard 184, Dow Corning). Untuk meningkatkan masa simpan dan meningkatkan stabilitas kinerja listrik selama percobaan, perangkat dienkapsulasi dengan lapisan Parylene C setebal 2 µm: enkapsulasi area penginderaan dicegah oleh ruang fluida, sehingga memastikan permukaan emas bebas untuk fungsionalisasi perangkat. Evaluasi biaya proses fabrikasi pada skala semi-industri dari teknologi yang diusulkan, yang dirinci dalam Informasi Tambahan, adalah sekitar 0,04 Euro cm −2 , dengan biaya untuk satu perangkat dalam kisaran 0,81 Euro (lihat Informasi Pendukung untuk analisis terperinci biaya produksi).
Desain probe untuk deteksi genom RNA SARS-CoV-2
Wilayah target 120 nukleotida, yang sesuai dengan bagian dari 25.860 hingga 26.009 nt dalam gen ORF3a virus dari genom referensi SARS-CoV-2 Wuhan-Hu-1 (ID GenBank NC_045512.2), dipilih menggunakan pencarian BLAST versus basis data nukleotida dan Betacoronavirus berdasarkan homologi paling sedikit dengan sekuens lainnya. Tiga area berbeda dari sekuens ini dengan sifat termodinamika berbeda dipilih dengan memvariasikan konten GC-nya untuk merancang probe komplementer untuk penangkapan target (P1, P2, dan P3). Probe PNA yang komplementer dengan wilayah ini, dan sekuens RNA sintetis 120 bp, dibeli oleh Panagene.
Desain Amplikon dan Probe untuk Pelacakan Varian
Oligo DNA yang digunakan dalam penelitian ini dirancang menggunakan isolat tipe liar Wuhan-Hu-1, nomor akses GenBank NC_045512.2, dan urutan isolat klinis Cagliari335, varian alfa, ID GISAID EPI_ISL_2885744. Urutan referensi Cagliari335 yang disebutkan sebelumnya diperoleh dari usapan hidung yang sebelumnya dinyatakan positif SARS-CoV-2 dengan menggunakan kit real-time PCR Genesis (Primerdesign Ltd., Inggris, siklus ambang batas 15,00). Untuk pengurutan NGS, kit sintesis cDNA SuperScript VILO (Invitrogen, Carlsbad, CA, AS) digunakan untuk membuat cDNA menggunakan 10 µl ekstrak RNA, mengikuti petunjuk pabrik. Prosedur NGS dilakukan dengan menggunakan Instrumen NGS Ion Torrent dengan pengurutan panel AmpliSeq Ion torrent (Thermo Fisher Scientific, AS).
Dua wilayah dari urutan gen protein lonjakan dipertimbangkan dalam urutan Wuhan-Hu-1 dan Cagliari335, yang dicirikan oleh jumlah maksimum basa yang tidak cocok: wilayah pertama yang terdiri dari 73 bp, di mana varian alfa menunjukkan delesi 6 bp (selanjutnya, Del69), dan wilayah kedua yang terdiri dari 86 dengan delesi 3 bp dalam varian alfa (selanjutnya, Del114). Amplikon untuk Wuhan-Hu-1 dan Cagliari335 di dua wilayah (A_Wuhan1 dan A_Wuhan2, dan A_alpha1 dan A_alpha2, untuk Del69 dan Del114 masing-masing) diperoleh melalui reaksi PCR, yang dilakukan menggunakan TaqPathTM 1-Step RRT-PCR MasterMix (Life Technologies, Corp di Carlsbad, Carlsbad, CA, AS) dan mempertimbangkan petunjuk pembuatan. Selain itu, urasil–DNA–glikosilase yang tidak tahan panas (UDG, Roche Molecular Biochemicals) dan 2 L ekstrak RNA digunakan. Profil PCR, yang dilakukan dengan menggunakan peralatan CFX 96 (laboratorium Bio-Rad AS), adalah sebagai berikut: i) inkubasi urasil–DNA–glikosilase (UNG) awal pada suhu 25 °C selama 2 menit, ii) inkubasi RT pada suhu 50 °C selama 15 menit dan iii) 40 siklus 3 detik pada suhu 95 °C, 30 detik pada suhu 60 °C. Amplikon PCR (sekitar rata-rata 158 bp) digunakan sebagai target untuk eksperimen elektrokimia. Untuk memastikan tidak adanya produk PCR sekunder yang potensial, produk PCR dianalisis dengan elektroforesis gel agarosa 0,8%.
Empat urutan probe PNA dengan demikian dirancang (dan dibeli oleh Panagene) untuk mengikat amplikon yang disebutkan di atas: P_Wuhan1 dan P_Wuhan2 untuk amplikon yang diperoleh dari Wuhan-Hu-1, dan P_alpha1 dan P_alpha2 untuk amplikon virus yang bermutasi dengan penghapusan Del49 dan Del114.
Fungsionalisasi Sensor
Fungsionalisasi area penginderaan dengan probe PNA dilakukan dengan memaparkan permukaan emas ke larutan 25 mm larutan penyangga fosfat (PBS), 25 mm natrium klorida (NaCl), yang mengandung probe PNA pada konsentrasi 10 µ m dan 1-merkapto-6-heksanol (MCH, Sigma Aldrich) pada konsentrasi 1 µ m . Untuk deteksi RNA genomik, campuran probe PNA P1, P2 dan P3 (dengan konsentrasi total 10 µ m ) digunakan; untuk deteksi amplikon, satu probe digunakan. Molekul MCH adalah ko-molekul terkenal yang digunakan untuk mengoptimalkan halangan sterik dan morfologi film probe dari penangkapan target yang efektif. Untuk memastikan pembentukan ikatan kimia dan penataan ulang probe pada permukaan, area penginderaan terpapar ke larutan fungsionalisasi setidaknya selama 12 jam, kemudian dibilas dengan PBS murni untuk menghilangkan molekul yang teradsorpsi secara spesifik.
Persiapan Fragmen RNA Genom
Tiga sampel berbeda dipertimbangkan untuk eksperimen deteksi RNA genomik. Kontrol positif untuk usapan tenggorokan, yang mengandung RNA virus lengkap dari virus SARS-CoV-2 Wuhan, digunakan sebagai templat untuk persiapan larutan pada kepadatan molekul yang berbeda (dari 10 5 hingga 10 2 molekul per mikroliter). Kontrol negatif, yaitu ekstrak murni dari usapan tenggorokan pasien yang negatif, juga digunakan. Kedua sampel disonikasi dalam air dingin menggunakan manik-manik kaca selama 70 menit, bergantian 30 detik sonikasi aktif dengan 30 detik waktu istirahat, untuk mendapatkan fragmen RNA sepanjang 150 bp, mengikuti protokol yang tersedia. [ 29 ]
Karakterisasi Listrik
Kinerja perangkat awalnya dievaluasi dengan mengukur kurva karakteristik transistor dan mengekstrapolasi angka-angka manfaat seperti tegangan ambang batas dan mobilitas pembawa muatan. Pengukuran telah dilakukan dengan menggunakan Keithley SourceMeter 2636, yang dikontrol oleh perangkat lunak Matlab khusus. Pengukuran deteksi hibridisasi telah dilakukan dalam kondisi sekitar menggunakan instrumentasi yang sama, dengan mengukur arus drain secara real time pada tegangan drain-ke-sumber tetap (V DS = – 5 V) dan dengan tegangan gate-ke-sumber variabel gelombang persegi, yang digunakan untuk meminimalkan tegangan bias. [ 30 ] Nilai tegangan gate disesuaikan untuk membiaskan perangkat yang berbeda pada kondisi overthreshold yang sama: pengaturan tipikal adalah V GS,ON =-3 V, V GS,OFF , 0, frekuensi 2,5 Hz, siklus kerja 30%.
Pernyataan Etika
Semua sampel manusia berasal dari prosedur penyaringan pandemi COVID-19 yang dilakukan di “Azienda Ospedaliera Universitaria” Universitas Cagliari; sebagai rumah sakit pendidikan, semua formulir persetujuan yang ditandatangani saat penyaringan mencakup kemungkinan untuk menggunakan data klinis, biokimia, dan pencitraan bahkan untuk tujuan penelitian. Dalam perspektif ini, persetujuan etika formal oleh Dewan Peninjau Independen tidak diperlukan sesuai dengan kebijakan Lembaga untuk studi retrospektif non-intervensional (observasional) mengenai klinis/biokimia/pencitraan. Selain itu, sampel yang digunakan sebagai urutan target, atau templat untuk produksi amplikon, dianonimkan. Oleh karena itu, prosedur pengumpulan dan pengelolaan sampel mematuhi prinsip-prinsip Deklarasi Helsinki.





Tinggalkan Balasan