ABSTRAK
Dalam dekade terakhir, dengan memadukan analisis eksperimental dan komputasional, ditunjukkan bahwa ikatan halogen (HaB) dapat berkontribusi pada mekanisme pengikatan dan enantiorecognition yang mendasari enantioseparasi HPLC analit kiral terhalogenasi dengan menggunakan kolom kiral berbasis selulosa tris (3,5-dimetilfenilkarbamat) (CDMPC) dan campuran berbasis n -heksana sebagai fase gerak. Ketika digunakan sebagai komponen penting dari fase gerak dalam kromatografi fluida superkritis (SFC), karbon dioksida sering dianggap sebagai pelarut nonpolar seperti n -heksana karena konstanta dielektriknya yang rendah dan momen dipol molekuler nol. Di sisi lain, karbon dioksida juga dapat berfungsi sebagai ikatan hidrogen (HB) dan akseptor HaB karena adanya elektron nonikatan pada dua atom oksigen, berinteraksi dengan enantiomer analit, penyeleksi kiral, dan pelarut bersama. Atas dasar ini, kami melaporkan di sini hasil dari sebuah studi yang bertujuan untuk mengevaluasi dampak penggunaan karbon dioksida dalam SFC sebagai pengganti n -heksana dalam HPLC pada enantioseparasi bergantung halogen dengan menggunakan 4,4′-bipiridina terhalogenasi atropisomerik sebagai analit dan Lux Cellulose-1 sebagai kolom kiral berbasis CDMPC. Investigasi eksperimental dilengkapi dengan studi komputasi yang dilakukan dengan menggunakan (a) perhitungan mekanika kuantum (QM) untuk memetakan dan mengukur interaksi nonkovalen yang mungkin mendasari kontak analit dengan karbon dioksida dan dengan gugus liontin khas CDMPC dan (b) simulasi dinamika molekuler (MD) untuk memvisualisasikan interaksi nonkovalen yang bekerja dalam sistem kromatografi analit 1 /CDMPC di media yang berbeda. Penggunaan simulasi MD untuk memodelkan enantioseparasi yang dilakukan dalam media berbasis karbon dioksida belum dilaporkan dalam literatur sejauh ini.
Singkatan
2-PrOH
propan-2-ol
CAM-B3LYP
Metode atenuasi Coulomb-fungsional pertukaran tiga parameter Becke dengan fungsional korelasi Lee-Yang-Parr
CDMPC
selulosa tris (3,5-dimetilfenilkarbamat)
Bahasa Indonesia: DFT
teori fungsional kepadatan
EEO
urutan elusi enantiomer
gd3
Versi D3 dari koreksi dispersi Grimme
Bahasa Inggris HaB
ikatan halogen
Bahasa Inggris
ikatan hidrogen
Bahasa Indonesia: LanL2DZ
Laboratorium Nasional Los Alamos 2 ganda-ζ
Dokter
dinamika molekul
MDMPC
metil tris (3,5-dimetilfenilkarbamat)
AkuOH
metanol
QM
mekanika kuantum
SFC
kromatografi fluida superkritis
1 Pendahuluan
Interaksi nonkovalen memainkan peran kunci dalam ilmu pemisahan dan enantioseparasi [ 1 ]. Dalam sebagian besar enantioseparasi kromatografi, penyeleksi kiral yang dihubungkan ke fase stasioner mengikat enantiomer, mengenali perbedaan dalam struktur tiga dimensinya, dan membuatnya berdiferensiasi secara termodinamika dan kinetik melalui pembentukan kompleks diastereomerik sementara. Dalam kromatografi fase cair, proses ini terjadi dengan adanya fase mobil, dan interaksi nonkovalen inter dan intramolekul enantioselektif dan nonenantioselektif [ 2 , 3 ] dapat berkontribusi pada proses pengikatan dan pengenalan yang menghasilkan enantioseparasi analitis [ 1 , 4 ]. Semua komponen sistem enantioseparasi, analit kiral, penyeleksi kiral, dan fase mobil, terlibat dalam interaksi nonkovalen, dan fase mobil dapat memodulasi kekuatan interaksi ini secara halus. Lebih jauh lagi, mengubah sifat fase mobil dapat menyebabkan modifikasi yang luar biasa dari konformasi penyeleksi kiral. Hal ini khususnya berlaku untuk penyeleksi berbasis polisakarida [ 5 , 6 ]. Meskipun ikatan hidrogen (HB) dan interaksi π─π telah memainkan peran penting dalam ilmu enantioseparasi [ 1 , 7 , 8 ], dan desain berbasis HB memberikan kontribusi yang kuat terhadap kemajuan kiroteknologi dan pengembangan metode di bidang ini [ 1 , 8 , 9 ], seiring waktu interaksi nonkovalen lainnya seperti ikatan halogen (HaB) [ 10 – 12 ] dan ikatan kalkogen [ 13 ], bersama dengan gaya dispersi dan hidrofobik [ 14 ], menarik minat yang memperluas skenario gaya nonkovalen yang berpotensi bekerja dalam enantioseparasi kromatografi.
Teknik kromatografi terbukti sangat sensitif untuk mendeteksi interaksi nonkovalen lemah dibandingkan dengan teknik analisis lainnya [ 15 ] karena teknik ini didasarkan pada langkah-langkah adsorpsi-desorpsi berulang yang memperkuat efek interaksi nonkovalen dan, akibatnya, kemampuan deteksinya [ 1 ]. Lebih jauh lagi, fitur ini menjadikan parameter kromatografi cocok sebagai data tolok ukur untuk memvalidasi alat komputasi dan pendekatan yang digunakan untuk menjelaskan dan memahami proses enantioseparasi pada tingkat molekuler [ 16 – 19 ].
Berdasarkan rekomendasi dari International Union of Pure and Applied Chemistry [ 20 , 21 ], HaB terjadi ketika ada bukti interaksi tarik menarik bersih antara daerah elektrofilik yang terkait dengan atom halogen dalam entitas molekuler dan daerah nukleofilik dalam entitas molekuler lain, atau yang sama. Kekuatan interaksi nonkovalen terarah ini bergantung pada sifat atom halogen (donor HaB) sebagai akseptor kerapatan muatan elektron dan basa Lewis (akseptor HaB) sebagai donor kerapatan muatan elektron [ 21 ], dan meningkat dalam urutan Cl < Br < I. Atas dasar ini, iodin dianggap sebagai donor HaB yang kuat karena polarisabilitasnya yang tinggi dan adanya daerah penipisan kerapatan elektron yang besar pada pemanjangan ikatan kovalen yang melibatkan atom iodin. HaB dapat berupa tipe van der Waals, lemah, kuat, atau sangat kuat, dengan energi pengikatan berkisar antara −0,01 dan −100 kkal mol −1 [ 22 ]. Rentang energi HaB antara entitas molekul netral yang berinteraksi sering kali antara −0,01 dan −8,0 kkal mol −1 . Meskipun diidentifikasi pada awal abad ke-19 [ 23 ], HaB terus menarik minat besar dalam rekayasa kristal dan kimia supramolekul dan diidentifikasi dalam banyak sistem kimia dan biologi [ 23 – 25 ].
Dipelajari dalam beberapa bidang kimia analitik selama 20 tahun [ 9 , 26 , 27 ], HaB diidentifikasi dalam kromatografi enantioseparasi fase cair 10 tahun yang lalu [ 28 , 29 ]. Dengan menggunakan n -heksana/2-PrOH 90:10 v/v sebagai fase mobil dan kolom kiral berbasis selulosa tris (3,5-dimetilfenilkarbamat) (CDMPC), teknik HPLC sangat sensitif untuk mendeteksi HaB sebagai interaksi nonkovalen yang berkontribusi pada enantioseparasi 4,4′-bipiridina heksahalogenasi 2,2′,3,3′,5,5′-kiral aksial seperti 1–3 (Gambar 1A ). Dalam kasus ini, derajat enantioselektivitas jelas bergantung pada sifat elektrofilik atom klorin, bromin, dan iodin yang menampilkan analit yang digunakan sebagai probe uji dan donor HaB, dengan oksigen karbonil dari CDMPC berfungsi sebagai akseptor HaB di sisi lain (Gambar 1B ). Akibatnya, HaB ditemukan berkontribusi pada mekanisme pengikatan dan enantiorecognition yang mendasari enantioseparasi ini (Gambar 1C ), mengamati bahwa nilai retensi dan selektivitas meningkat mengikuti urutan Cl < Br < I (Gambar 1D , batang hitam). Juga diamati bahwa retensi dan selektivitas yang diperoleh untuk enantioseparasi 4,4′-bipiridina terhalogenasi sangat berkurang dengan memperkenalkan MeOH dalam fase mobil (Gambar 1D , batang abu-abu). Efeknya cukup karena HB kompetitif antara MeOH dan atom oksigen karbonil dari penyeleksi kiral juga berfungsi sebagai akseptor HB, menghasilkan ketersediaan situs ini yang berkurang sebagai akseptor HaB.
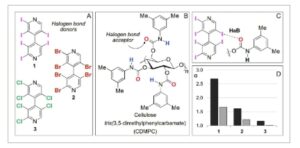
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Struktur 4,4′-bipiridina 1–3 yang diheksahalogenasi 2,2′,3,3′,5,5′ (A) dan selulosa tris (3,5-dimetilfenilkarbamat) (CDMPC) (B), deskripsi ikatan halogen (HaB) antara analit 1 dan kerangka 3,5-dimetilfenilkarbamat (C), dan perbandingan faktor pemisahan ( α ) yang diperoleh untuk 4,4′-bipiridina 1–3 dengan Lux Cellulose-1 (CDMPC) dengan menggunakan n -heksana/2-PrOH 90:10 v/v (batang hitam) dan n -heksana/2-PrOH/MeOH 90:5:5 v/v/v (batang abu-abu) sebagai fase gerak (D) (Tabel S1 untuk data numerik [ 15 ]) (laju alir = 0,8 mL min -1 , T = 25°C).
Karbon dioksida bertekanan nonpolar, digunakan sebagai komponen dasar fase mobil dalam kromatografi fluida superkritis (SFC), sering dianggap sebagai pelarut seperti n -heksana sehubungan dengan kekuatan elusinya [ 30 ]. Namun, pada tingkat molekuler, karbon dioksida tidak benar-benar seperti n- heksana karena memiliki dipol lokal, elektron π, dan elektron nonikatan [ 31 ]. Lebih jauh lagi, perhitungan teoritis dan data eksperimen terkait mengkonfirmasi bahwa karbon dioksida dapat berpartisipasi dalam HB konvensional dan nonkonvensional [ 32 ] dan membentuk HaB (O═C═O···X, X═Cl, Br, I) di mana ia bertindak sebagai akseptor HaB [ 33 , 34 ].
Atas dasar ini, kami melaporkan hasil penyelidikan tentang enantioseparasi SFC dari 4,4′-bipiridina polihalogenasi 1–3 pada kolom kiral berbasis CDMPC. Kami bertujuan untuk mengevaluasi dampak perubahan n -heksana menjadi karbon dioksida sebagai komponen utama fase gerak pada enantioseparasi 1–3 ketika SFC digunakan sebagai teknik kromatografi sebagai pengganti HPLC. Dengan kata lain, kami menggunakan teknik SFC untuk mengevaluasi (a) apakah nilai retensi dan selektivitas yang diperoleh dalam SFC dengan menggunakan campuran CO2 / 2-PrOH sebagai fase mobil dapat dikorelasikan dengan sifat elektrofilik substituen halogen yang meningkat mengikuti urutan Cl < Br < I, seperti yang telah diamati dalam HPLC dengan menggunakan n -heksana/2-PrOH 90:10 v/v sebagai fase mobil, (b) dampak perubahan n -heksana menjadi karbon dioksida pada enantioseparasi 4,4′-bipiridina terhalogenasi 1–3 , dan (c) dampak penambahan MeOH ke fase mobil pada enantioseparasi SFC 4,4′-bipiridina 1–3 . Lebih jauh, mekanika kuantum (QM) dan dinamika molekuler (MD) digunakan sebagai teknik komputasi secara komplementer untuk menjelaskan data eksperimen pada tingkat molekuler. Memang, perhitungan QM memungkinkan untuk mengukur interaksi nonkovalen dengan akurasi yang lebih tinggi dibandingkan dengan simulasi MD. Di sisi lain, teknik MD lebih cocok untuk menggambarkan efek pelarut eksplisit dan fitur dinamis dari proses enantioseparasi.
2 Komputasional
2.1 Mekanika Kuantum
Struktur 3D dari ( M )- dan ( P )-enantiomer dari 4,4′-bipiridina 1–3 , karbon dioksida, metil 3,5-dimetilfenilkarbamat (MDMPC), dan kompleks terkait dihasilkan dengan menggunakan fungsi bangun dan model kit serta alat yang disediakan oleh GaussView 6.1 [ 35 ] untuk membangun dan mengedit molekul organik. Semua struktur yang digunakan dalam studi ini dioptimalkan pada level teori fungsi kerapatan (DFT) dalam fase gas dengan menggunakan Gaussian 16W [ 36 ], dengan fungsi korelasi-pertukaran hibrid menggunakan metode redaman Coulomb CAM-B3LYP, LanL2DZ (Los Alamos National Laboratory 2 double-ζ) sebagai basis set tipe potensial inti efektif, dan versi D3 dari koreksi dispersi Grimme ( gd3 ). Untuk setiap struktur, frekuensi vibrasi juga dihitung untuk memvalidasi proses optimasi. Untuk kompleks ( P )- 1–3 dengan karbon dioksida dan dengan MDMPC, kesalahan superposisi basis set (BSSE) dikoreksi dengan metode penyeimbang standar Boys dan Bernardi [ 37 ]. Energi interaksi (Δ E int ) dilaporkan dalam kkal mol −1 . Parameter geometris, jarak [Å], dan sudut (°) diukur dengan menggunakan alat yang disediakan oleh GaussView 6.1 [ 35 ]. Kekuatan HaB dan HB dievaluasi dengan mempertimbangkan persentase derajat penetrasi bola van der Waals dari atom-atom yang berinteraksi [parameter penetrasi, pp % elektrofil … nukleofil = 100 × {( d El…Nu )/( r vdW El + r vdW Nu) − 1}, di mana d El…Nu adalah jarak interatomik antara atom-atom yang berinteraksi dengan sifat sebagai elektrofil dan nukleofil, dan r vdW adalah jari-jari van der Waals yang sesuai]. Untuk r vdW dari Br, Cl, H, I, N, dan O, nilai yang diberikan oleh Bondi dipertimbangkan [ r vdW : 1,85 Å (Br), 1,75 Å (Cl), 1,20 Å (H), 1,98 Å (I), 1,55 Å (N), 1,52 Å (O)] [ 38 ].
2.2 Dinamika Molekuler
Perangkat lunak AMBER24 [ 39 ] digunakan untuk melakukan simulasi MD 100 ns, dan perangkat lunak Chimera (UCSF, San Francisco, AS) digunakan untuk visualisasi dan analisis lintasan MD [ 40 ]. Rincian MD dilaporkan di bagian Informasi Pendukung.
3 Bahan dan Metode
3.1 Bahan Kimia dan Fase Stasioner Kiral
2,2′,3,3′,5,5′-Hexahalogenated 4,4′-bipyridines 1–3 disiapkan dan dikarakterisasi seperti yang dilaporkan sebelumnya [ 41 ]. Lux Cellulose-1 (CDMPC, 3 µm) (Phenomenex Inc., Torrance, CA, AS) digunakan sebagai kolom kiral (250 × 4,6 mm). n -heksana tingkat HPLC dibeli dari Sigma-Aldrich (Taufkirchen, Jerman). Metanol (MeOH) dan 2-propanol (2-PrOH) dibeli dari Carlo-Erba (Val-de-Reuil, Prancis) dan karbon dioksida (CO 2 , kemurnian 99,995%) dari Air Liquide (Loos, Prancis).
3.2 Sistem Kromatografi
Sistem HPLC Seri 1100 Agilent Technologies (Waldbronn, Jerman) (sistem gradien biner bertekanan tinggi yang dilengkapi dengan detektor susunan dioda [DAD] yang beroperasi pada beberapa panjang gelombang [220, 254, 280, dan 360 nm], autosampler yang dapat diprogram dengan loop 20-µL, dan kompartemen kolom termostat) digunakan. Akuisisi dan analisis data dilakukan dengan perangkat lunak data kromatografi Agilent Technologies ChemStation Versi B.04.03.
Sistem kromatografi yang digunakan untuk analisis SFC adalah peralatan hibrida SFC-PICLAB 10–20 (PIC Solution, Avignon, Prancis) yang dilengkapi dengan autosampler yang terdiri dari pelat 48 vial (model Alias, Emmen, Belanda), tiga pompa model 40 P: dua untuk CO 2 dan yang ketiga untuk pengubah (Knauer, Berlin, Jerman), oven kolom dengan katup pemilihan kolom sepuluh posisi Valco, dan katup pengalih pelarut enam posisi Valco. Sistem ini juga terdiri dari Knauer Smartline 2600 DAD (Berlin, Jerman). Panjang gelombang deteksi ditetapkan pada 254 nm. Sistem dikontrol, dan data diperoleh dengan perangkat lunak SFC-PICLAB Analytic Online v.3.1.2 (PIC Solution, Avignon, Prancis). Waktu retensi adalah nilai rata-rata dari dua penentuan replikasi. Data diproses oleh perangkat lunak SFC New Data Manager V.1.8.0 (PIC Solution, Avignon, Prancis).
3.3 Kondisi Kromatografi dan Persiapan Sampel
Untuk analisis SFC, volume yang disuntikkan adalah 20 µL, laju alir yang digunakan adalah 1,5 mL min -1 , dan fase mobil selalu berupa campuran pengubah CO 2 dengan berbagai persentase MeOH atau 2-PrOH sebagai pengubah. Semua analisis dijalankan dalam mode isokratik. Suhu oven kolom adalah 40°C, dan tekanan outlet dipertahankan pada 120 bar untuk semua percobaan. Sampel disiapkan pada 1 mg mL -1 dalam MeOH. Larutan disaring melalui filter jarum suntik PTFE 0,45 µm (diameter 15 mm) sebelum digunakan. Analisis HPLC dilakukan dalam mode isokratik pada 22°C. Laju alir ditetapkan pada 0,8 mL min -1 . Ordo elusi enantiomer (EEO) untuk pemisahan enantiomer senyawa 1–3 ditentukan dengan menyuntikkan enantiomer murni dengan konfigurasi absolut ( M ) atau ( P ) yang diketahui [ 41 ].
4 Hasil dan Pembahasan
4.1 Pemisahan SFC dari 4,4′-Bipiridin Terhalogenasi 1–3
Pemisahan enantioseparasi SFC senyawa 1–3 dilakukan dengan menggunakan Lux Cellulose-1 sebagai kolom kiral dengan campuran karbon dioksida/2-PrOH sebagai fase gerak dengan kandungan aditif alkohol berkisar antara 50% hingga 10% (Gambar 2 , garis hitam). Sesuai dengan hasil yang diperoleh dalam pemisahan enantioseparasi HPLC 1–3 pada Lux Cellulose-1 [ 29 ], dalam SFC baik retensi dan selektivitas juga menunjukkan ketergantungan halogen, meningkat mengikuti urutan Cl < Br < I. Dengan demikian, interaksi berbasis iodin tampaknya berkontribusi secara signifikan terhadap mekanisme pengikatan dan enantiorecognition. Hal ini terbukti bahkan dengan menggunakan campuran yang kaya akan aditif alkohol seperti karbon dioksida/2-PrOH 50:50 v/v sebagai fase gerak (Gambar 3 ). Waktu retensi yang sangat tinggi diperoleh untuk 1 dengan menggunakan karbon dioksida/2-PrOH 70:30 v/v sebagai fase gerak ( t 1 = 66,99 menit; t 2 = 126,54 menit) dibandingkan dengan 2 dan 3. Elusi analit teriodinasi 1 tidak diperoleh dalam waktu 120 menit dengan menggunakan campuran dengan kandungan 2-PrOH yang lebih rendah sebagai fase gerak, seperti karbon dioksida/2-PrOH 80:20 atau 90:10 v/v.
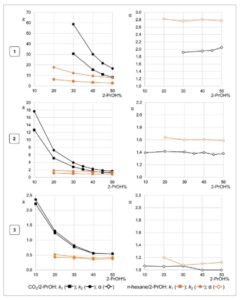
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Ketergantungan faktor retensi ( k ) dan pemisahan ( α ) rac – 1 , rac – 2 , dan rac – 3 pada kandungan 2-PrOH dalam campuran karbon dioksida/2-PrOH (garis hitam) dan n -heksana/2-PrOH (garis oranye) yang digunakan sebagai fase gerak dengan Lux Cellulose-1 sebagai kolom kiral dalam SFC (laju alir = 1,5 mL min −1 , T = 40°C) dan HPLC (laju alir = 0,8 mL min −1 , T = 22°C), masing-masing (untuk data numerik, Tabel S2 dan S3 ).
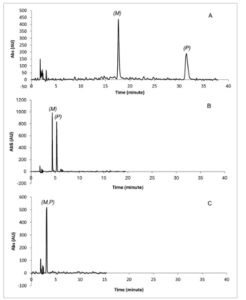
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
Pemisahan dan enantioseparasi rac – 1 (A), rac – 2 (B), dan rac – 3 (C) pada Lux Cellulose-1, karbon dioksida/2-PrOH 50:50, laju alir = 1,5 mL min −1 , T = 40°C, 150 bar, λ = 254 nm.
Faktor retensi ( k ) meningkat secara signifikan seiring dengan menurunnya kandungan 2-PrOH dalam fase mobil (dan peningkatan kandungan karbon dioksida) hingga tingkat yang bergantung pada atom halogen yang khas. Memang, dengan menurunkan kandungan 2-PrOH dalam fase mobil dari 50% menjadi 30%, persentase peningkatan faktor retensi enantiomer elusi pertama dan kedua adalah 278–254, 130–135, dan 42,6–51,8 untuk 1 , 2 , dan 3 , masing-masing. Dengan demikian, peningkatan kandungan karbon dioksida dalam fase mobil memiliki dampak yang lebih tinggi pada retensi iodin 1 dibandingkan dengan 4,4′-bipiridina 2 dan 3 .
Semua senyawa 1–3 menunjukkan ( M )–( P ) sebagai EEO, yang menunjukkan bahwa mekanisme pengikatan yang sama dapat diharapkan mendasari afinitas setiap analit terhadap fase stasioner kiral, dengan perbedaan terkait dengan sifat stereoelektronik dari analit yang berbeda.
Faktor pemisahan ( α ) menunjukkan ketergantungan yang dapat diabaikan pada kandungan alkohol dalam fase bergerak. Namun, perbedaan yang halus dapat diamati antara tren selektivitas senyawa 1 dan 3. Memang, dengan meningkatkan kandungan 2-PrOH dari 30% menjadi 50%, faktor pemisahan senyawa 1 juga meningkat dari 1,92 menjadi 2,05, sedangkan tren yang berlawanan dapat diamati untuk senyawa 3 dengan faktor pemisahan yang sedikit menurun dari 1,06 menjadi 1,00.
Analit 1–3 juga dipisahkan secara enantioseparasi dalam HPLC dengan menggunakan kolom kiral berbasis CDMPC yang sama dan campuran n -heksana/2-PrOH (20 ≤ 2-PrOH% ≤ 50) sebagai referensi untuk perbandingan (Gambar 2 , garis oranye). Faktor retensi yang lebih tinggi diperoleh dalam SFC dibandingkan dengan analisis HPLC. Atas dasar ini, karbon dioksida terbukti memengaruhi afinitas 4,4′-bipiridina terhalogenasi terhadap pemilih berbasis polisakarida dengan cara yang berbeda dibandingkan dengan n -heksana dan sampai batas tertentu bergantung pada jenis atom halogen yang berbeda. Memang, dengan mengubah kondisi analisis dari HPLC ( n- heksana/2-PrOH 70:30, T = 22°C) ke SFC (karbon dioksida/2-PrOH 70:30, T = 40°C), persentase kenaikan dan penurunan faktor retensi enantiomer elusi pertama dan nilai selektivitas berikut, masing-masing, dapat diamati: +586% dan −30,4% untuk 1 , +178,2% dan −12,5% untuk 2 , dan +92,5% dan −3,6% untuk 3 .
Berdasarkan hipotesis bahwa, dalam fase stasioner kiral berbasis CDMPC, atom oksigen karbonil merupakan akseptor bagi donor HaB dan HB, hasil kami konsisten dengan pengamatan yang dilaporkan oleh West dan rekan penulis bahwa kemampuan interaksi CDMPC terhadap donor HB lebih kuat di SFC dibandingkan dengan NPLC [ 42 ]. Di sisi lain, campuran karbon dioksida/alkohol dilaporkan heterogen, dengan molekul alkohol mengelompok di sekitar analit [ 42 ], dan kekuatan elusi dalam kondisi heterogen lebih tinggi daripada kekuatan yang diharapkan untuk campuran homogen. Lebih jauh lagi, baik karbon dioksida dan alkohol sebagai co-solvent diadsorpsi pada fase stasioner, berkontribusi pada modifikasi polaritas dan struktur tiga dimensinya [ 42 – 44 ].
Pengurangan selektivitas yang diamati dalam SFC dibandingkan dengan HPLC disebabkan oleh efek yang berbeda dari perubahan n -heksana menjadi karbon dioksida pada retensi enantiomer terelusi kedua dibandingkan dengan yang terelusi pertama. Misalnya, dengan mempertimbangkan fase gerak yang mengandung 30%, 40%, dan 50% 2-PrOH, faktor retensi rata-rata dari ( M )-enantiomer terelusi pertama dari 1 adalah lima kali lebih tinggi dalam SFC daripada yang ada dalam HPLC, sedangkan nilai rata-rata untuk enantiomer terelusi kedua adalah 3,6 kali lebih tinggi. Efek ini lebih tinggi untuk 1 dibandingkan dengan 2 (2 kali untuk k 1 dan 1,8 kali untuk k 2 ) dan 3 (1,6 kali untuk k 1 dan 1,5 kali untuk k 2 ), yang mengakibatkan penurunan selektivitas yang lebih tinggi dengan mengubah HPLC menjadi SFC. Pada tingkat molekuler, efek yang sama pada kedua enantiomer dapat diharapkan jika karbon dioksida bekerja sebagai n -heksana, berfungsi sebagai pelarut yang tidak berinteraksi. Sebaliknya, efek “enantioselektif” karbon dioksida dapat dipertimbangkan jika media ini memberikan dampak yang berbeda pada kompleks diastereomerik antara analit terhalogenasi dan pemilih kiral. Lebih jauh, perbedaan tingkat peningkatan waktu retensi yang bergantung pada jenis halogen (I > Br > Cl) dapat dikaitkan dengan pembentukan gugus solvasi halogen O═C═O… berbasis HaB. Di sisi lain, perbedaan yang diamati dengan mengubah n -heksana menjadi karbon dioksida juga dapat berasal dari interaksi karbon dioksida dengan gugus N─H amidik dari CDMPC yang memengaruhi selektivitas dan retensi.
Kami juga menyelidiki dampak perubahan 2-PrOH menjadi MeOH dalam fase gerak berbasis karbon dioksida yang digunakan dalam SFC (Tabel 1 ) dengan menggunakan kandungan MeOH berkisar antara 10% hingga 50%. Juga dalam kasus ini, waktu retensi meningkat seiring dengan menurunnya kandungan aditif alkohol, sedangkan ketergantungan nilai selektivitas pada kandungan MeOH dapat diabaikan. Dengan menggunakan fase gerak yang mengandung MeOH, nilai selektivitas menurun dalam semua kasus dibandingkan dengan yang diperoleh dengan campuran karbon dioksida/2-PrOH sampai batas tertentu mengikuti orde I > Br > Cl. Tren ini juga diamati dalam enantioseparasi yang digerakkan HaB yang dilakukan dalam HPLC [ 29 ].
TABEL 1. Waktu retensi ( t ), faktor retensi ( k ), dan faktor pemisahan ( α ) dari 4,4′-bipiridina 1–3 pada Lux Cellulose-1 [selulosa tris (3,5-dimetilfenilkarbamat)] dengan campuran karbon dioksida/2-MeOH sebagai fase gerak (laju alir = 1,5 mL min −1 , T = 40°C).
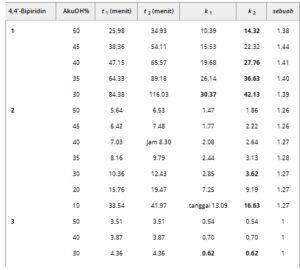
Catatan : Faktor retensi lebih rendah dengan fase gerak yang mengandung MeOH dibandingkan dengan media yang mengandung 2-PrOH (Tabel S2 ) dilaporkan dengan huruf tebal.
Berbeda, dalam kebanyakan kasus, faktor retensi meningkat dengan menggunakan MeOH sebagai komponen alkohol dari fase mobil kemungkinan karena kontribusi gaya hidrofobik atau dispersi terhadap retensi. Memang, interaksi hidrofobik lebih disukai dalam MeOH daripada dalam 2-PrOH [ 45 ]. Di sisi lain, polarisabilitas sistem kimia dapat berkorelasi dengan kemampuannya untuk mengerahkan interaksi berbasis dispersi mengingat mobilitas elektron yang lebih tinggi [ 46 ]. Dengan demikian, polarisabilitas MeOH lebih rendah daripada 2-PrOH, MeOH dapat mengerahkan persaingan yang lebih rendah untuk interaksi dispersi daripada 2-PrOH, meningkatkan interaksi tipe dispersi selektor-analit. Jika tidak, dalam beberapa kasus (disorot dengan huruf tebal di Tabel 1 ), terutama untuk enantiomer kedua yang dielusi dari senyawa 1 , faktor retensi dengan fase gerak yang mengandung MeOH menurun dibandingkan dengan fase gerak yang mengandung 2-PrOH sebagai pelarut bersama, kemungkinan karena kontribusi interaksi polar yang dilemahkan dengan menggunakan MeOH sebagai pelarut bersama.
Semua perbedaan halus yang diamati dengan mengubah n- heksana menjadi karbon dioksida dalam fase bergerak mengonfirmasi bahwa karbon dioksida, sebagai pelarut yang berinteraksi, berperilaku berbeda dibandingkan dengan n -heksana yang tidak berinteraksi dan menunjukkan bahwa interaksi yang bergantung pada halogen terjadi antara karbon dioksida dan analit 1–3 dalam lingkungan SFC.
4.2 Analisis Komputasional
Substituen halogen dapat berkontribusi pada pengenalan molekuler dengan memainkan banyak peran. Dengan demikian, kemungkinan pembentukan interaksi nonkovalen halogen O═C═O … memerlukan konfirmasi teoritis. Atas dasar ini, metode QM yang diterapkan dalam fase gas digunakan untuk mengidentifikasi dan mengukur O═C═O … I HaB dan kemungkinan interaksi nonkovalen lainnya yang mendasari kontak antara analit 1–3 dan kerangka metil 3,5-dimetilfenilkarbamat (MDMPC) sebagai model gugus liontin khas dari pemilih kiral CDMPC. Lebih jauh, simulasi MD juga digunakan untuk mengevaluasi dampak penggunaan karbon dioksida pada interaksi dinamis antara analit 1 dan nonamer virtual CDMPC dengan menggunakan parameterisasi eksplisit untuk virtualisasi pelarut. Dalam hal ini, perlu disebutkan bahwa simulasi MD dari enantioseparasi SFC yang memperlakukan karbon dioksida secara eksplisit belum dilaporkan sejauh ini.
Dalam penelitian sebelumnya, sifat elektrofilik atom halogen yang menampilkan analit 1–3 dievaluasi sebagai prasyarat untuk pembentukan HaB dan diukur melalui analisis potensial elektrostatik, yang mengonfirmasi karakter elektrofilik meningkat mengikuti urutan Cl < Br < I [ 15 , 26 ].
Dalam semua perhitungan, tidak ada batasan energi yang diterapkan pada mitra yang berinteraksi untuk memaksa mereka berada pada posisi tertentu.
4.2.1 Kuantifikasi Interaksi Nonkovalen dengan QM
Untuk memetakan kemungkinan interaksi nonkovalen antara analit 1–3 dan karbon dioksida sebagai padanan yang berinteraksi, kami menghitung struktur yang dioptimalkan DFT dari sembilan kompleks karbon dioksida/analit (Gambar S1 ) mulai dari sembilan struktur masukan yang dibangun dengan cara menambatkan satu molekul karbon dioksida secara manual di dekat setiap atom halogen pada posisi 2, 3, dan 5 dari perancah 4,4′-bipiridil. Mengingat simetri pola substitusi analit, posisi 2′-, 3′-, dan 5′- tidak dipertimbangkan. Pendekatan ini bertujuan untuk memberikan perkiraan jenis dan kekuatan interaksi nonkovalen yang terlibat dalam pembentukan kompleks. Di sisi lain, efek nonkovalen kooperatif atau anti-kooperatif dapat bekerja dalam sistem kromatografi nyata pada tingkat molekuler karena kemungkinan interaksi simultan analit dengan beberapa molekul pelarut dan gugus liontin dan dengan tulang punggung polimer.
Untuk memperoleh energi interaksi yang andal dan peta interaksi nonkovalen, dan mempertimbangkan keberadaan atom-atom iodin yang sangat terpolarisasi yang menampilkan analit 1 , kami menggunakan metode komputasi berdasarkan (a) fungsi CAM-B3LYP yang mencakup koreksi untuk interaksi jarak jauh seperti gaya dispersi, (b) versi D3 dari koreksi dispersi Grimme ( gd3 ), (c) LanL2DZ sebagai basis set tipe potensial inti efektif untuk mengganti elektron inti dengan potensial efektif dan, akibatnya, untuk menghindari penggunaan fungsi basis inti yang akan meningkatkan waktu komputasi, dan (d) metode penyeimbang standar Boys dan Bernardi untuk mengoreksi BSSE yang akan memengaruhi energi interaksi.
Pada Tabel 2 , interaksi nonkovalen yang mendasari pembentukan kompleks dilaporkan. HaB diamati dalam kompleks karbon dioksida/ 1 , secara eksklusif, dengan tingkat penetrasi bola van der Waals berkisar antara -6,17% hingga -7,69%.
TABEL 2. Interaksi nonkovalen dalam kompleks yang dioptimalkan teori fungsi kerapatan (DFT) antara 4,4′-bipiridina 1–3 dan CO 2 (legenda warna: karbon, abu-abu; hidrogen, abu-abu pucat; nitrogen, biru; oksigen, merah) (struktur tiga dimensi kompleks yang dioptimalkan dilaporkan dalam Gambar S1 ).
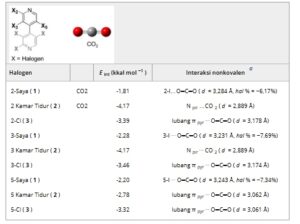
a pp % = 100 × {( d Ha⋅⋅⋅O )/( r vdW Ha + r vdW O) − 1}), di mana d Ha…O adalah jarak antar atom antara atom Ha dan O dan r vdW adalah jari-jari van der Waals yang sesuai.
Untuk kompleks karbon dioksida dengan 2 dan 3 , jenis interaksi nonkovalen lainnya dapat diamati tanpa keterlibatan langsung atom bromin atau klorin sebagai elektrofil. Untuk kedua analit ini, atom oksigen dari karbon dioksida lebih terlibat dalam interaksi nonkovalen yang melibatkan awan piridil π yang miskin elektron sebagai elektrofil. Hasil ini mungkin menunjukkan bahwa pembentukan O═C═O … halogen HaB mungkin benar-benar bertanggung jawab atas waktu elusi yang tinggi dan selektivitas yang lebih rendah yang diamati untuk analit 1 dalam SFC dibandingkan dengan HPLC, yang memengaruhi proses enantioseparasi dalam beberapa kemungkinan cara. Misalnya, gugus karbon dioksida/analit berdasarkan HaB dapat dibentuk, yang dapat memperlambat elusi analit di sepanjang permukaan fase stasioner kiral berbasis CDMPC. Selain itu, dalam fase gerak berbasis karbon dioksida, gugus juga dapat terbentuk di sekitar kompleks pemilih analit/kiral, yang dapat mengurangi kemampuan stereoelektronik kedua enantiomer untuk dibedakan dibandingkan dengan n -heksana yang tidak berinteraksi yang digunakan sebagai komponen utama fase gerak dalam HPLC. Di sisi lain, pembentukan HB antara karbon dioksida dan hidrogen amidik dari CDMPC (O═C═O…H─N<) dapat meningkatkan kemampuan akseptor HB dari pemilih kiral dan, akibatnya, kekuatan interaksi nonkovalen yang melibatkan atom oksigen karbonil sebagai akseptor HB atau HaB dan, pada gilirannya, afinitas analit terhadap fase stasioner. Kami juga menghitung struktur yang dioptimalkan DFT dari tiga set kompleks antara setiap analit dan MDMPC, dengan struktur masukan yang dibangun sebagai berikut: ( set 1 ) Kelompok karbonil MDMPC terletak di dekat setiap atom halogen pada posisi 2, 3, dan 5 (Gambar S2 ); ( set 2 ) gugus N─H amidik MDMPC terletak di dekat sabuk nukleofilik setiap atom halogen pada posisi 2, 3, dan 5 (Gambar S3 ); ( set 3 ) gugus N─H amidik terletak di dekat nitrogen piridil setiap analit sebagai akseptor HB (Gambar S4 ). Beberapa interaksi nonkovalen ditemukan mendasari sebagian besar kompleks analit/MDMPC (Tabel 3 ). Perlu dicatat bahwa dalam sistem nyata, interaksi nonkovalen dapat dipengaruhi oleh kendala stereoelektronik yang bekerja pada analit dalam alur polimer dan oleh efek solvasi. Misalnya, kemungkinan HB yang melibatkan atom halogen dari analit 1–3 sebagai akseptor HB diperkirakan agak lemah dan tidak disukai karena aksesibilitas yang rendah dari sabuk nukleofilik atom halogen ini untuk kemungkinan elektrofil sebagai donor HB (Gambar S5 ). Pertimbangan yang sama dapat menyangkut kemungkinan interaksi π-π yang melibatkan cincin piridil dari analit. Meskipun demikian, perhitungan QM dapat memberikan perkiraan interaksi nonkovalen yang bekerja dalam sistem kromatografi yang sedang diselidiki. Tiga puluh lima interaksi nonkovalen ditemukan dalam 21 kompleks yang dioptimalkan (n. 7 untuk setiap analit) dengan frekuensi berikut: HaB (n. 10) > interaksi penumpukan π–π (n. 9) > HB dengan pp % < 0 (n. 7) dan HB lemah dengan pp % > 0 (n. 7) > ikatan π-hole (n. 2). Frekuensi ini sesuai dengan hasil simulasi MD yang dilaporkan sebelumnya untuk kompleks 4,4′-bipiridina/CDMPC [ 15 ] di mana HaB, interaksi penumpukan π–π, dan HB terdeteksi dengan jelas. Lebih jauh lagi, data eksperimen telah membuktikan kontribusi utama atom oksigen karbonil dari gugus liontin karbamat dibandingkan dengan atom hidrogen amidik untuk enantioseparasi bergantung halogen yang dilakukan dengan menggunakan kolom kiral berbasis CDMPC [ 15 ]. Energi rata-rata yang dihitung untuk kompleks masing-masing analit yang berbeda menurun mengikuti urutan I > Cl > Br. HaB (I…O═C< dan I…ArMe 2 ) merupakan interaksi yang paling sering diidentifikasi dalam tujuh kompleks yang mengandung iodium.
Kompleks yang paling stabil melibatkan nitrogen piridil (N pyr …HN HB, −13,11 kkal mol −1 ) dan iodin pada posisi 3 dan 5 (−12,69 dan −12,56 kkal mol −1 , berturut-turut). Penelitian sebelumnya menunjukkan bahwa interaksi yang melibatkan situs yang terletak pada posisi 3,3′,5,5′, dekat dengan sumbu kiral, berkontribusi secara signifikan terhadap enantiorecognition [ 47 ]. Sebaliknya, kompleks yang didasari oleh I … H─N< HB, sehingga melibatkan hidrogen amidik MDMPC dan sabuk kaya elektron dari atom iodin sebagai akseptor HB, menunjukkan energi interaksi yang lebih rendah. Jika tidak, interaksi penumpukan π–π ditemukan sebagai interaksi yang paling sering terjadi dalam tujuh kompleks yang mengandung klorin, dan kompleks analit 3 yang paling stabil didasari oleh penumpukan ArMe 2 …piridil π–π. Untuk kompleks yang melibatkan analit 2 , distribusi yang luas antara lima jenis interaksi nonkovalen diperoleh, dengan prevalensi HaB dan HB dibandingkan interaksi penumpukan π–π.
Perhitungan QM ini dengan jelas menunjukkan bahwa atom iodin dari analit 1 dapat membentuk HaB dengan karbon dioksida dan gugus liontin CDMPC. Dalam hal ini, energi rata-rata yang lebih negatif dihitung untuk kompleks MDMPC/ 1 (−10,37 kkal mol −1 ) dibandingkan dengan yang dihitung untuk kompleks MDMPC/ 2 (−9,03 kkal mol −1 ) dan MDMPC/ 3 (−10,04 kkal mol −1 ). Dengan demikian, pengamatan ini mengonfirmasi, berdasarkan QM, kontribusi HaB dalam kontak analit-selektor, afinitas analit 1 yang lebih tinggi terhadap CDMPC, dan sifat interaktif karbon dioksida terhadap analit 1–3 .
TABEL 3. Interaksi nonkovalen dalam kompleks yang dioptimalkan teori fungsi kerapatan (DFT) antara 4,4′-bipiridina 1–3 dan metil 3,5-dimetilfenilkarbamat (MDMPC) (legenda warna: karbon, abu-abu; hidrogen, abu-abu pucat; nitrogen, biru; oksigen, merah) (struktur tiga dimensi kompleks yang dioptimalkan dilaporkan dalam Gambar S2–S4 ).
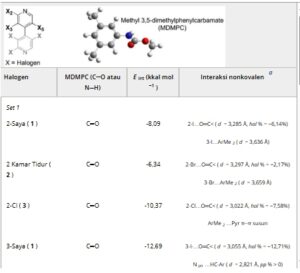
a pp % = 100 × {( d El…Nu )/( r vdW El + r vdW Nu) − 1}), di mana d El…Nu adalah jarak antar atom yang berinteraksi dengan sifat elektrofil dan nukleofil dan r vdW adalah jari-jari van der Waals yang sesuai.
4.2.2 Simulasi MD
Enantioseparasi 1 pada Lux Cellulose-1 dengan n -heksana/2-PrOH dan karbon dioksida/2-PrOH 70:30 v/v sebagai fase mobil dipertimbangkan, dimodelkan oleh MD, dan hasil perhitungan dibandingkan dengan data eksperimen acuan. Simulasi MD ini dilakukan dengan tujuan utama untuk memodelkan CDMPC dalam media berbasis karbon dioksida, jenis simulasi yang belum dilaporkan sejauh ini dalam bidang kromatografi enantioselektif. Lebih jauh, minat kami juga untuk mengonfirmasi apakah dan bagaimana HaB berpartisipasi dalam pengikatan dan pengenalan enantioselektif dalam perspektif dinamis dalam domain mekanika molekuler dan untuk mengeksplorasi pola interaksi nonkovalen yang mendasari kontak CDMPC dengan analit 1 . Simulasi MD 100 ns dalam medan gaya AMBER [ 48 ] dilakukan dengan menggunakan nonamer CDMPC sebagai model virtual pemilih berbasis polisakarida, struktur yang dioptimalkan DFT yang dihitung untuk enantiomer ( M ) dan ( P ) dari 1 , dan campuran pelarut virtual eksplisit sesuai dengan kondisi eksperimen yang digunakan dalam analisis kromatografi. Parameterisasi σ-hole (ESH) eksplisit [ 49 , 50 ] digunakan untuk memodelkan penipisan kerapatan muatan elektron elektrofilik pada atom yodium [ 51 ] (lihat bagian Informasi Pendukung untuk detailnya dan Tabel S4 ).
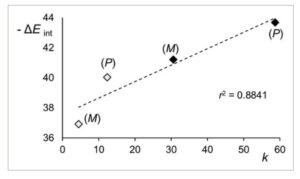
Pada Gambar 4 , korelasi antara total energi interaksi yang dihitung untuk kompleks ( M )- 1 /CDMPC dan ( P )- 1 /CDMPC dengan faktor retensi eksperimental dilaporkan. Meskipun keterbatasan tidak mempertimbangkan perbedaan antara kedua lingkungan (karbon dioksida vs. n -heksana) terkait dengan efek entropi, garis tren linier yang memuaskan ( r 2 = 0,8841) diperoleh.
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
Korelasi energi interaksi (Δ E int , kcal mol −1 ) antara enantiomer analit 1 dan nonamer CDMPC, dihitung dengan MD [kotak pelarut: n -heksana/2-PrOH 70:30 (◊); karbon dioksida/2-PrOH 70:30 (⧫)], dengan k eksperimen enantiomer elusi pertama dan kedua dari analit 1 [Lux Cellulose-1: n -heksana/2-PrOH 70:30, T = 22°C, 0,8 mL min −1 (◊); karbon dioksida/2-PrOH 70:30, T = 40°C, 1,5 mL min −1 (⧫)].
Energi yang dilaporkan adalah nilai rata-rata yang dihitung dari 5000 kompleks yang diperoleh melalui snapshot yang diambil setiap 20 ps dari lintasan MD 100 ns. Energi interaksi ( E int ) antara enantiomer dan selektor dihitung berdasarkan energi kompleks selektor-enantiomer, selektor, dan enantiomer (𝐸 int = 𝐸 total − 𝐸 enantiomer − 𝐸 selektor berbasis polisakarida ).
EEO yang dihitung [( M )–( P )] sesuai dengan urutan elusi eksperimen, dan nilai energi interaksi yang lebih negatif untuk kompleks analit-CDMPC dihitung dengan menggunakan campuran virtual yang mengandung karbon dioksida (Δ E int ( M ) = −41,22 ± 3,96 kkal mol −1 ; Δ E int ( P ) = −43,68 ± 5,59 kkal mol −1 ) dibandingkan dengan pelarut berbasis n -heksana (Δ E int ( M ) = −36,92 ± 5,96 kkal mol −1 ; Δ E int ( P ) = −40,04 ± 7,47 kkal mol −1 ).
Dalam Tabel S5–S8 , waktu hidup HBs dan HaBs yang diekstraksi dari lintasan MD simulasi kompleks ( M )- dan ( P )- 1 dengan CDMPC dalam media berbasis n -heksana dan karbon dioksida dicantumkan dan dibandingkan. Lebih jauh, interaksi π–π intramolekuler dalam CDMPC serta I … π ArMe2 analit-CDMPC HaBs juga diamati. Dengan memeriksa pola interaksi nonkovalen yang terjadi dalam dua media yang dipilih, pernyataan berikut muncul:
Dalam simulasi yang dilakukan dengan karbon dioksida/2-PrOH 70:30, HBs antara molekul 2-PrOH (0,02 ≤ masa hidup (ns) ≤ 8) yang lebih kuat daripada HBs antara karbon dioksida dan 2-PrOH (0,02 ≤ masa hidup (ns) ≤ 0,2) diamati, mengonfirmasi heterogenitas medium berbasis karbon dioksida.
Dalam semua simulasi, sesuai dengan fitur penting dari struktur sangat teratur dari penyeleksi kiral berbasis polisakarida karbamat [ 5 , 9 ], HB intramolekul >C═O…H─N< dapat diamati selama 100 ns MD dengan rentang waktu hidup dari 63 hingga 0,02 ns.
Dalam n -heksana/2-PrOH 70:30, CDMPC disolvasi oleh molekul 2-PrOH melalui HBs di mana molekul pelarut bertindak sebagai donor dan akseptor HB yang berinteraksi dengan oksigen karbonil dan atom hidrogen amidik, dengan rentang waktu antara 34 hingga 0,02 ns. Dalam karbon dioksida/2-PrOH 70:30, HBs yang lebih kuat antara 2-PrOH dan CDMPC ditemukan dengan rentang waktu antara 77 hingga 0,02 ns, tetapi molekul karbon dioksida juga melarutkan polimer melalui beberapa HBs yang lebih lemah yang memiliki rentang waktu antara 2 hingga 0,02 ns. Hal ini menegaskan bahwa karbon dioksida dan 2-PrOH teradsorpsi pada fase stasioner.
Dalam n -heksana/2-PrOH 70:30, enantiomer analit disolvasi oleh molekul 2-PrOH melalui HB yang lebih lemah antara atom hidrogen hidroksil dari 2-PrOH dan nitrogen piridil dari analit (0,02 ≤ waktu hidup (ns) ≤ 3), dan melalui HaB yang lebih kuat antara atom oksigen hidroksil dari 2-PrOH dan atom yodium dari analit (0,02 ≤ waktu hidup (ns) ≤ 10). Dalam karbon dioksida/2-PrOH 70:30, molekul karbon dioksida juga melarutkan enantiomer analit melalui beberapa HaB yang lebih lemah yang memiliki waktu hidup berkisar dari 0,02 hingga 0,4 ns, sedangkan HB (0,02 ≤ waktu hidup (ns) ≤ 2) dan HaB yang lebih kuat (0,02 ≤ waktu hidup (ns) ≤ 35) antara 2-PrOH dan analit juga dapat diamati, mengonfirmasi keberadaan molekul alkohol yang mengelompokkan analit.
Dalam semua kasus, interaksi antara enantiomer ( M )- dan ( P )- 1 dan CDMPC didominasi oleh HaB antara iodin dan atom oksigen karbonil polimer dengan jumlah HaB yang diamati dan derajat penetrasi terkait sesuai dengan EEO eksperimental [( M )–( P )] (Tabel 4 ). Lebih jauh, HB antara atom nitrogen piridil analit dan atom hidrogen amidik CDMPC juga berkontribusi pada kontak pemilih analit-kiral untuk enantiomer ( P )- (0,6 ns) dalam n -heksana/2-PrOH 70:30 dan untuk enantiomer ( M )- dan ( P )- (masing-masing 0,1 dan 9 ns) dalam karbon dioksida/2-PrOH 70:30.
Menariknya, simulasi MD yang dilakukan dengan menggunakan karbon dioksida sebagai media menunjukkan HB intramolekul yang kuat dalam CDMPC (0,02 ≤ waktu hidup (ns) ≤ 74) dan HaB analit-CDMPC intermolekul (0,4 ≤ waktu hidup (ns) ≤ 91) (Tabel 4 dan Tabel S9 dan S10 ).
Dalam semua simulasi yang melibatkan karbon dioksida, molekul pelarut diamati lebih suka mengoordinasikan ( M )-enantiomer (0,02 ≤ waktu hidup (ns) ≤ 0,4) dari analit dibandingkan dengan ( P )-enantiomer yang paling tertahan (0,02 ≤ waktu hidup (ns) ≤ 0,3). Preferensi ini dapat menjelaskan peningkatan retensi yang lebih tinggi yang diamati secara eksperimental untuk enantiomer terelusi pertama dengan mengubah kondisi HPLC ke SFC dibandingkan dengan enantiomer terelusi kedua. Perilaku ini dapat dianggap agak logis. Memang, ( P )-enantiomer terelusi kedua memberikan interaksi yang lebih kuat dengan CDMPC. Ini mengurangi karakter elektrofilik dari atom iodin noninteraksi lainnya dan, akibatnya, kemampuan mereka untuk mengoordinasikan karbon dioksida. Yang sebaliknya terjadi pada ( M )-enantiomer terelusi pertama , yang memberikan interaksi yang kurang kuat dengan CDMPC.
TABEL 4. Waktu hidup, parameter penetrasi%, dan lokasi ikatan halogen (HaBs) yang diamati antara ( M )- dan ( P )-enantiomer dari 1 dan selulosa tris (3,5-dimetilfenilkarbamat) (CDMPC) dalam dinamika molekuler (MDs) 100 ns yang dilakukan dengan menggunakan n -heksana/2-PrOH 70:30, CO 2 /2-PrOH 70:30, dan CO 2 sebagai media virtual. Untuk gugus karbonil dari CDMPC, posisi gugus liontin yang sesuai dalam unit glukopiranosa dilaporkan (2, 3, atau 6).
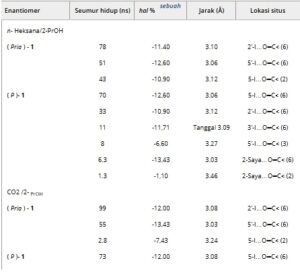
a pp % = 100 × {( d Ha⋅⋅⋅O )/( r vdW Ha + r vdW O) − 1}), di mana d Ha…O adalah jarak antar atom antara atom Ha dan O dan r vdW adalah jari-jari van der Waals yang sesuai.
Gambaran representatif dari kompleks ( M ) – dan ( P ) – 1 / CDMPC yang dihitung dengan MD dan beberapa interaksi nonkovalen terkait dilaporkan dalam Tabel S11 dan S12 dan Gambar S6 .
5. Penutup
Pemisahan enantiose dari tiga 4,4′-bipiridina heksahalogenasi 2,2′,3,3′,5,5′ kiral diteliti dengan menggunakan kolom kiral berbasis CDMPC dalam kondisi SFC. Setiap analit memiliki atom halogen yang khas, iodin, bromin, dan klorin, sebagai substituen dari gugus 4,4′-bipiridil. Mengingat bahwa polarisabilitas dan sifat elektrofilik dari seri meningkat mengikuti urutan Cl < Br < I, ketiga analit dipilih sebagai uji probe untuk mengeksplorasi kemungkinan bahwa HaB dapat berkontribusi pada pengikatan dan mekanisme pengenalan enantioselektif dalam media karbon dioksida. Analisis juga dilakukan dengan menggunakan teknik HPLC dengan fase gerak berbasis n -heksana sebagai referensi untuk perbandingan. Memang, penelitian sebelumnya menunjukkan bahwa enantioseparasi 4,4′-bipiridina terhalogenasi dikontrol dan dimodulasi oleh HaB dalam kondisi HPLC, hingga tingkat yang bergantung pada sifat elektrofilik substituen halogen dan pada kemampuannya sebagai donor HaB, dan pada sifat nukleofilik selektor berbasis polisakarida sebagai akseptor HaB. Dengan menggunakan campuran karbon dioksida/2-PrOH dan karbon dioksida/MeOH dengan kandungan pelarut alkohol yang berbeda, faktor retensi dan pemisahan meningkat mengikuti urutan Cl < Br < I dalam semua kasus. Dibandingkan dengan fase gerak berbasis n -heksana yang digunakan dalam HPLC, faktor retensi yang lebih tinggi tetapi nilai selektivitas yang lebih rendah diperoleh dalam SFC dalam semua kasus yang dipelajari. Berdasarkan hasil eksperimen, karbon dioksida tampaknya bekerja sebagai pelarut yang berinteraksi dibandingkan dengan n -heksana yang tidak berinteraksi yang digunakan dalam HPLC. Mengingat kemampuan karbon dioksida sebagai akseptor HaB dan sifat atom iodin sebagai donor HaB yang kuat, perhitungan QM dan simulasi MD dilakukan untuk mengonfirmasi bahwa interaksi nonkovalen O═C═O … I dapat berkontribusi pada afinitas besar analit teriodinasi terhadap CDMPC. Analisis QM komputasional mengonfirmasi bahwa hanya analit teriodinasi 1 yang dapat membentuk HaB dengan atom oksigen karbon dioksida yang, secara berbeda, membentuk jenis interaksi lain dengan analit terbrominasi dan terklorinasi 2 dan 3. Lebih jauh, simulasi MD menunjukkan bahwa dengan kandungan 30% 2-PrOH dalam fase bergerak berbasis karbon dioksida, cangkang solvasi di sekitar kompleks analit/pemilih dibentuk oleh molekul 2-PrOH dan karbon dioksida. Dengan menggunakan karbon dioksida sebagai pelarut virtual, molekul pelarut ini ditemukan berpartisipasi dalam cangkang solvasi kompleks analit/pemilih kiral, juga berinteraksi dengan polimer CDMPC oleh HB. Hasil studi eksperimental/komputasional ini menunjukkan bahwa keberadaan karbon dioksida dapat meningkatkan waktu elusi analit teriodinasi dengan membentuk gugus berbasis HaB yang memperlambat kemajuan analit di sepanjang kolom. Di sisi lain, dengan menggunakan fase gerak yang mengandung karbon dioksida, atom oksigen dari pelarut ini dapat mengoordinasikan CDMPC melalui atom hidrogen amidik, berfungsi sebagai pengaktif atom oksigen karbonil dari pemilih kiral sebagai akseptor HaB, sehingga meningkatkan afinitas CDMPC terhadap donor HaB.





Tinggalkan Balasan