Abstrak
Rangkaian baru konjugat rhodamin nitroksida profluoresens disintesis menggunakan reaksi multikomponen berbasis isonitril (IMCR) yang terkenal. Konjugat yang disintesis dirancang secara rasional sebagai probe penargetan mitokondria untuk mendeteksi spesies oksigen reaktif dalam sel hidup. Di sini, probe yang disintesis menunjukkan selektivitas tinggi untuk menargetkan mitokondria dari sel PC3 dan NIH3T3 yang mewakili garis sel kanker dan sel normal. Menempelkan TEMPO nitroksida ke rhodamin menyebabkan pemadaman fluoresensi, yang memungkinkan deteksi dan kuantifikasi ROS. Sensor yang disiapkan menyediakan metode yang andal untuk membedakan antara lingkungan oksidatif yang berbeda dalam organisme hidup melalui berbagai tingkat fluoresensi yang akan diukur. Penggunaan reaksi multikomponen Ugi memungkinkan pendekatan sintetis yang efisien dan serbaguna, yang menawarkan keuntungan signifikan dibandingkan metode yang dilaporkan sebelumnya untuk membangun probe pendeteksi ROS. Kesederhanaan pengaturan reaksi dan kemampuan untuk menghasilkan beragam pustaka produk dengan memvariasikan komponen Ugi membuat protokol ini sangat mudah beradaptasi untuk modifikasi kimia lebih lanjut dan aplikasi potensial dalam sistem biologis.
1 Pendahuluan
Pemantauan proses biologis dalam sel merupakan proses yang berkelanjutan dan perangkat analisis modern terus dikembangkan untuk memberikan hasil yang cepat, andal, dan dapat direproduksi untuk menjawab pertanyaan dan kebutuhan yang mendesak dalam konteks masalah terkait penyakit. Di antara proses seluler yang menunjukkan indikasi yang jelas tentang sifat dan statusnya adalah pembentukan spesies oksigen reaktif (ROS). ROS mencakup radikal hidroksil dan anion superoksida yang merupakan radikal oksigen, meskipun ROS non-radikal juga ada seperti hidrogen peroksida dan ozon. Sekitar 1% oksigen yang diserap tubuh kita melalui pernapasan sederhana diubah menjadi ROS. [ 1 ]
Produksi ROS yang berlebihan menyebabkan kerusakan sel, yang mengakibatkan stres oksidatif dan akhirnya kematian sel. Akibat produksi ROS yang berlebihan, kerusakan DNA dapat terjadi yang dapat memicu mutasi gen. Selain itu, banyak penyakit yang berhubungan dengan produksi ROS yang berlebihan seperti penyakit neurodegeneratif (Alzheimer), [ 2 ] hipertensi, [ 3 ] hilangnya perlindungan jantung, [ 4 ] dan hiperglikemia. [ 5 ]
Memang, produksi ROS oleh sel kanker adalah manifestasi utamanya dan karena aktivitas metaboliknya yang tinggi dibandingkan dengan sel normal, menimbulkan masalah yang harus ditangani. [ 6 ] Oleh karena itu, pemahaman tentang alasan dan kondisi yang menyebabkan distorsi ini adalah mandat untuk mengembangkan alat yang menjanjikan untuk melawan situasi ini. Lokalisasi proses ini ke organel subseluler juga sangat diperlukan. Karena rantai transpor elektron terletak di membran mitokondria, kemungkinan besar organel ini merupakan sumber utama ROS. Memang 90% produksi ROS terjadi di mitokondria, yang terbentuk selama fosforilasi oksidatif, metabolisme asam amino dan asam lemak, dan biosintesis hormon. [ 7 ] Karena tingkat proses redoks bawaannya yang tinggi yang dimulai dengan aliran elektron dari rantai transpor elektron untuk mengoksidasi oksigen molekuler menjadi spesies oksigen radikal, mitokondria adalah kompartemen sel yang dipelajari dengan baik.
Bahasa Indonesia: Banyak fluorofor untuk penargetan mitokondria telah dilaporkan, seperti fluorescein yang secara rutin digunakan untuk pelabelan protein tetapi mengalami permeabilitas seluler terbatas dalam penelitian yang melibatkan sel hidup. Sebaliknya, pewarna rhodamin yang berbeda; rhodamin 123, rhodamin B, violet dasar 11, rhodamin 6G, dan rhodamin 101, dikecualikan karena kecenderungannya untuk menembus sel lebih mudah daripada fluorescein, karena potensial membran plasma negatif dalam sitoplasma sel. Selain itu, sistem π kationik rhodamin yang terdelokalisasi memfasilitasi akumulasinya dalam mitokondria. [ 8 ] Dalam penelitian kami untuk menargetkan mitokondria, fluorofor rhodamin dipilih, karena telah terbukti bahwa pewarna kationik lipofilik tersebut terlokalisasi ke dalam organel tertentu, oleh karena itu bertindak sebagai fluorofor serta kelompok penargetan. [ 9 ] Selain itu, rhodamin memperoleh daya tarik tinggi karena sifat fotofisika yang diinginkan, seperti; hasil kuantum tinggi (ɸ) dan daya serap molar tinggi (ε). Selain itu, karena fotostabilitasnya yang sangat baik, rhodamin banyak digunakan dalam studi biologi [ 10 ] dan juga diketahui memiliki stabilitas kimia yang tinggi. Stabilitasnya terhadap pH, ion logam, anion, dan tiol memberikan kepercayaan pada fitur terpentingnya yaitu stabilitasnya terhadap spesies oksigen reaktif. [ 11 – 13 ] Di dekat pewarna, kami membayangkan memasang radikal 2,2,6,6-Tetramethylpiperidinyloxyl nitroxide (TEMPO)-moiety untuk efisiensi pendinginan maksimum karena pendinginan fluorofor sangat bergantung pada jarak antara radikal nitroxide relatif terhadap tag fluoresen. [ 14 ] Salah satu aplikasi nitroxide adalah konjugasinya dengan fluorofor dan untuk memanfaatkan konjugat ini sebagai molekul sensor pra-fluoresensi (spin dan fluoresensi) fungsi ganda. [ 15 – 17 ] Nitroksida diketahui bertindak sebagai probe profluoresensi melalui kemampuannya untuk memadamkan keadaan tereksitasi dari tag fluoresensi. [ 18 – 21 ]
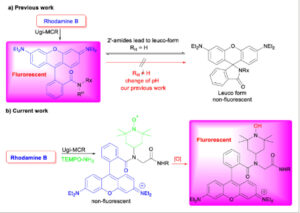
Dalam studi terkini kami menggambarkan preparasi konjugat rhodamin TEMPO sebagai probe penargetan mitokondria. Banyak laporan menunjukkan bahwa pewarna rhodamin cenderung terakumulasi dan terlokalisasi dalam mitokondria. [ 22 , 23 ] Namun, kelemahan utama kimia rhodamin adalah analognya sensitif terhadap pH, dan amida sekunder rhodamin menghasilkan bentuk leuko (non-fluoresensi) melalui siklisasi intramolekuler ( Skema 1 ). Dalam studi sebelumnya, kami menunjukkan bahwa penggunaan rhodamin dalam reaksi Ugi menghasilkan peptoid yang tidak dapat diubah menjadi bentuk leuko setelah perubahan pH (Skema 1 ). [ 24 ] Reaksi Ugi menawarkan kemungkinan untuk menggunakan TEMPO-NH2 . Dengan demikian, aduk yang diperoleh tidak berfluoresensi karena pendinginan oleh radikal. Namun, setelah oksidasi, probe ini akan berubah menjadi analit fluoresen yang mampu memantau ROS setelah perubahan intensitas aduk Ugi. Selain itu, penggabungan radikal TEMPO juga menawarkan kemungkinan untuk menggunakan sensor ini sebagai probe pembacaan ganda, pembacaan kedua diperoleh dari spektroskopi Resonansi Paramagnetik Elektron (EPR). Spektroskopi EPR adalah teknik yang mapan dan ampuh dengan berbagai macam aplikasi. Ini adalah metode yang sangat presisi dan tidak merusak yang membutuhkan jumlah sampel yang sangat sedikit (kisaran 10—100 µL). Semua sifat ini membuat EPR cocok untuk berbagai keperluan biologis. EPR didasarkan pada pemantauan interaksi elektron yang tidak berpasangan dengan iradiasi gelombang mikro di hadapan medan magnet. Oleh karena itu, EPR dapat digunakan untuk mengetahui tidak hanya tingkat ROS, tetapi juga RNS (Spesies Nitrogen Reaktif) dalam sistem seluler. Tentang peran EPR dalam mendeteksi dan mengukur ROS dalam media biologis, ada ulasan terperinci di tempat lain. [ 25 – 27 ]
 Skema 1
Skema 1
Buka di penampil gambar
Kekuatan Gambar
Perbandingan karya sebelumnya dan saat ini.
Reaksi multikomponen Ugi (U-MCR) adalah protokol sintesis satu pot yang mapan untuk mencapai keragaman hanya dalam satu operasi sintesis. Cakupannya agak luas, dan berbagai gugus fungsi dapat digunakan dalam komponen asam karboksilat, amina, dan isonitril tanpa memerlukan strategi perlindungan dan aktivasi, dengan air sebagai satu-satunya produk sampingan. Penerapannya terhadap sintesis senyawa bioaktif telah ditunjukkan dalam beberapa contoh. [ 28 – 31 ] Dalam studi sebelumnya, kami juga menunjukkan bahwa kondisi reaksi Ugi tidak mengganggu radikal TEMPO, menjaga karakter radikal tetap utuh selama sintesis. [ 32 , 33 ] Studi ini memajukan pengembangan probe ROS yang menargetkan mitokondria dengan memanfaatkan sifat unik fluorofor rhodamin dan radikal nitroksida melalui pendekatan sintesis yang efisien dan modular. Penggunaan reaksi multikomponen Ugi dalam studi ini memastikan peningkatan stabilitas kimia, kemampuan deteksi ganda melalui spektroskopi fluoresensi dan EPR, serta kemampuan beradaptasi untuk diversifikasi struktural melalui reaksi Ugi. Atribut ini menjadikannya alat yang menjanjikan untuk bioimaging, pemantauan stres oksidatif, dan studi biologi redoks, dengan aplikasi potensial dalam memahami dan mendiagnosis penyakit yang terkait dengan stres oksidatif.
2 Hasil dan Pembahasan
2.1 Sintesis dan Karakterisasi
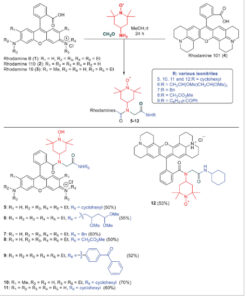
Untuk penelitian ini, kami membayangkan menggunakan radikal TEMPO sebagai komponen amina. Untuk memastikan jarak yang dekat dan pendinginan maksimum radikal terhadap fluorofor, rhodamin B dipilih sebagai komponen asam dalam U-MCR, dan formaldehida digunakan sebagai senyawa karbonil untuk menghindari pembentukan stereoisomer. Untuk diversifikasi 1) rhodamin B, 2) rhodamin 110, 3) rhodamin 19 digunakan ( Skema 2 ). Berbagai isonitril yang terdiri dari gugus sikloheksil, benzil, dan benzofenon digunakan untuk menghasilkan pustaka konjugat rhodamin TEMPO. U-MCR juga dilakukan dengan isonitril konvertibel yang memiliki gugus ester dan isonitril IPB yang memungkinkan modifikasi pasca-U-MCR. [ 34 , 35 ] Semua U-MCR dilakukan dalam metanol sebagai pelarut pada suhu kamar dalam kondisi sekitar. Hasil dari probe berlabel spin 5–12 (Skema 2 ) berkisar antara ≈50% hingga 70%. Hasil yang baik ini dengan jelas membuktikan keserbagunaan pendekatan U-MCR untuk mencapai berbagai macam sensor radikal rhodamine hanya dalam satu transformasi. Sifat bagian asam karboksilat tidak memiliki dampak besar pada pembentukan produk.
 Skema 2
Skema 2
Buka di penampil gambar
Kekuatan Gambar
Persiapan probe berlabel spin 5–12 .
2.2 Sifat Spektroskopi UV, EPR, dan NMR dari Probe Berlabel Spin 5
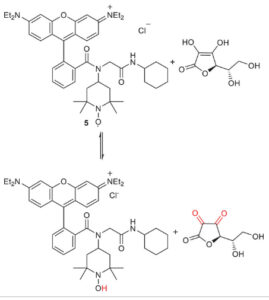
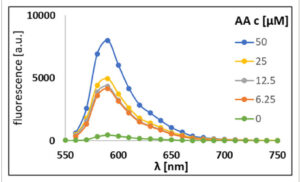
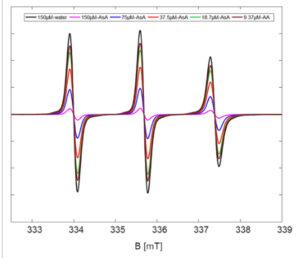
Kami memilih probe 5 berlabel spin untuk menguji apakah dapat direduksi menjadi hidroksilamina yang sesuai sehingga memfasilitasi pewarna rhodamin untuk mendapatkan kembali fluoresensinya. Untuk tujuan ini, kami telah memilih asam askorbat (AA) sebagai agen pereduksi dalam berbagai konsentrasi ( Skema 3 ). Karakteristik spektral dari probe 5 berlabel spin yang disintesis diuji tanpa dan dengan adanya AA. Baik EPR maupun spektroskopi fluoresensi digunakan untuk memantau reaksi pada berbagai konsentrasi AA. Hasilnya menunjukkan hubungan respons bergantung dosis antara AA dan probe 5. Sebelum AA ditambahkan hampir tidak ada fluoresensi yang terekam untuk probe 5 (50 µ m dalam metanol) seperti yang terlihat pada Gambar 1 . Karena rasio molar AA perlahan meningkat secara bertahap dari 6,25 hingga 50 µ m sambil menjaga konsentrasi probe 5 konstan (50 µ m ), intensitas fluoresensi meningkat seperti yang ditunjukkan pada Gambar 1 . Spektrum EPR direkam dalam penambahan AA bertahap ke probe 5, juga ( Gambar 2 ). Setelah penambahan AA ke senyawa 5 (150 µ m ) secara bertahap (AA: 75, 37,5, 18,75 dan akhirnya 9,37 µ m ), intensitas tiga garis khas radikal nitroxide dari probe 5 menurun hingga hampir terjadi pemadaman penuh sinyal EPR (Gambar 2 ). Spektrum EPR yang disimulasikan dari probe 5 dalam air menunjukkan kopling hiperhalus isotropik (Aiso) sebesar 47,66MHz dan menghasilkan nilai-g isotropik sebesar 2,0057 (Gambar S4 , Informasi Pendukung). Kedua sifat ini sesuai dengan nilai isotropik nitroxide khas dalam lingkungan polar. [ 36 – 38 ] Paket perangkat lunak Easyspin digunakan untuk simulasi. [ 39 ]
 Skema 3
Skema 3
Buka di penampil gambar
Kekuatan Gambar
Pengurangan asam askorbat pada probe 5.
 Gambar 1
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Respon fluoresensi probe berlabel spin 5 (50 µ m ) terhadap asam askorbat (AA).
 Gambar 2
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Spektrum cw-EPR dari reduksi bertahap probe 5 berlabel spin oleh asam askorbat (AA). Spektrum hitam menunjukkan probe 5 dalam air (referensi) sebelum penambahan AA.
Untuk merekam spektrum NMR dari probe 5 , gugus nitroksida harus direduksi menjadi hidroksilamina yang sesuai. Reduksi probe spin-labeed 5 dilakukan secara in situ dengan menggunakan agen pereduksi AA (Skema 3 ). Reaksi dipantau melalui NMR selama 66 menit (Gambar S1 , Informasi Pendukung).
2.3 Keamanan Biologis dari Probe Berlabel Spin yang Disintesis (5-8)
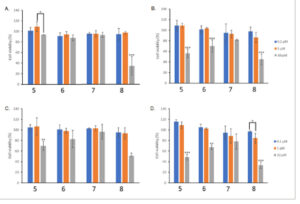
Sebelum menyelidiki kemampuan probe berlabel spin 5 untuk mendeteksi ROS dalam lini sel kanker, keamanan probe 5 – 8 yang disintesis pertama kali dikonfirmasi. Baik sel fibroblas embrionik tikus NIH3T3 yang juga mewakili fibroblas normal tikus dan sel kanker prostat PC3 manusia yang mewakili kanker prostat manusia digunakan sebagai model (uji MTT/3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazolium bromida dan CV/kristal violet) untuk menentukan viabilitas sel. Probe berlabel spin 5 – 8 yang diuji tidak secara signifikan mempengaruhi pertumbuhan sel normal pada 0,1 dan 1 µ m serta fungsi mitokondria dibandingkan dengan sel yang tidak diobati. Dengan demikian, senyawa dalam konsentrasi yang digunakan ditemukan tidak beracun terhadap tumor dan sel normal yang dipilih ( Gambar 3 ). Probe berlabel spin 5 – 8 menunjukkan tingkat keamanan yang tinggi dan ditoleransi oleh tumor prostat PC3 dan fibroblast normal NIH3T3. Hasilnya mendorong kami untuk melanjutkan studi tindak lanjut seperti yang dijelaskan sebelumnya. Kami membayangkan untuk menggunakan probe berlabel spin 5 sebagai probe model kami meskipun probe berlabel spin 6 dan 7 berkinerja sangat baik meskipun teori studi kami memerlukan satu probe representatif.
 Gambar 3
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Viabilitas sel ditentukan setelah 48 jam pengobatan dengan probe A) NIH3T3 dan B) sel PC3 yang dievaluasi dengan uji MTT, C) NIH3T3 dan D) sel PC3 yang dievaluasi dengan uji CV. ANOVA satu arah, * p < 0,05, ** p < 0,01, *** p < 0,001.
2.4 Deteksi ROS pada Probe Berlabel Spin 5 melalui Analisis Flow Cytometry
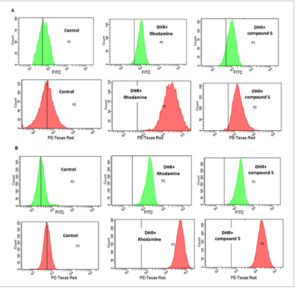
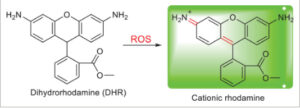
Untuk mengevaluasi potensi deteksi ROS dari probe yang mengandung TEMPO, sel diperlakukan dengan probe 5 berlabel spin, dan analisis flow cytometry dilakukan ( Gambar 4 ). Secara singkat, PC3 dan NIH3T3 diwarnai dengan pewarna dihidro rhodamine (DHR), kemudian diperlakukan bersamaan dengan probe 5 berlabel spin untuk menyelidiki dan membandingkan produksi ROS pada sel normal serta sel tumor. Pewarna DHR adalah indikator ROS yang tidak bermuatan dan tidak berfluoresensi dan setelah berinteraksi dengan ROS, pewarna dioksidasi menjadi rhodamine kationik, yang terlokalisasi dalam mitokondria dan menunjukkan fluoresensi hijau ( Skema 4 ).
 Gambar 4
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Analisis sitometri aliran dari A) NIH3T3 dan B) sel PC3 yang diwarnai ganda dengan DHR (10 menit) dan probe 5 yang diberi label putar (45 menit).
 Skema 4
Skema 4
Buka di penampil gambar
Kekuatan Gambar
DHR untuk deteksi ROS.
Dua saluran deteksi berbeda dengan panjang gelombang eksitasi/emisi berbeda digunakan untuk merekam fluoresensi DHR dan probe berlabel spin 5 . Saluran deteksi FITC digunakan untuk DHR dengan panjang gelombang eksitasi/emisi 488 nm/520 nm dan didukung oleh saluran deteksi merah Texas dengan panjang gelombang eksitasi/emisi 561 nm/610 nm [ 40 ] yang digunakan untuk probe berlabel spin 5 . Sebagai kontrol positif, sel yang diobati bersama dengan rhodamine dan DHR digunakan. Secara teori, ketika sel diobati dengan rhodamine saja, fluoresensi tinggi diharapkan terlihat untuk kedua lini sel PC3 dan NIH3T3. Dari deteksi DHR dapat dilihat bahwa produksi ROS lebih menonjol pada tumor PC3 daripada pada sel NIH3T3 normal (Gambar 4 ), seperti yang diharapkan. Yaitu, perbedaan dalam pergeseran fluoresensi sesuai dengan tingkat produksi spesies ROS. Ketika sel diwarnai ganda dengan rhodamin dan DHR, tidak ditemukan korelasi antara kadar ROS pada sel normal dan sel tumor seperti yang diantisipasi. Sebaliknya, sel yang diobati bersama dengan DHR dan probe 5 berlabel spin menunjukkan korelasi tinggi antara kadar ROS dan pergeseran fluoresensi. Intensitas fluoresensi bergantung pada konsentrasi karena radikal nitroksida direduksi menjadi hidroksilamina yang sesuai setelah berinteraksi dengan ROS sehingga kehilangan kemampuannya untuk memadamkan fluoresensi rhodamin (Gambar 4 ).
2.5 Penargetan Mitokondria pada Probe Berlabel Putar 5
Lokalisasi probe spin-labeled baru 5 dalam sel ditentukan menggunakan mikroskopi fluoresensi ( Gambar 5 ). Sel tumor PC3 serta sel NIH3T3 normal diobati dengan MitoTracker Green dan selanjutnya dengan rhodamine, sebagai kontrol, dan probe spin-labeled 5, berturut-turut. Gambar yang diperoleh dengan mikroskopi fluoresensi menunjukkan bahwa rhodamine terlokalisasi dalam mitokondria (Gambar 5A dan 6A ). [ 22 , 23 ] Seperti yang ditunjukkan dalam percobaan flow cytometry, terlepas dari tingkat ROS, intensitas fluoresensi rhodamine serupa dalam sel NIH3T3 dan PC3. Sel NIH3T3 yang diwarnai dengan probe spin-labeled 5 tidak menunjukkan fluoresensi (Gambar 6 .B). Di sisi lain, sel PC3 yang diobati dengan probe spin-labeled 5 menunjukkan intensitas fluoresensi yang tinggi (Gambar 5 .B). Perbedaan intensitas fluoresensi ini, sesuai dengan data flow cytometry, disebabkan oleh produksi ROS yang lebih tinggi oleh sel PC3 daripada sel NIH3T3. Panel distribusi probe berlabel spin 5 sama dengan MitoTracker Green, pewarna komersial yang melokalisasi mitokondria secara eksklusif.
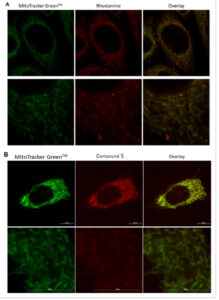 Gambar 5
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Mikrofotografi fluoresensi: sel PC3 diwarnai dengan MitoTracker Green (saluran FITC) dan rhodamine A; saluran Texas Red) atau probe berlabel putar 5B; saluran Texas Red).
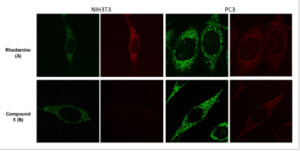 Gambar 6
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Mikrofoto fluoresensi: perbandingan sel NIH3T3 dan PC3 yang diwarnai dengan MitoTracker Green (saluran FITC) dan rhodamine (saluran Texas Red) atau probe berlabel putar 5 (saluran Texas Red).
2.6 Lokalisasi Mitokondria Probe 5 Berlabel Spin melalui Pengukuran EPR
Tingkat ROS dari tiga bagian seluler (sel utuh, ekstrak sitosol, dan ekstrak mitokondria) dalam sel tumor PC3 dipantau pada suhu kamar dengan pengukuran EPR. Selain kompartemen seluler yang disebutkan di atas, spektrum sel kontrol (NIH3T3) juga direkam ( Gambar 7 ). Seluruh sel atau kompartemen yang diinginkan (sitosol dan mitokondria) diinkubasi dengan probe 5 selama 30 menit pada suhu kamar dan kemudian sampel dikirim ke kapiler EPR dan diukur. Waktu inkubasi yang lebih lama (hingga 24 jam) tidak mempengaruhi hasil akhir. Probe 5 yang disintesis ditemukan masih aktif dalam sampel sel utuh dan ekstrak sitosol sementara tidak ada sinyal dalam ekstrak mitokondria, baik untuk kontrol maupun untuk sel tumor. Ini merupakan indikasi bahwa tingkat ROS dalam mitokondria lebih tinggi daripada dua kompartemen lainnya sehingga nitroxide direduksi menjadi bentuk hidroksilaminanya. Sinyal yang berkurang dalam mitokondria berkorelasi baik dengan peningkatan fluoresensi yang sesuai dalam mitokondria karena nitroksida telah kehilangan kemampuannya untuk memadamkan fluoresensi Rhodamin.
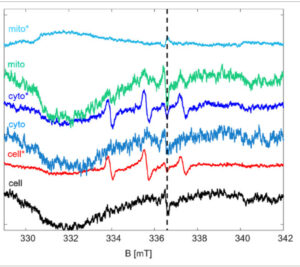 Gambar 7
Gambar 7
Buka di penampil gambar
Kekuatan Gambar
Spektrum cw-EPR dari sel kontrol NIH3T3 dan sel kanker PC3 (diberikan dengan tanda bintang). Spektrum yang direkam untuk sel utuh, ekstrak sitosolik, dan ekstrak mitokondria diberikan. Parameter karakteristik EPR (Aiso dan giso) identik dengan parameter probe 5. Sinyal pada posisi medan yang dilambangkan dengan garis putus-putus (giso = 2,0012) berasal dari pusat cacat pada kapiler EPR yang digunakan.
3 Kesimpulan
Jelas terlihat bahwa reaksi Ugi-multikomponen dapat digunakan sebagai protokol sintetis yang sederhana dan elegan untuk mengembangkan probe rhodamine nitroxide baru untuk deteksi ROS seluler. Hasilnya dikonfirmasi menggunakan metode yang berbeda termasuk flow cytometry, pencitraan fluoresensi, dan spektroskopi EPR. Probe 5 menunjukkan selektivitas tinggi terhadap ROS dan pergeseran fluoresensi tinggi dapat dilihat pada garis sel kanker PC3 dengan hampir tidak ada fluoresensi untuk garis sel NIH3T3. Probe TEMPO yang inovatif dapat berhasil diterapkan untuk mendeteksi kadar ROS menggunakan flow cytometry serta lokalisasi mitokondria dalam sel hidup in vitro. Sel yang diobati dengan rhodamine tidak menunjukkan perbedaan dalam intensitas fluoresensi antara kedua garis sel sementara sel yang diobati dengan probe 5 berlabel spin menunjukkan adanya fluoresensi dalam kasus sel PC3 karena TEMPO nitroxide sensitif terhadap ROS dan hadir dalam tingkat yang lebih besar pada tumor daripada pada sel normal. Temuan dari studi ini memberikan dasar yang kuat untuk pengembangan sensor bioimaging canggih untuk penyakit yang berhubungan dengan stres oksidatif. Mekanisme deteksi fluoresensi ganda dan EPR menawarkan strategi yang lebih kuat dan serbaguna untuk membedakan lingkungan oksidatif dalam sel hidup, dengan aplikasi potensial dalam deteksi kanker dini dan pemantauan terapeutik. Selain itu, kemampuan adaptasi reaksi multikomponen Ugi memungkinkan modifikasi probe lebih lanjut, membuka jalan bagi pencitraan yang ditargetkan, konjugasi antibodi, dan studi in vivo yang potensial. Hasil ini menggarisbawahi janji probe berbasis rhodamine nitroxide dalam penelitian biomedis dan kemajuan diagnostik.





Tinggalkan Balasan