Abstrak Grafis
Serangkaian ftalimida dan luminol fotoaktif disiapkan melalui metode arilasi dari prekursor utama. Korelasi stereoelektronik yang signifikan dari substituen aromatik dengan sifat fotofisik didokumentasikan. Turunan luminol arilasi baru menunjukkan Φ CL lebih dari tiga kali lebih tinggi daripada luminol induk. Teori fungsional kerapatan (DFT) diterapkan untuk merasionalisasi perilaku penyerapan, fluoresensi, dan CL.
Abstrak
Luminol adalah salah satu molekul kemiluminesensi yang paling banyak dikenal dan paling dikenal dengan beragam aplikasi dalam ilmu analitis modern seperti forensik dan uji sel. Modifikasi struktural dan elektronik dari luminol induk dapat secara efektif meningkatkan sifat (foto)fisik dan (foto)kimia. Di sini, rute langsung ke turunan luminol termodulasi secara stereoelektronik dikembangkan dengan memanfaatkan cross-coupling yang efektif pada prekursor bromo phthalimide yang serbaguna. Sintesis modular memungkinkan akses mudah ke dua kelas molekul fotoaktif yang berbeda: 6-aril-4-amino N- metil phthalimide yang sangat berfluoresensi dan turunan luminol 7-aril yang kemiluminesensi. Substituen aril yang kaya elektron terbukti secara signifikan meningkatkan hasil kuantum kemiluminesensi (CL) dan menunjukkan batas deteksi yang baik dalam uji hidrogen peroksida CL. Efek stereoelektronik pada penyerapan, fluoresensi, dan sifat CL dievaluasi melalui studi eksperimental dan teoritis.
1 Pendahuluan
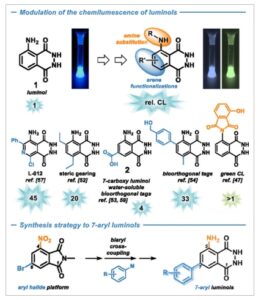
Sejak laporan pertama tentang chemiluminescence (CL) yang kuat oleh Albrecht pada tahun 1928, [ 1 ] luminol ( 1 ) telah terbukti menjadi alat yang ampuh untuk kimia analitik, forensik, dan ilmu hayati [ 2 – 20 ] karena penginderaan kimianya yang serbaguna melalui mekanisme CL dan elektro-CL (ECL). [ 21 – 23 ] Keterbatasan kritis untuk berbagai aplikasi analitik yang jauh lebih luas mencakup hasil kuantum CL yang biasanya rendah, kelarutan yang buruk dalam media berair/buffer, dan kurangnya variasi sintetis yang efektif dan mudah dari motif struktur inti. Perhatian yang signifikan telah dicurahkan untuk manipulasi kondisi reaksi CL, [ 24 – 31 ] misalnya, dengan katalis ion logam, [ 32 ] nanopartikel, [ 33 , 34 ] enzim, [ 25 , 35 – 37 ] dan berbagai kondisi bebas katalis yang memulai CL. [ 38 , 39 ] Modifikasi sintetis inti luminol juga memungkinkan penyempurnaan sifat fotofisika, meskipun sebagian besar dengan tingkat perubahan yang rendah ( Skema 1 , tengah). Secara umum, variasi sintetis yang dilaporkan dari struktur luminol induk dapat dibagi menjadi dua kelompok: 1) derivatisasi gugus amino [ 40 – 49 ] dan 2) pengenalan substitusi dan rantai samping pada cincin aromatik (Skema 1 , atas). [ 50 – 58 ] Sementara pemasangan substituen amina dapat dengan mudah dilakukan pada hidrazida ftalat yang tersedia secara komersial, [ 41 , 44 , 46 , 47 ] modifikasi pada arena lebih menantang. Modifikasi ini sebagian besar memerlukan konstruksi de novo kromofor aromatik dari blok bangunan baru. Upaya tersebut sebagian besar terbatas pada rantai samping hidrokarbon yang stabil dan nonfungsional (alkil, aril) oleh kondisi reaksi yang keras dalam sintesis multitahap. Tim kami melaporkan sintesis dan sifat fotofisika berbagai luminol tersubstitusi 6,8-alkil dan luminol 7-karboksi ( 2 ). [ 50 – 53 , 59 ]Khususnya turunan yang terakhir menunjukkan kelarutan dan sifat CL yang sangat ditingkatkan. [ 53 , 59 ] Pengamatan ini mendorong penyelidikan lebih lanjut ke dalam modulasi regiospesifik posisi 7 luminol, yang kurang mudah diakses dan kurang dieksplorasi daripada pola substitusi 6,8. [ 50 , 53 – 55 ] Kami percaya bahwa strategi yang efektif menuju turunan luminol baru dan studi terperinci tentang hubungan struktur-aktivitas sehubungan dengan dua sistem patokan, luminol ( 1 ) dan 7-karboksi luminol ( 2 ), perlu memenuhi kriteria berikut: 1) pengenalan substituen selektif pada posisi 7 dengan metode sintesis yang kuat dan mudah dioperasikan; 2) variasi luas sifat sterik dan elektronik dari substituen 7; dan 3) penggunaan prekursor sintesis umum yang memungkinkan substitusi modular menuju turunan luminol dan mungkin juga keluarga bahan (fotoaktif) lainnya. Pemasangan substituen aromatik tampaknya menjadi pilihan yang paling menjanjikan karena variabilitas stereoelektroniknya yang luas, ketersediaan banyak protokol untuk penggabungannya dengan arena fungsional, dan stabilitasnya terhadap kondisi reaksi dari langkah preparatif dan jalur CL. Luminol yang mengandung substituen aromatik pada posisi 6 dan 8 baru-baru ini dilaporkan oleh Mikroulis et al. [ 54 ] Kami membayangkan memanfaatkan prekursor ftalimida tersubstitusi halogen yang kuat, yang mudah diakses dan stabil terhadap berbagai kondisi reaksi (Skema 1 , bawah). Ftalimida tersubstitusi sendiri merupakan motif umum dalam polimer konduktif modern, [ 60 – 67 ] farmasi aktif, [ 51 , 68 – 70 ] dan pewarna fluoresen. [ 71 – 82 ]
Skema 1
Buka di penampil gambar
Kekuatan Gambar
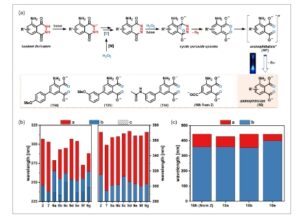
Atas: Luminol ( 1 ) sebagai reagen kemiluminesensi induk dengan situs modulasi struktural umum dari sifat fotofisika dan fotokimia. Tengah: Contoh literatur terpilih dari turunan luminol (misalnya, 7-karboksi luminol, 2 ) dan efisiensi CL relatifnya (vs. 1 ). Bawah: Strategi sintesis de novo melalui prekursor 4-nitro-6-bromo phthalimide untuk berbagai 7-aryl luminol (karya ini).
2 Hasil dan Pembahasan
2.1 Sintesis Derivatif Phthalimide dan Luminol
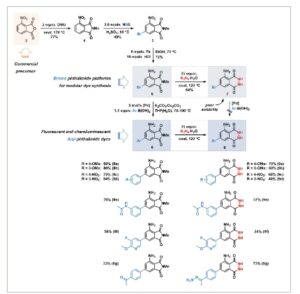
Kami mulai mengeksplorasi pemasangan substituen halogen sebagai pegangan untuk fungsionalisasi modular lebih lanjut. Pendekatan sintesis kami didasarkan pada tiga asumsi: 1) Kami beralasan bahwa ftalimida terhalogenasi akan berfungsi sebagai prekursor serbaguna namun stabil untuk inti ftalhidrazida dari turunan luminol. [ 50 , 54 , 55 ] 2) Halogenasi regioselektif pada tahap turunan nitrobenzena harus memberikan pola meta -substitusi yang diinginkan, yang dapat mengalami reduksi nitro-ke-amina. 3) Motif orto -dikarboksilat harus sudah ada dalam bahan awal, karena pemasangan tahap akhir ke arena fungsionalisasi sangat menantang. Kondisi kerangka kerja ini menjadikan anhidrida 3-nitroftalat yang tersedia secara komersial ( 3 ) sebagai prekursor yang paling menjanjikan untuk molekul platform yang diinginkan. Turunan 6–bromo ftalimida 6 disintesis melalui metilimidasi berurutan, halogenasi, dan reduksi Béchamp dengan hasil keseluruhan 27% ( Skema 2 ). Iodinasi zat antara ftalimida 4 tidak berhasil (lihat ESI), sementara brominasi menggunakan N -bromosuksimida (NBS) dalam asam sulfat cukup memuaskan. [ 83 , 84 ] Hidrazinasi 6 dalam larutan murni menghasilkan 7–bromo luminol 7 dengan hasil yang baik. Kedua pewarna yang mengandung bromo, turunan ftalimida 6 dan turunan luminol 7 , merupakan platform yang mudah diakses dan serbaguna untuk derivatisasi lebih lanjut. Namun, kelarutan 7 yang buruk dalam pelarut organik umum menghalangi penggunaannya dalam reaksi penggandengan silang konvensional. Yang menggembirakan, cross-coupling 6 dengan asam aril-boronat dengan bersih menghasilkan serangkaian ftalimida tersubstitusi-arena 8a–g dalam hasil yang baik (Skema 2 ). Gugus amino bebas sepenuhnya ditoleransi dan meniadakan kebutuhan untuk strategi gugus pelindung. Gugus fungsi perifer yang beragam dapat dimasukkan ke dalam arilftalimida, termasuk donor dan akseptor elektron, situs asam dan basa (yaitu, metoksi, nitro, keton, fluor, asetanilida, dan piridina). Hidrazinolisis berikutnya dengan hidrazin hidrat dalam larutan murni menghasilkan luminol 7-aril yang sesuai 9a–g . Yang menarik, hidrazinolisis dari 4-asetil-fenil ftalimida 8g mengakibatkan pembentukan luminol 9g yang difungsikan oleh hidrazon.Kondisi penggandengan alternatif dengan adanya amina (aminasi Buchwald–Hartwig) dan dengan alkohol (reaksi tipe Ullmann) masing-masing tidak efektif (lihat ESI). Setelah menyelesaikan sintesis bertahap 6-aril-4-aminoftalimida 8a–g dan 7-aril luminol 9a–g , kami mulai mempelajari sifat fotofisika dan fotokimianya.
Skema 2
Buka di penampil gambar
Kekuatan Gambar
Sintesis tiga langkah molekul platform, bromo phthalimide 6 , dari reagen komersial. Reaksi cross-coupling hetero-biaryl menuju 6-aryl phthalimide ( 8a–g ) dan hidrazinasi menuju derivatif luminol 7-aryl ( 9a–g ). DMU: N , N’ -dimethylurea, NBS: N -bromo succinimide. Untuk detail eksperimental dan analitis, lihat ESI.
2.2 Sifat Fotofisika Aril Ftalimida
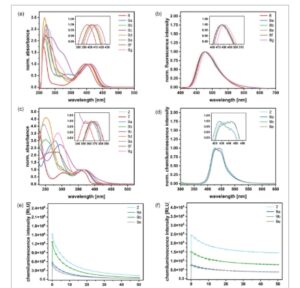
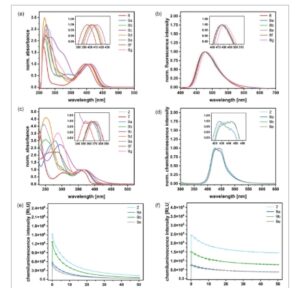
Turunan bromo 6 dan semua 6-aril ftalimida 8a–g menunjukkan kelarutan tinggi dalam dimetil sulfoksida (DMSO), sementara hanya 6 , 8a , 8b , dan 8e yang larut dalam etanol. Semua ftalimida menunjukkan pita serapan kuat antara 397 dan 413 nm dalam DMSO, yang dikaitkan dengan transisi S0 → S1 ( Gambar 1a ). Maksimum serapan sekitar 300 nm mungkin dihasilkan dari transisi S0 → S ≥2 , seperti yang ditunjukkan untuk senyawa serupa. [ 71 ] Dalam seri ini, 6 menunjukkan transisi energi tertinggi, kemungkinan besar karena kromofor π terpendek dibandingkan dengan aril ftalimida; 8c menunjukkan serapan paling bergeser ke merah. Koefisien penyerapan molar ditentukan dari korelasi Beer-Lambert linear antara konsentrasi dan absorbansi (lihat Tabel 1 dan bab 2.1 ESI). Transisi S0 → S1 memberikan nilai ε antara 4200 dan 8800 L mol −1 cm −1 , dengan turunan dua-nitro ( 8c , 8d ) dan 6 menunjukkan ε terendah . Turunan nitro 8c dan 8d tidak berfluoresensi; semua ftalimida lainnya menunjukkan emisi maksimum pada 475–487 nm (DMSO) dan 479–485 nm (EtOH, lihat Gambar 1b dan Gambar S3, Informasi Pendukung). [ 85 ] Meskipun polaritas DMSO lebih tinggi, pergeseran Stokes sedikit lebih besar dalam etanol (83–87 nm vs. 73–78 nm; Tabel 1 ). Fenomena ini telah didokumentasikan untuk motif serupa dan kemungkinan besar berasal dari ikatan hidrogen antara karbonil dari phthalimide dan fungsi OH dari pelarut. [ 81 , 85 – 88 ] Hasil kuantum fluoresensi relatif Φ f ditentukan dengan membandingkannya dengan pewarna kumarin sebagai referensi (lihat bab 2.1 ESI). [ 89 ] Hasil kuantum aril phthalimide berada dalam kisaran Φ f = 0,3–0,6; bromo phthalimide 6 menunjukkan yang terendah ( Φ f = 0,1) karena efek atom berat memfasilitasi persilangan antarsistem dan peluruhan non-radiatif. Hasil kuantum dalam etanol lebih rendah dibandingkan dengan yang ada dalam DMSO. Hal ini lagi-lagi merupakan hasil dari sifat donor ikatan hidrogen dari etanol dan pemadaman fluoresensi yang diakibatkannya. [ 81 , 82 ] Kelompok donor elektron (EDG) pada substituen aromatik umumnya menghasilkan Φ f yang lebih tinggi daripada ftalimida dengan kelompok penarik elektron (EWG) di arena.
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
a) Spektrum serapan yang dinormalkan dari phthalimides 6 , 8a–g (10−4 mol L −1 , DMSO). b) Spektrum fluoresensi yang dinormalkan dari phthalimides 6 , 8a–g (ditetapkan pada absorbansi 0,1, DMSO). c) Spektrum serapan yang dinormalkan dari luminol 2 , 9a–g ( c = 5, 10−5 mol L −1 ) dalam penyangga karbonat/bikarbonat (0,1 mol L −1 , pH 10,5). Spektrum dinormalkan ke pita serapan panjang gelombang terpanjangnya. d) Spektrum CL yang dinormalkan (tidak dikoreksi) dari luminol dengan katalis hemin. e) Pengukuran kinetik turunan luminol dengan katalis hemin. f) Pengukuran kinetik turunan luminol dengan katalis kobalt(II).
Tabel 1. Sifat spektral terpilih dari turunan ftalimida.
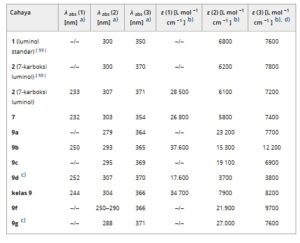
a) Penyerapan maksimum c = 10−4 mol L −1 .
b) Koefisien penyerapan molar pada panjang gelombang penyerapan terpanjang.
c) Konsentrasi sama dengan absorbansi 0,1.
d) Pergeseran Stokes.
e) Hasil kuantum fluoresensi relatif terhadap pewarna kumarin sebagai referensi, kesalahan relatif semua hasil kuantum fluoresensi berada dalam 5%.
2.3 Sifat Fotofisika Aril Luminol
Sifat fotofisika 7-aril luminol 9 yang disintesis dibandingkan dengan luminol induk 1 dan 7–karboksi luminol 2. Efek yang jelas dari pola substitusi individual pada kelarutan dalam media penyangga berair, penyerapan, emisi, dan CL dalam kondisi yang berbeda diamati. Absorbansi dalam penyangga karbonat/bikarbonat (0,1 mol L −1 , pH 10,5) berubah secara signifikan dengan pengenalan substituen aromatik pada posisi C 7 (Gambar 1c , Tabel 2 ). Gugus 7-aril dengan substituen para hanya berdampak pada penyerapan maksimum kedua λ max (2), sedangkan substitusi meta –aril hanya memengaruhi penyerapan maksimum pertama λ max (1). Secara khusus, luminol 7-aril tersubstitusi para 9a , 9c , dan 9g menunjukkan pergeseran hipsokromik dan hiperkromik dari λ max (2) versus 2. Koefisien penyerapan menunjukkan peningkatan ε (2): ε (3) menjadi 3:1 melalui substitusi para –aril (Gambar S7, Informasi Pendukung). Turunan tersubstitusi meta 9b , 9d , dan 9e mempertahankan rasio 1:1 dari ε (2): ε (3), mirip dengan 2 , dan tidak menunjukkan pergeseran λ max (2). Pergeseran batokromik pita energi tinggi λ max (1) diamati, yang menghasilkan tumpang tindih sebagian dengan λ max (2). Selain itu, sifat substituen arena perifer memengaruhi λ max (2) dan λ max (3), terlepas dari pola substitusi. EDG menyebabkan pergeseran hipsokromik pada dua titik maksimum terakhir, sementara EWG tidak menyebabkan pergeseran tambahan (yaitu 9a vs. 9c ; 9b vs. 9d ). Pertimbangan semua pengamatan menghasilkan kesimpulan berikut pada posisi λ maks (2): EDG pada posisi para dari substituen aril mengakibatkan pergeseran hipsokromik yang besar ( 9a ); EWG para atau meta -EDG memberikan pergeseran hipsokromik sedang ( 9b , 9c , 9g , 9e); meta -EWG tidak berdampak ( 2d ) (detail dalam ESI, bab 2.2, Gambar S8, Tabel S1, Informasi Pendukung). Prekursor cross-coupling 7-bromo luminol 7 menunjukkan pola penyerapan yang sama seperti karboksi luminol 2 , tetapi dengan penyerapan λ max (3) yang bergeser ke biru pada 354 nm. Luminol poli-fungsional 9f dengan EDG (OMe) dan EWG (F, piridina) menunjukkan pita lebar pada 250–290 nm, mungkin lapisan pita λ max (1) batokromik dan pita λ max (2) yang sangat hipsokromik. Rasio koefisien penyerapan molar 2:1 adalah rata-rata pola meta – dan para – substitusi individual . Untuk studi CL komparatif luminol, kami menguji kelarutan 7 , 9a–g dalam penyangga karbonat/bikarbonat (0,1 mol L −1 , pH 10,5). Sementara karboksiluminol polar 2 mudah larut, kuantum CL maksimum yang dihasilkan Φ CL dari turunan 9a , 9b , dan 9e hanya tercapai setelah 3d ketika pelarutan dalam penyangga telah selesai. Penambahan volume kecil DMSO atau ultrasonikasi sebelumnya tidak meningkatkan kinetika pelarutan, yang mungkin disebabkan oleh polaritas rendah luminol aril (vs. 1 ) dan mungkin penumpukan π –arena.
Tabel 2. Data penyerapan turunan luminol dalam penyangga karbonat/bikarbonat (0,1 mol L −1 , pH 10,5).
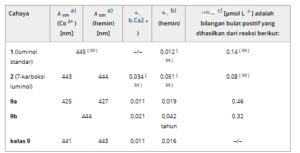
a) Penyerapan maksimum c = 5 × 10−5 mol L −1 .
b) Koefisien penyerapan molar c = 5 × 10 −5 mol L −1 .
c) Diukur setelah 2 hari, curah hujan setelah 5 hari.
d) ( Miring ) angka menunjukkan posisi pita serapan.
Bifenil tanpa substituen orto diketahui mengadopsi konformasi planar dalam keadaan padat dengan gaya antarmolekul yang signifikan. [ 90 – 92 ] Fitur tersebut dapat menjelaskan tidak adanya pelarutan lambat untuk luminol 6- dan 8-aril terkait oleh Mikroulis et al. [ 54 ] Sayangnya, turunan m –nitrofenil 9d dan turunan hidrazon 9g mengendap 5d setelah persiapan sampel dan tidak dievaluasi lebih lanjut sebagai reagen CL. Turunan luminol 7 , 9c , dan 9f menunjukkan Φ CL yang sangat rendah di bawah 0,001 dan juga tidak diselidiki. Perbandingan perilaku CL dari luminol induk 1 , 7-karboksi luminol 2 , dan tiga turunan 7-aril luminol 9a , 9b , dan 9e diberikan dalam Tabel 3 dan Gambar 1d . CL diinisiasi dengan mereaksikan campuran luminofor dan katalis logam (100 μL: 200 μmol L −1 luminofor, 2 μmol L −1 /1 mol% garam Co(II) atau Fe(III)-hemin) dan H 2 O 2 (100 μL: 60 mmol L −1 ) dalam buffer karbonat/bikarbonat pH 10,5 berair (ESI, bab 1.4). Setelah pengocokan selama 5 detik, spektrum emisi direkam (300–650 nm, langkah 1 nm) dengan waktu integrasi 20 ms. Terlepas dari katalis, 7–karboksi luminol ( 2 ) dan turunan meta -aril 9b dan 9e memberikan emisi maksimum CL pada 443 nm; 9a menunjukkan CL maksimum pada 426 nm (Gambar 1d , Gambar S9, Informasi Pendukung, Tabel 3 ). Emisi 9a yang bergeser ke biru (vs. 9b , 9e ) dapat dikaitkan dengan substitusi arena yang berbeda ( para vs. meta ). Data perhitungan aminoftalat yang sesuai menunjukkan bahwa spektrum emisi luminol yang disebutkan di atas dikaitkan dengan transisi S0 → S1 dan S0 → S ≥2 , dengan kontribusi yang bervariasi . Untuk 9a , kontribusi S0 → S ≥2 lebih besar daripada untuk 9b dan 9e .(Tabel S4B, Informasi Pendukung), yang dapat mengakibatkan emisi pergeseran biru yang teramati.
Tabel 3. Sifat CL terpilih dari turunan luminol dari peroksidasi yang dikatalisis kobalt(II) dan hemin dalam penyangga karbonat/bikarbonat (0,1 mol L −1 , pH 10,5).
a) CL maksimum.
b) Hasil kuantum CL relatif dengan m -karboksi luminol ( 2 ) sebagai referensi, diadaptasi dari Rink et al. [ 59 ] Kesalahan relatif dari semua hasil kuantum CL berada dalam kisaran 10%.
c) Batas deteksi dalam uji H 2 O 2 dengan katalis hemin. Untuk semua kondisi eksperimen, lihat ESI Bab 1.4.
Setelah wawasan pertama ini ke dalam sifat-sifat CL dari luminol, kinetika emisi dipelajari sebagai pengukuran peluruhan menggunakan kobalt(II) dan hemin sebagai katalis logam (Gambar 1e,f ). Reaksi CL dimulai pada kondisi yang sama seperti yang dijelaskan sebelumnya untuk spektrum emisi tetapi direkam selama periode 50 menit dalam mode titik akhir (integral emisi) dengan waktu integrasi 0,2 detik (lihat ESI, bab 1.4). Peluruhan CL dari sistem luminofor-H2O2 dengan hemin tidak hanya menunjukkan intensitas awal yang lebih tinggi, yang bermanfaat untuk pembacaan analitis yang cepat dan sensitif, tetapi juga mengungkapkan laju peluruhan intensitas yang lebih tinggi dari CL yang dihasilkan dibandingkan dengan katalis Co(II). Secara umum, kinetika CL sangat bergantung pada konsentrasi radikal luminol yang terbentuk. Sesuai dengan laju peluruhan hemin yang intensitasnya lebih tinggi, Bastos et al. menjelaskan mekanisme CL dari sistem luminol-H 2 O 2 -hemin yang beroperasi melalui dua perantara radikal luminol; Burdo et al. juga menyimpulkan untuk katalis Co(II) mekanisme radikal. [ 38 , 93 ] Jejak kinetik kualitatif dari luminol aril yang diselidiki mirip dengan luminol 7–karboksi acuan kami, menunjukkan jalur reaksi CL yang kongruen.
Secara umum, luminol yang mengandung substituen EDG, seperti 9a , 9b , dan 9e , memberikan nilai Φ CL yang lebih unggul , yang mungkin disebabkan oleh stabilisasi zat antara reaktif dalam jalur radiatif. Karena donasi elektron ke dalam ikatan O O dari zat antara peroksida disarankan sebagai langkah kunci dalam mekanisme kemieksitasi ( Gambar 2a ), EDG tambahan pada struktur inti akan lebih menyukai fragmentasi peroksida radiatif daripada non-radiatif. [ 94 ] Pengaruh menguntungkan dari EDG sepenuhnya sesuai dengan struktur luminol yang dilaporkan sebelumnya. [ 56 , 95 , 96 ] Dalam seri yang dipelajari di sini, turunan m –metoksifenil 9b adalah luminofor paling terang dengan Φ CL sekitar tiga kali lebih tinggi daripada luminol ( 1 ) itu sendiri tetapi sedikit lebih rendah daripada 2 ( 9b : ≈0,04; 1 : ≈0,01; 2 : ≈0,05). 9a dan 9e menunjukkan nilai Φ CL yang mirip dengan 1 .
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
a) Mekanisme yang diterima secara umum dari CL luminol melalui perantara diazaquinone dan peroksida utama menuju produk aminoftalat terminal ( 10 ). b) Perbandingan panjang gelombang serapan luminol secara eksperimental (a, batang merah) dan dihitung (b dan c, batang biru dan putus-putus) (data dari Tabel 2 dan Tabel S4A, Informasi Pendukung). c) Perbandingan panjang gelombang serapan maksimum emisi luminol secara eksperimental (a, batang merah) dan dihitung (b, batang biru) (data dari Tabel 2 ‘hemin’ dan Tabel S4B, Informasi Pendukung).
Untuk menetapkan derivatif baru kami sebagai probe benchmark potensial, batas deteksi (LOD) mereka dalam uji H 2 O 2 ditentukan. Baik derivatif metoksifenil 9a dan 9b memberikan nilai yang sangat rendah dalam rentang mikromolar bawah untuk deteksi H 2 O 2 , yang sebanding dengan LOD yang ditentukan dalam kondisi serupa untuk luminol standar ( 1 ) dan 7–karboksi luminol ( 2 ) oleh Rink et al. (Gambar S11, Informasi Pendukung, Tabel 3 ). [ 59 ] Selain deteksi hidrogen peroksida, luminofor sendiri dapat berfungsi sebagai analit yang akan diuji. LOD yang ditentukan dengan memvariasikan konsentrasi luminofor berada dalam rentang pikomolar, dengan hemin lebih efektif daripada kobalt(II) (Gambar S10, Tabel S2, Informasi Pendukung). Dalam sistem hemin, turunan aril luminol yang paling menjanjikan, 9b, terbukti melampaui LOD luminol standar [ 59 ] dengan faktor dua, menjadikan 9b sangat menarik untuk aplikasi analisis jejak. Selain itu, akses sintetis yang mudah dan sifat CL yang baik dari 9b merupakan dasar yang menjanjikan untuk penyelidikan lebih lanjut terhadap konjugat terkait eter dari probe luminol dan penggunaannya sebagai elemen biorecognition (yaitu, antibodi, aptamer, dan reseptor).
2.4 Perhitungan Kimia Kuantum
Mekanisme CL luminol yang diterima secara umum melibatkan degradasi oksidatif multi langkah dari motif phthalhydrazide menjadi aminophthalate ( 10 ) dalam media basa (Gambar 2a ). [ 52 , 54 , 94 ] Perantara utama adalah peroksida siklik yang terbentuk dari diazaquinone. [ 97 , 98 ] Peroksida siklik ini berubah, setelah eliminasi dinitrogen gas, menjadi keadaan tereksitasi aminophthalate ( 10* ). [ 94 , 99 – 102 ] Relaksasi radiatif yang terakhir menghasilkan luminesensi yang dapat diamati dan aminophthalate dalam keadaan dasarnya ( 10 ). [ 52 , 54 , 94 – 96 , 102 – 106 ] Laporan sebelumnya mendokumentasikan kesesuaian kalkulasi kimia kuantum untuk rasionalisasi CL yang berasal dari luminol. [ 52 , 54 , 94 ] Oleh karena itu, kami menyelidiki sifat fotofisika luminol 2 , 7 , 9a–g dan produk yang diharapkan dari CL, aminoftalat 10a , 10b , 10e , dan 10h . Geometri turunan luminol yang disintesis dalam keadaan dasar dioptimalkan pada tingkat teori BHHLYP 6-311G(d, p) (lihat bab 1.5 ESI). Polaritas dan hidrofilisitas luminol menentukan kapasitasnya untuk membentuk ikatan hidrogen, yang merupakan kunci untuk absorbansi dan sifat CL. [ 107 ] Momen dipol luminol yang dihitung meningkat dalam urutan: 9a ≈ 9f ≈ 9g < 9e ≈ 9b < 7 < 2 < 9d < 9c (Gambar S12, Informasi Pendukung) . Efek pelarut meningkatkan polaritas semua molekul kecuali 9a dan 9b . Oleh karena itu, polaritas luminol serta ionisasi gugus amino mereka harus dipertimbangkan dalam pendekatan mendatang. Kami secara khusus mempelajari transisi elektronik bahan awal luminol dan produk aminoftalat yang sesuai (lihat bab 2.3 ESI, Gambar S13, S14, dan Tabel S4, Informasi Pendukung). Pada kedua jenis kromofor, beberapa π → Transisi π * dapat terjadi dengan probabilitas tinggi dan berbagai kontribusi, menjelaskan pola spektral kompleks dari kedua set senyawa. Dua atau tiga pita serapan diamati dalam semua spektrum UV/Vis yang dihitung. Pita yang dihitung umumnya bergeser ke biru dibandingkan dengan spektrum eksperimen (Gambar 2b ). [ 108 ] Pita serapan yang dihitung dalam kisaran 294–315 nm terutama dikaitkan dengan transisi S 0 → S 1 (HOMO → LUMO) dan sesuai dengan λ abs eksperimen (3) (Gambar S15c, Informasi Pendukung, batang hijau). Pita dalam kisaran 233–254 nm dikaitkan dengan transisi yang lebih tinggi S 0 → S ≥2 dengan berbagai kontribusi (HOMO– n → LUMO + n , n = 1–5). Posisi λ abs eksperimental (2) berkorelasi baik dengan pita panjang gelombang terendah dari spektrum yang dihitung (Gambar S15a,b, Informasi Pendukung; batang merah vs. biru).
Secara keseluruhan, spektrum serapan terhitung dari struktur luminol yang dioptimalkan sebagian besar sesuai dengan data eksperimen, dan oleh karena itu, evaluasi teoritis tersebut dapat berfungsi sebagai alat prediksi untuk turunan luminol yang ditargetkan. Pertimbangan proses solvasi dan ionisasi dapat sangat meningkatkan kualitas prediksi tersebut. Lebih jauh, kami mensimulasikan spektrum emisi aminoftalat luminescent 10 . Lima keadaan tereksitasi yang berbeda dihitung untuk setiap turunan aminoftalat. Probabilitas transisi diperkirakan dari kekuatan osilator ( f ), konstanta laju radiasi ( k r ), dan energi transisi E
![]()
Spektrum luminesensi terhitung dari struktur aminoftalat menunjukkan beberapa karakteristik utama (lihat Tabel S4B, Informasi Pendukung untuk detailnya). Pita emisi panjang gelombang tertinggi, yang dikaitkan dengan transisi S0 → S1 , sebagian besar sesuai dengan spektrum eksperimen (Gambar 2c ). Pita emisi yang sangat mirip telah diperoleh untuk aminoftalat keadaan tereksitasi 10* yang berasal dari 2 , 9a , dan 9b (yaitu 10h* , 10a* , 10b* ). Pergeseran merah yang signifikan (≈40 nm) dari pita emisi 10e* terhitung dapat menjadi konsekuensi dari fleksibilitas konformasi yang tinggi. Umumnya, mekanisme multistep kompleks CL luminol yang melibatkan berbagai langkah kimia (yaitu, asam-basa, oksidasi, katalis logam, penambahan, eliminasi, dan proses reorganisasi elektronik; Gambar 2a ) [ 94 , 99 – 102 ] melarang korelasi langsung perilaku CL luminol dengan sifat fotofisika dari aminoftalat yang dihasilkan. Misalnya, probabilitas emisi terhitung yang lebih tinggi untuk aminoftalat keadaan tereksitasi 10a* dan 10b* versus 10h* dan 10e* tidak konsisten dengan data eksperimen (lihat bab 2.3 ESI, Tabel S4B, Informasi Pendukung, dan Tabel 3 ). Penyimpangan tersebut sebagian besar disebabkan oleh hasil kuantum CL yang diamati Φ CL merupakan lapisan kelarutan, hasil reaksi kimia, efisiensi pembentukan keadaan tereksitasi, dan probabilitas emisi. [ 54 ] Oleh karena itu, CL dari turunan luminol yang menunjukkan perbedaan mencolok antara emisi aminoftalat dan Φ CL sangat didominasi oleh efisiensi berbagai langkah
oksidasi kimia.
3 Kesimpulan
Kami telah berhasil memperluas ketersediaan sintetis pewarna fluoresen dan luminesen melalui rute baru ke ftalimida tersubstitusi-aril 8a–g dan luminol 9a–g . Kopling silang tipe Suzuki dari prekursor ftalimida 6-bromo yang praktis 6 dengan asam arilboronat komersial memungkinkan sintesis serangkaian turunan luminol 7-aril yang baru. Karakterisasi fotofisika terperinci dari ftalimida baru 8a–g mendokumentasikan korelasi pola substitusi aromatik dan fluoresensi yang diamati. meta -EDG dalam substituen 6-aril memberikan Φ f yang lebih tinggi daripada pada posisi para , sedangkan nitro-EWG mengurangi fluoresensi. Tidak ada korelasi langsung dari Φ f ftalimida dan Φ CL dari luminol yang dihasilkan. Di antara turunan luminol yang baru disiapkan, 7–(3–metoksifenil)-luminol 9b menunjukkan Φ CL tertinggi , yaitu lebih dari tiga kali lebih tinggi daripada luminol induk 1. DFT diterapkan untuk merasionalisasi penyerapan yang diamati dan perilaku CL. Spektrum yang dihitung dan eksperimental memiliki kesesuaian yang baik, sehingga prediksi luminofor yang tidak diketahui dapat dibuat, terutama ketika polaritas pewarna dan proses ionisasi dipertimbangkan. Rute sintesis yang mapan menuju rantai samping aromatik fungsional dalam pewarna fluoresensi dan luminesensi dapat berfungsi dengan baik sebagai platform untuk desain probe analitis yang sangat sensitif untuk aplikasi penginderaan dan pelacakan. Studi lebih lanjut tentang penerapan tag reaktif untuk konjugasi antibodi dan nanopartikel saat ini sedang berlangsung di laboratorium kami.





Tinggalkan Balasan