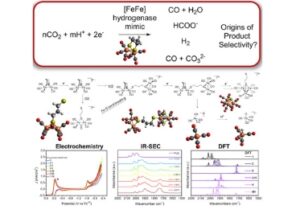
Abstrak Grafis
Dengan menggabungkan voltametri siklik, spektroelektrokimia inframerah, dan metode teori fungsi kerapatan, reduksi CO 2 oleh tiruan hidrogenase [FeFe] diteliti. Meskipun kemampuannya membentuk spesies hidrida tereduksi yang stabil, katalis ini tidak secara selektif mereduksi CO 2 menjadi HCOO − dalam kondisi yang diuji. Hal ini menunjukkan jalur yang lebih kompleks menuju format yang melibatkan spesies Fe mononuklear atau trinuklear mungkin terlibat.
Abstrak
Laporan terkini menunjukkan bahwa tiruan hidrogenase [FeFe] aktif untuk reduksi elektrokimia CO 2 menjadi format (HCOO − ). Di sini, reduksi elektrokimia CO 2 dengan tiruan hidrogenase [FeFe] [Fe 2 (μ-pdt)(CO) 6 , 1 , di mana pdt = propana-1,3-dithiolate] dalam asetonitril dilaporkan. Dengan adanya asam lemah, metanol (MeOH), 1 mereduksi CO 2 menjadi CO (Efisiensi Faradaic maksimum [FE maks ] sebesar 16 ± 6%) dan HCOO − (FE maks = 20%) dan menghasilkan H 2 (FE maks = 56 ± 4%). Tanpa penambahan MeOH, 1 bereaksi dengan air adventif untuk membentuk H 2 (FE maks = 85 ± 1%), HCOO − (FE maks = 7,8%), dan CO (FE maks = 7 ± 3%) dengan CO 3 2− yang dideteksi oleh spektroskopi inframerah. Pembentukan produk bergantung pada potensial: potensial yang lebih negatif meningkatkan selektivitas untuk HCOO − daripada CO. Reduksi pertama 1 membentuk dimer yang dijembatani pdt, 2 . Namun, reduksi 2 pada potensial yang diperlukan untuk reduksi CO 2 elektrokimia menghasilkan dua spesies baru. Dengan menggunakan teori fungsional kerapatan, dan spektroelektrokimia inframerah (IR-SEC), struktur ini diidentifikasi sebagai [Fe(CO) 4 ] 2− ( 3 ) dan spesies trinuklear Fe 3 ( 4 ). Sementara spesies ini dapat mereduksi CO 2 menjadi CO dan HCOO − , pembentukan H 2 yang dominan mengungkapkan masalah kinetik dalam reduksi CO 2 . Pekerjaan ini menawarkan untuk mempertimbangkan jalur mekanistik alternatif yang bersaing dan menjelaskan kurangnya selektivitas produk saat menggunakan katalis reaksi evolusi hidrogen untuk reduksi CO2 menjadi HCOO
1 Pendahuluan
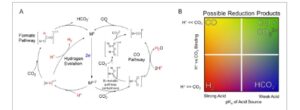
Peningkatan berkelanjutan dalam CO2 atmosfer dan akhirnya menipisnya bahan baku petrokimia telah mempertahankan minat berkelanjutan dalam pemanfaatan CO2 sebagai sumber C1 untuk bahan bakar cair. [ 1 ] Rute yang menjanjikan untuk proses ini adalah reduksi elektrokatalitik CO2 menggunakan katalis homogen. [ 2 ] Untuk tujuan ini, katalis logam transisi yang mengandung logam yang melimpah di bumi seperti Mn, [ 3 ] Ni, [ 4 ] Co, 4 , 5 dan Fe [ 6 ] telah dipelajari secara ekstensif dalam beberapa tahun terakhir. Dua transformasi yang paling mudah, reduksi dua elektron, dua proton CO2 menjadi CO atau asam format sangat menarik untuk pemanfaatan lebih lanjut dalam kimia Fischer–Tropsch dan sel bahan bakar asam format, masing-masing. [ 7 ] Selektivitas antara kedua produk bergantung pada dua reaksi awal yang berbeda ( Gambar 1A ). Format umumnya dibuat melalui protonasi awal situs aktif diikuti oleh transfer langsung hidrida ke CO2 . Sebaliknya, reduksi menjadi CO memerlukan penambahan langsung CO2 ke situs logam aktif diikuti oleh O-protonasi berikutnya dari aduk untuk membentuk hidroksikarbonil, [ 8 ] atau dengan deoksigenasi dari perantara CO2 tereduksi dalam sistem multimetalik [ 9 ] dan asam Lewis. 3 , 6 , 10 Dalam konteks ini, substrat pengikat di situs aktif dan sumber proton memainkan peran penting dalam mempengaruhi selektivitas produk.
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
A) Reduksi situs aktif (M), terdapat dua jalur berbeda yang dapat mengarah pada pemilihan produk yang berbeda. Jika M terprotonasi, maka produk yang muncul dapat berupa H 2 dari HER atau HCO 2 − dari penyisipan CO 2. Akan tetapi, jika CO 2 berikatan, CO terbentuk baik dari protonasi dan pembentukan H 2 O berikutnya atau dari rute anhidrat disproporsionasi CO 2 di mana CO dan CO 3 2− terbentuk, biasanya melalui jalur bimetalik. B) Termodinamika reaksi dikontrol oleh p Ka dari sumber asam dan energi pengikatan relatif proton dan CO 2 ke situs aktif.
Dari sudut pandang energetik, selektivitas antara kedua jalur ini bergantung pada pH sumber proton yang ditambahkan dan perbedaan energi pengikatan H + dan CO2 ( Gambar 1B ). Dalam skenario ideal, mengubah sumber proton akan menghasilkan pergeseran lateral pada diagram pada Gambar 1B , yang mengubah selektivitas sistem. Misalnya, katalis reaksi evolusi hidrogen (HER) yang baik, yang membentuk hidrida stabil, diharapkan dapat mereduksi CO2 menjadi HCOO- terutama ketika sumber proton cukup lemah untuk menunda timbulnya HER hingga penambahan CO2 dapat terjadi. Namun, dalam praktiknya, selektivitas katalitik lebih rumit. Hal ini sering ditentukan oleh interaksi kompleks dari faktor-faktor seperti stabilitas dan reaktivitas katalis serta hambatan termodinamika dan kinetik reaksi di bawah kondisi baru. Hambatan kinetik dapat mencegah jalur tertentu menjadi layak, pengikatan H + terkait dengan pKa sumber proton , dan katalis mungkin tidak stabil terhadap kondisi baru yang diperlukan untuk perubahan selektivitas. Semua faktor ini sering kali menyebabkan distribusi produk yang kurang optimal meskipun ekspektasi diberikan dalam setiap kondisi reaksi yang ditunjukkan pada Gambar 1B . Oleh karena itu, pemahaman yang lebih mendalam tentang perilaku katalis diperlukan, terutama saat menggunakan katalis HER untuk reaksi reduksi CO 2 , di mana interaksi jalur protonasi dan kondisi reaksi memainkan peran penting dalam menentukan selektivitas produk.
Peniru hidrogenase [FeFe] telah terbukti mengkatalisis (HER) dengan asam kuat dan lemah. [ 11 ] Katalis ini memiliki beberapa jalur protonasi dan reduksi untuk HER yang melibatkan kooperativitas Fe–Fe. [ 12 ] Baru-baru ini, peniru hidrogenase [FeFe] ini telah dieksplorasi untuk reaktivitasnya terhadap reduksi CO 2 . Misalnya, Fe 2 (μ-bdt)(CO) 6 (di mana bdt = benzena-1,2-dithiolate) mampu mereduksi CO 2 menjadi format sebagai produk utama dengan adanya asam lemah. 6 , 13 Namun, mekanisme jalur reaksi kurang dipahami dan tidak jelas apakah reaktivitas ini dapat ditransfer ke kompleks dengan ligan dithiolate jembatan lainnya, yang lebih mirip dengan pusat reaksi hidrogenase FeFe. 12 , 14 Di sini, kami menyelidiki reduksi CO 2 elektrokimia dari Fe 2 (μ-pdt)(CO) 6 , 1 , [di mana pdt = propana-1,3-dithiolate] dengan dan tanpa adanya MeOH sebagai asam lemah. Perhitungan IR-SEC dan DFT digunakan untuk mengungkap kemungkinan zat antara yang terbentuk selama kondisi reaksi yang memainkan peran penting dalam katalisis.
2 Hasil
2.1 Voltametri Siklik (CV)
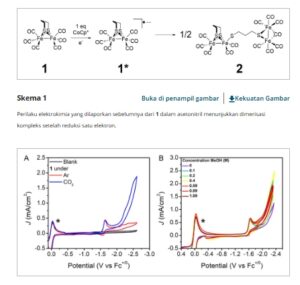
Sifat elektrokimia 1 telah dilaporkan sebelumnya dalam asetonitril. 12 , 15 Kompleks menunjukkan reduksi kuasi-reversibel satu elektron pada -1,65 V versus Fc +/0 diikuti oleh dua reduksi satu elektron yang lebih kecil dan ireversibel pada -2,18 dan -2,33 V versus Fc +/0 dan satu oksidasi pada -0,69 V versus Fc +/0 (Gambar 1A ). Ketidakterbalikan reduksi menunjukkan bahwa perubahan kimia senyawa mengikuti setiap reduksi. Reduksi pertama 1 adalah reduksi elektron tunggal menjadi 1* diikuti oleh dimerisasi spesies radikal untuk membentuk 2 ( Skema 1 ). 15 , 16 Hal ini dikonfirmasi oleh spektroelektrokimia inframerah (IR-SEC, ESI), yang menunjukkan pembentukan 2 pada potensial negatif dari reduksi pertama (Gambar 4 ). Dengan meningkatkan laju pemindaian, reduksi pertama menjadi lebih reversibel, dan oksidasi pada -0,69 V versus Fc +/0 menghilang, yang menunjukkan bahwa keduanya merupakan bagian dari proses dimerisasi yang dibatasi oleh difusi (Gambar S1, Informasi Pendukung). Pada laju pemindaian yang lebih tinggi, reduksi kedua dan ketiga menjadi reduksi tunggal yang ireversibel pada -2,16 V versus Fc +/0 , yang mengonfirmasi bahwa reduksi kedua dan ketiga dikaitkan dengan dimer (Gambar S2, Informasi Pendukung). Di bawah CO 2 dan tanpa adanya sumber proton, CV menunjukkan timbulnya arus katalitik pada reduksi kedua ( Gambar 2A ).
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
CV 1 mM 1 dalam MeCN kering dengan 100 mM [Bu 4 N][PF 6 ] A) dibersihkan dengan Ar (merah) dan CO 2 (biru) dan dibersihkan dengan CO 2 dengan tambahan MeOH B) dengan elektroda referensi Ag/AgCl, elektroda lawan grafit, dan elektroda kerja karbon kaca. Ferrosena (*) sebagai referensi internal. Laju pemindaian = 100 mV s −1 .
Untuk menekan evolusi H 2 , asam lemah, MeOH (p Ka 29,0 dalam DMSO), [ 17 ] digunakan sebagai sumber proton dalam penelitian ini, karena cukup kuat untuk memprotonasi spesies tereduksi tetapi cukup lemah untuk menunda timbulnya HER hingga reduksi kedua katalis. Peningkatan arus katalitik diamati dengan meningkatnya konsentrasi asam, dengan i cat / i p = 25,1 dalam 1 M MeOH dibandingkan dengan i cat / i p = 17,5 tanpa penambahan MeOH (Reduksi kedua digunakan untuk i p ). Hubungan ini menunjukkan katalisis yang bergantung pada proton (Gambar 2B ). Selain itu, ketika 1 M CD 3 OD digunakan, i cat / i p menurun hingga 15,1 (Gambar S4, Informasi Pendukung), yang menunjukkan efek isotop kinetik dan mengonfirmasi bahwa proton berpartisipasi dalam langkah pembatas laju. Dengan adanya CO 2 dengan atau tanpa sumber proton tambahan, CV (Gambar 2 ) dan IR-SEC (Gambar 4 ) pada reduksi pertama tetap tidak berubah. Hal ini menunjukkan bahwa baik CO 2 maupun MeOH tidak bereaksi dengan spesies radikal yang terbentuk setelah reduksi pertama dan bahwa spesies katalitik harus berasal dari reduksi dimer, 2.
2.2 Elektrolisis Potensial Terkendali (CPE)
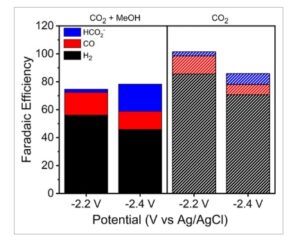
Percobaan CPE dari 1 di bawah CO 2 dengan dan tanpa MeOH mengungkapkan bahwa tiga produk reduksi CO 2 dibuat selama katalisis. Produksi CO dan H 2 ditentukan melalui kromatografi gas, dan HCOO − diidentifikasi oleh NMR. Di bawah CO 2 dengan 1 M MeOH, produk utama pada potensial reduksi kedua (−1,8 V vs. Ag/AgCl, ≈−2,2 V vs. FC+/0) adalah H 2 (Efisiensi Faradaic [FE] = 56 ± 4%), sedangkan FE untuk CO adalah 16 ± 6%. FE dari HCOO − adalah 2% melalui 3,8 pergantian relatif terhadap mol 1 dalam larutan ( Gambar 3 ). Distribusi produk berubah ketika elektrolisis massal dijalankan pada reduksi ketiga (−2,0 V vs. Ag/AgCl, ≈−2,4 V vs. Fc +/0). Sementara produk utama, H 2 (FE = 46 ± 14%) dan CO (12 ± 3%), tetap berada dalam kesalahan hasil yang diperoleh pada potensial yang lebih rendah, produksi HCOO − (FE = 12%) meningkat secara signifikan, dengan 3,5 kali pergantian relatif terhadap mol 1 dalam larutan. Peningkatan FE untuk HCOO − menunjukkan bahwa distribusi produk dengan adanya MeOH bergantung pada potensial yang diberikan dan bahwa produk yang terbentuk setelah reduksi ketiga kemungkinan bertanggung jawab atas produksi format.
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Efisiensi faradaik total dan selektivitas dari percobaan CPE 60 menit dengan 1 (2 mM) di bawah CO 2 dengan adanya 1 M MeOH (batang padat) dan tidak adanya MeOH (bergaris-garis).
Bahasa Indonesia: Dengan tidak adanya MeOH, elektrolisis massal pada potensial reduksi kedua menunjukkan penurunan produksi CO dengan FE sebesar 12 ± 3% dengan 3,4 pergantian relatif terhadap mol 1 dalam larutan. Namun, produk utama tetap H 2 (FE = 86 ± 1%) dengan HCOO − (FE = 3%) yang dapat dideteksi oleh NMR. Dalam kasus ini, pembentukan H 2 dan HCOO − menunjukkan bahwa katalis aktif harus membersihkan proton dari “air adventif” dalam larutan, elektrolit ([Bu 4 N][PF 6 ]), atau pelarut CH 3 CN. [ 18 ] Elektrolisis massal pada reduksi ketiga tanpa sumber proton tambahan meningkatkan produksi HCOO − hingga 8%, sementara produksi CO (FE = 7 ± 3%) dan H 2 (FE = 74 ± 9%) tetap sama dalam kesalahan katalisis pada reduksi kedua. Hal ini sekali lagi menegaskan potensi ketergantungan pada pembentukan HCOO− dan menunjukkan bahwa spesies aktif untuk produksi HCOO− kemungkinan besar terbentuk setelah reduksi ketiga.
Di bawah atmosfer Ar dengan 1M MeOH dalam MeCN, H 2 adalah produk utama pada potensial reduksi ketiga dengan FE 99 ± 24%. Namun, beberapa CO terdeteksi dengan FE 10 ± 1% yang menunjukkan bahwa, sementara dalam kondisi katalitik, degradasi katalis menyebabkan sebagian CO yang terbentuk selama elektrolisis (Gambar S7, Informasi Pendukung).
2.3 Spektroelektrokimia Inframerah
IR-SEC memberikan wawasan tentang spesies aktif yang terbentuk di bawah potensi yang diterapkan yang diperlukan untuk katalisis. Zat antara yang disintesis secara independen dan perhitungan Teori Fungsi Kepadatan (DFT) digunakan untuk mengidentifikasi struktur spesies yang ada pada setiap kondisi reaksi. Deskripsi terperinci tentang sintesis tersebut dan alasan di balik penetapan struktur pada spektrum IR-SEC disediakan dalam informasi pendukung. IR-SEC dalam kondisi inert menunjukkan pembentukan dimer, 2, pada reduksi pertama ( Gambar 4A,D ). Ketika potensi yang diterapkan ditingkatkan melampaui reduksi kedua, pita yang terkait dengan dimer tetap ada. Namun, konversi parsial terjadi, dan dua spesies baru diamati dengan pita intens pada 1741 cm −1 dan peningkatan lebih lanjut dalam intensitas pita lebar pada 1901 dan 1861 cm −1 (Gambar 4A ). Bahasa Indonesia : Mengikuti literatur dan analisis DFT kami (Gambar 4D dan ESI), kami menetapkan pita pada 1741 cm −1 sebagai puncak karakteristik untuk 3 , [Fe(CO) 4 ] 2− , yang dikenal luas sebagai “reagen Collman.” [ 18 ] Ini juga telah ditunjukkan sebagai produk sampingan yang terbentuk dari reduksi tiruan hidrogenase [FeFe] yang serupa. 15 Setelah peningkatan lebih lanjut dalam potensial yang diterapkan pada reduksi ketiga, spektrum didominasi oleh pita pada 2007, 1901, dan 1861 cm −1 , dan pita mewakili 3 (serta beberapa spesies minor). Menggunakan survei DFT dari kemungkinan produk (lihat ESI) dan laporan literatur sebelumnya, [ 19 ] kami menentukan bahwa pita ini sesuai dengan spesies Fe trinuklear, 4 (Gambar 4D dan S17.4, Informasi Pendukung).
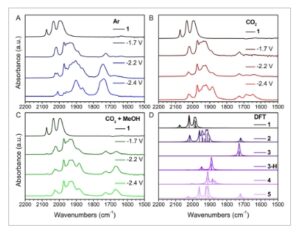
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
IR-SEC dari 5 mM dari 1 dalam MeCN kering dengan 100 mM [Bu 4 N][PF 6 ] dibersihkan dengan A) Ar, B) CO 2 tanpa penambahan MeOH dan C) dan dengan 1 M MeOH. Potensial dilaporkan vs Fc +/0 . D) DFT (set basis Def2-TZVP [ 23 ] menggunakan PCM dengan asetonitril sebagai pelarut) menentukan spektrum IR senyawa 1–5 . Spektrum divisualisasikan menggunakan FWHM 5 cm −1 dan bentuk garis Lorentzian.
Langkah-langkah kinetik yang lambat atau produk samping yang tidak reaktif yang terbentuk in situ selama katalisis dapat ditentukan melalui IR-SEC di bawah atmosfer CO 2 . Ketika potensial yang diterapkan ditahan melewati reduksi kedua tanpa adanya MeOH, ada penurunan intensitas (sehubungan dengan spektrum 2 ) pita pada 2017 dan 1954 cm −1 , serta munculnya dua pita baru pada energi yang lebih rendah yaitu 1685 dan 1647 cm −1 (Gambar 4B ). Pita energi yang lebih rendah ini merepresentasikan CO 3 2− dan mengusulkan mekanisme anhidrat yang melibatkan konversi dua ekuivalen CO 2 menjadi CO dan CO 3 2− , mirip dengan pengamatan dengan katalis reduksi CO 2 lainnya . [ 20 ] Sintesis independen (lihat ESI) dan preseden literatur, 15 menunjukkan penurunan intensitas dua pita energi yang lebih tinggi kemungkinan besar disebabkan oleh pembentukan 5 ( Skema 2 , Gambar 4D ) dari reduksi elektron tunggal 1 dalam keberadaan gas CO yang dihasilkan selama katalisis atau pemecahan dimer, 2 . Karena sifatnya yang jenuh terkoordinasi, 5 kemungkinan besar keluar dari siklus katalitik atau terlibat dalam langkah lambat dalam reduksi CO 2 . Peningkatan potensial ke reduksi ketiga menyebabkan peningkatan intensitas pita yang sesuai dengan CO 3 2− serta pembentukan pita baru pada 1884 cm −1 yang sesuai dengan versi terprotonasi dari 3, yang kami beri label 3-H (Gambar 3B dan 4D ).
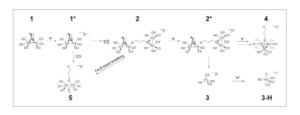
Skema 2
Buka di penampil gambar
Kekuatan Gambar
Perilaku elektrokimia 1 ditentukan melalui voltametri siklik, spektroelektrokimia inframerah, dan teori fungsi kerapatan. 1 menjalani jalur ECECEC, pertama-tama membentuk radikal ( 1* ), diikuti oleh dimerisasi untuk membentuk 2 . Reduksi 2 perlahan berubah menjadi 3 pada −2,18 V vs Fc +/0 dan 4 pada potensial lebih besar dari −2,33 V vs Fc +/0 . Dalam kondisi katalitik, 3 diprotonasi untuk membentuk 3-H . Selain itu, 5 terbentuk baik dari reduksi 1 dengan adanya CO atau dari pemutusan ikatan Fe S pada 2 .
Bahasa Indonesia: Di hadapan 1 M MeOH di bawah atmosfer CO2 , penerapan potensial melewati reduksi kedua tidak menunjukkan pembentukan CO32− karena pita pada 1685 dan 1647 cm −1 tidak muncul (Gambar 4C ). Sebaliknya, ada puncak tunggal yang terbentuk pada 1667 cm −1 , yang berhubungan dengan air, 8 produk sampingan yang terbentuk selama reduksi CO2 dengan adanya proton. Selain itu, pita pada 1884 cm −1 muncul setelah reduksi kedua dibandingkan dengan yang ketiga dalam kondisi anhidrat, yang selanjutnya menunjukkan bahwa puncak ini kemungkinan berasal dari spesies terprotonasi 3-H (Gambar 4D ). Ada sedikit perubahan dalam spektrum ketika potensial yang diterapkan berada di luar reduksi ketiga. Intensitas pita pada 1884 cm −1 sedikit menurun, dan intensitas pita pada 1667 cm −1 yang berhubungan dengan air sedikit meningkat.
3 Diskusi
Sementara [FeFe] selektif untuk H 2 dengan asam kuat dan membentuk hidrida yang stabil terhadap reduksi, reaktivitas ini secara inheren tidak memungkinkan konversinya menjadi katalis reduksi CO 2 menjadi HCOO − seperti yang ditunjukkan oleh spesifisitas yang tidak berperilaku baik terhadap produk tereduksi oleh 1 . Analisis elektrokimia, spektroskopi, dan DFT gabungan memberikan wawasan tentang selektivitas produk ini dan hambatan untuk mengubah katalis HER menjadi katalis reduksi CO 2 , terutama jika dibandingkan dengan senyawa dan sistem yang serupa. Sementara Fe 2 (μ-bdt)(CO) 6 yang dilaporkan oleh Cheng 6 mengalami reduksi dua elektron pada −1,30 V versus Fc +/0, 1 hanya mengalami reduksi satu elektron pada −1,65 V versus Fc +/0 . Preseden literatur menunjukkan bahwa penggunaan asam yang lebih kuat, seperti asam asetat (p Ka dalam MeCN = 22,6), [ 21 ] cukup untuk menginduksi 1* yang direduksi tunggal untuk membentuk spesies hidrida alih-alih dimerisasi untuk membentuk 2 . 11 , 12 Namun, seperti yang ditentukan oleh IR-SEC dan CV, asam lemah, MeOH, tidak cukup kuat untuk memprotonasi 1* sebelum pembentukan 2 , yang menunjukkan proses elektrokimia (E) diikuti oleh proses kimia (C) sebelum katalisis. Dimer, 2 , memerlukan reduksi lebih lanjut untuk diubah menjadi spesies aktif.
Karena potensial dipindai negatif dari reduksi pertama 1 , permulaan katalisis sesuai dengan munculnya pita yang terkait dengan 2* dan 3 , seperti yang terungkap dalam studi IR-SEC (Gambar S11, Informasi Pendukung). Pembentukan 3 dihasilkan dari labilisasi ligan tiolat karena keadaan oksidasi formal rendah dari Fe pada reduksi kedua, diikuti oleh dekomposisi. Katalisis setelah reduksi kedua menghasilkan syngas, karena H 2 dan CO terbentuk dalam rasio ≈3:1. Kehadiran CO 3 2− yang diamati dalam IR-SEC menunjukkan perubahan mekanisme untuk reduksi CO 2 yang mirip dengan yang diusulkan dalam Skema 1 , yang melibatkan reduksi/disproporsionasi anhidrat CO 2 . Penurunan hasil produksi CO dalam kondisi ini dibandingkan dengan saat MeOH ditambahkan kemungkinan besar karena hambatan tambahan yang diperkenalkan oleh kebutuhan untuk ekuivalen kedua CO 2 dalam mekanisme reduksi/disproporsionasi. Menariknya, H 2 masih diproduksi dalam kondisi ini, yang menunjukkan bahwa “air adventif” cukup aktif untuk memprotonasi hidrida yang terbentuk tetapi tidak cukup kuat untuk memprotonasi aduk COOH untuk menghasilkan CO dan air.
Langkah lain yang sebelumnya tidak teramati dalam kompleks di-besi yang dilaporkan di sini adalah bahwa reduksi ketiga dari 1 mengarah pada pembentukan 4 , spesies besi trinuklear yang bertepatan dengan peningkatan produksi HCOO − . Reaktivitas ini mirip dengan yang ditentukan pada reduksi tiruan hidrogenase FeFe yang serupa, dengan satu tiol penghubung. [ 22 ] Pekerjaan oleh Berben dan rekan kerja telah menunjukkan bahwa gugus karbonil besi yang serupa bersifat selektif untuk reduksi CO 2 menjadi HCOO − . 6 , 19 Menariknya, telah dilaporkan bahwa ada peningkatan selektivitas untuk pembentukan HCOO − dengan antar-jemput proton yang lemah. 6
Selain itu, dua produk lain diidentifikasi selama katalisis. IR-SEC dalam kondisi katalitik mengungkapkan bahwa 5 terbentuk secara koordinatif jenuh, yang mungkin dihasilkan dari pembelahan ikatan Fe S dalam 2 atau dari reaksi 1* dengan CO. Lebih jauh, 3-H dibentuk oleh protonasi 3 . Baik 3-H dan 5 kemungkinan merupakan zat antara atau produk dekomposisi yang dapat diamati, seperti yang diamati selama katalisis, yang menunjukkan penumpukan spesies yang signifikan.
Secara keseluruhan, pembentukan tiga spesies berbeda, 2* , 3 , dan 4 , masing-masing dengan aktivitas reduksi CO2 dan HER yang berbeda , menjelaskan kisaran produk yang diamati selama katalisis. Penting untuk menyatakan bahwa hasil yang disajikan dalam karya ini hanya menunjukkan keberadaan spesies ini dalam setiap kondisi reaksi dan tidak mengonfirmasi peran spesifik mereka dalam mekanisme reduksi CO2 . Sementara kami menunjukkan beberapa bukti yang menunjukkan bahwa 3 adalah spesies aktif untuk reduksi CO2 menjadi CO dan HER dan bahwa 4 terlibat dalam pembentukan HCOO- , peran mereka dalam katalisis masih bersifat dugaan tanpa penyelidikan independen lebih lanjut tentang perilaku elektrokatalitik mereka melalui perhitungan IR-SEC dan DFT.
Namun, yang dapat dipelajari dari hasil ini adalah bahwa spesies yang baru terbentuk ini menunjukkan aktivitas HER asli mereka dan sangat menyukai pengikatan H + dan favorabilitas kinetik bagi spesies hidrida untuk diprotonasi lebih lanjut, yang mengarah ke H 2 sebagai produk utama. Selain itu, sementara MeOH cukup lemah untuk memungkinkan pembentukan HCOO − , terutama pada potensial yang lebih negatif, ini mengorbankan hilangnya selektivitas untuk pengikatan CO 2 ke pusat logam dan beralih ke CO. Tanpa MeOH yang ditambahkan, pengikatan CO 2 tetap ada, deteksi CO 3 2− menunjukkan bahwa air adventif atau MeCN tidak cukup untuk memprotonasi aduk logam yang terikat CO 2 . Sementara HCOO − juga dapat terbentuk dalam kondisi ini, FE untuk H 2 lebih meningkat, yang menunjukkan keuntungan kinetik pembentukan H 2 dibandingkan pembentukan HCOO − .
Ini menunjukkan bahwa sementara beberapa katalis HER dapat digunakan untuk mengubah CO 2 menjadi HCOO − , masalah mendasar yang mengganggu sistem ini bukanlah pengikatan preferensial H + atas CO 2 tetapi lebih pada langkah kedua, di mana kinetika preferensial hidrida yang sangat tereduksi bereaksi dengan proton lemah atas penyisipan CO 2 . Oleh karena itu, kemungkinan sumber katalis reduksi CO 2 yang cepat dan stabil yang selektif terhadap HCOO − tidak akan berasal dari katalis HER tetapi dari modifikasi atau perancangan katalis yang memberikan preferensi kinetik untuk penyisipan CO 2 , baik melalui interaksi bola luar (seperti dalam sistem biologis) atau melalui pengendalian konsentrasi CO 2 dan H + .
4 Kesimpulan
Kesimpulannya, reduksi CO 2 sebesar 1 dengan dan tanpa asam lemah dieksplorasi. Dengan kombinasi upaya CV, IR-SEC, dan DFT, ditentukan bahwa katalis aktif terbentuk setelah pembentukan dimer, 2 , dalam larutan. Reduksi dimer ini mengarah pada pembentukan spesies yang aktif secara katalitik. IR-SEC menunjukkan bahwa pada potensial yang diperlukan untuk timbulnya arus katalitik, reduksi dimer terjadi, membentuk 2* dan spesies mononuklear, [Fe(CO) 4 ] 2− ( 3 ). Dengan adanya senyawa-senyawa ini, sistem selektif untuk evolusi H 2 dan produksi CO dengan jejak HCOO − yang diproduksi. Namun, setelah pembentukan spesies Fe trinuklear 4 , terjadi peningkatan dalam pembentukan HCOO − .
Pembentukan tiga spesies berbeda dan kisaran produk yang diamati selama katalisis menunjukkan bahwa katalis HER, meskipun spesies hidrida tereduksinya stabil, tidak mereduksi CO 2 menjadi HCOO − melalui CO dalam kondisi yang diuji. Alih-alih gerakan lateral, seperti yang disarankan dalam Gambar 1B , katalis terdegradasi sebelum penambahan H + atau CO 2 ke pusat logam. Karena preferensi mereka untuk mengikat H+ dalam bentuk tereduksi dan hidrida, H 2 tetap menjadi produk utama dengan beberapa derajat reduksi CO 2 menjadi CO dan HCOO − .
Meskipun hasilnya menunjukkan bahwa spesies besi mononuklear dan trinuklear berperan penting dalam katalisis, penyelidikan lebih lanjut diperlukan untuk menemukan hubungan yang lebih baik antara spesies ini dengan reduksi HER dan CO 2. Studi elektrokatalitik tambahan, termasuk CV, CPE, dan IR-SEC, beserta perhitungan DFT akan memberikan wawasan yang lebih mendalam tentang peran spesifik yang dimainkan oleh spesies ini.
5 Bagian Eksperimen
Pertimbangan Umum
Kompleks 1 , 2 , dan 5 disiapkan melalui laporan literatur. Reaksi dilakukan menggunakan teknik Schlenk-line dan glove box standar di bawah atmosfer nitrogen. Kromatografi kolom flash dilakukan pada Teledyneisco CombiFlash Rf200 menggunakan kolom SiO2 atau kolom bermuatan alumina netral. Semua reagen dibeli dari sumber komersial dan digunakan tanpa pemurnian lebih lanjut kecuali dinyatakan lain. MeCN disimpan di bawah argon dan dikeringkan pada sistem pelarut kering khusus di atas kolom alumina dan lapisan di atas saringan molekuler sebelum digunakan. Tetrabutylammonium hexafluorophosphate ([Bu4N ] [PF6 ] , Aldrich, 98%) direkristalisasi dua kali dari metanol dan dikeringkan di bawah vakum pada 90 °C selama 16 jam sebelum digunakan.
Instrumentasi
Spektrum 1H NMR direkam pada spektrometer JOEL 400 MHz. Pergeseran kimia 1H NMR dilaporkan relatif terhadap TMS ( δ = 0) dan dirujuk ke puncak proton pelarut residual. Spektrum FTIR direkam pada Thermo Scientific Nicolet 6700. Spektrum yang diperoleh dirata-ratakan selama 32 pemindaian pada resolusi 4 cm −1 . Sampel gas dianalisis pada Kromatogram Gas Seri Hewlett-Packard 7890A dengan dua kolom molsieve (30 m × 0,53 mm id × film 25 μm).
Riwayat Hidup
Percobaan elektrokimia dilakukan dalam larutan 0,1 M [Bu 4 N][PF 6 ] dalam 5 mL asetonitril dengan katalis 1 mM menggunakan potensiostat BAS Epsilon. Semua pemindaian menggunakan ferosena sebagai standar internal (1 mM). Sebuah botol sintilasi dengan bagian atas yang dipasang khusus digunakan, memanfaatkan elektroda karbon kaca berdiameter 3 mm (dari BASi) sebagai elektroda kerja. Elektroda lawan adalah kawat Pt, dan elektroda pseudoreferensi adalah elektroda Ag/AgCl yang dipisahkan dari larutan oleh ujung Vycor dan tabung gelas yang diisi dengan larutan 0,1 M [Bu 4 N][PF 6 ] dalam MeCN. Kawat Pt diberi perlakuan api dengan obor butana sebelum digunakan. Elektroda karbon kaca dipoles dengan pasta berlian 15-, 3-, dan 1-mikron, dibilas dengan metanol, dan dikeringkan di bawah aliran nitrogen sebelum digunakan. Untuk semua percobaan, argon dan CO2 yang “benar-benar kering” pertama -tama dialirkan melalui kolom Drierite masing-masing dan kemudian melalui botol tertutup MeCN kering yang diisi dengan saringan 3 Å untuk meminimalkan jumlah kehilangan pelarut dan penumpukan air yang tidak disengaja. Kanula yang dikeringkan dalam oven digunakan untuk memindahkan gas kering yang jenuh MeCN ke pengaturan elektrokimia. Larutan elektrokimia disemprotkan setidaknya selama 10 menit sebelum dimulainya pengumpulan data dan disimpan di bawah selimut gas selama percobaan. Penurunan ohmik dikoreksi menggunakan alat kompensasi iR potensiostat, yang mengoreksi 90–100% dari resistansi yang diukur.
IR-SEC
IR-SEC dilakukan dengan menggunakan sel IR-SEC yang dibuat khusus yang terdiri dari elektroda kerja karbon kaca berdiameter 1 cm, elektroda lawan Pt, dan elektroda referensi semu Ag yang telah dipoles hingga mengilap seperti cermin. [ 23 ] Dalam atmosfer Ar atau CO 2 , sel diisi dengan larutan asetonitril yang terdiri dari 1 (5 mM) dan [Bu 4 N][PF 6 ] (0,1 M) dan, jika berlaku, 0,1 M MeOH. Potensi sel IR-SEC dikontrol menggunakan potensiostat BAS Epsilon. Elektrolisis yang dikontrol lapisan tipis dipantau melalui spektroskopi reflektansi dari elektroda kerja karbon kaca yang dipoles, dan spektrum inframerah dikumpulkan pada Thermo Scientific Nicolet 6700. Semua potensial mengacu pada elektroda referensi semu, Ag/Ag+ (≈+400 mV dari pasangan Fc/Fc+).
CPE
Percobaan CPE dilakukan dalam Gamry Dr. Bob’s Cell 60 mL yang dilengkapi dengan lima sambungan untuk menahan elektroda dan mampu disegel oleh septa untuk penyemprotan gas. Semua sambungan disegel dengan pita listrik, dan sambungan kaca juga disegel dengan gemuk silikon untuk mencegah kebocoran produk gas. Pengaturan tersebut mencakup elektroda kerja dan elektroda lawan batang karbon (elektroda lawan dipisahkan dari larutan oleh frit kaca berpori), dan elektroda referensi Ag/AgCl (BASi, dipisahkan dari larutan oleh selubung kaca yang diisi dengan 0,1 M [Bu 4 N][PF 6 ] dalam MeCN dan ditutup dengan ujung CoralPor). Kondisi percobaan mencakup 20 mL MeCN kering dengan 0,1 M [Bu 4 N][PF 6 ], kompleks 2 mM, dan jumlah MeOH yang sesuai. Larutan disemprot dengan Ar kering atau CO 2 (dikeringkan melalui metode yang dijelaskan di atas) selama 30 menit sebelum elektrolisis. Setelah penyemprotan, 1 mL gas dikeluarkan dari sistem, lalu 1 mL gas metana murni disuntikkan sebagai standar internal. Larutan diaduk terus-menerus selama percobaan. Ruang kepala diambil sampelnya setiap setengah jam melalui 2 mL alikuot yang disuntikkan ke dalam kromatografi gas Seri Hewlett–Packard 7890 A dengan dua kolom molsieve (film 30 m × 0,53 mm id × 25 μm). Suntikan 2 mL dibagi antara dua kolom, satu dengan N 2 dan satu dengan He sebagai gas pembawa, untuk mengukur H 2 dan CO secara bersamaan di setiap percobaan. Jumlah gas CO dan H 2 yang dihasilkan diukur dengan menggunakan kurva kalibrasi yang direkam secara eksperimen yang dibuat dari berbagai konsentrasi relatif gas dan metana.
Pembandingan Komputasional
Semua kalkulasi dijalankan dalam Gaussian 16. [ 24 ] Metode yang digunakan diuji dengan melakukan benchmarking fungsional dan basis set terhadap spektrum eksperimen 5 dalam asetonitril, dan menghasilkan metode berikut, yang tidak memerlukan faktor skala untuk kesesuaian yang baik dengan spektrum inframerah empiris. Optimasi akhir dan kalkulasi frekuensi dijalankan dengan fungsional TPSSH [ 25 ] dan basis set Def2-TZVP [ 26 ] yang menggunakan model kontinum terpolarisasi (PCM) dengan asetonitril sebagai pelarut. [ 27 ] Jika memungkinkan, geometri awal ditetapkan menggunakan data kristalografi yang tersedia dan digambar dalam Avogadro [ 28 ] dan dioptimalkan secara awal menggunakan medan gaya Universal force field (UFF). [ 29 ] Spektrum vibrasi yang dihasilkan divisualisasikan menggunakan Gabedit. [ 30 ] Dengan menggunakan metode ini, faktor skala yang diterapkan pada spektrum IR yang ditentukan DFT adalah 0,988. Struktur DFT 1* dan 2* tidak konvergen dan dengan demikian dikeluarkan dari analisis DFT.
Sintesis 1
Sintesis 1 mengikuti preseden literatur yang diterbitkan sebelumnya. [ 31 ] Secara singkat, dalam labu alas bulat, 0,600 mg (1,19 mmol, 1 eq) Fe 3 (CO) 12 ditambahkan ke 100 mL toluena. Larutan disemprot dengan nitrogen, dan 0,258 g 1,3-propanedithiol (2,38 mmol, 2 eq, 0,239 mL) ditambahkan melalui spuit. Larutan yang dihasilkan diletakkan di bawah N 2 dan dipanaskan hingga refluks selama 2 jam. Larutan kemudian diangkat dari api dan dibiarkan dingin selama 30 menit. Pelarut kemudian dihilangkan melalui penguapan putar, dan padatan yang dihasilkan dimurnikan melalui kromatografi kolom (9:1 Heksana/EtOAc) untuk menghasilkan padatan merah. Padatan kemudian direkristalisasi dengan penguapan heksana yang lambat untuk menghasilkan produk yang murni secara analitis. (Hasil 63%)
IR (FTIR) dalam MeCN ν maks (CO) [cm −1 ]: 2074, 2034, 1995.
1 H NMR (500 MHz, MeCN-d 3 ) δ ppm −1 1,75–1,80 (m, 2H), 2,18 (t, 4H, J = 5,9 Hz).
Sintesis 5
Sintesis 5 mengikuti preseden literatur yang diterbitkan sebelumnya. 15 Secara singkat, dalam labu Schlenk yang berisi batang pengaduk dan ≈10 mL tetrahidrofuran kering, 1 (50 mg, 0,130 mmol, 1 eq) dan 18-crown-6 (34,2 mg, 0,130 mmol, 1 eq) ditambahkan. Dalam labu Schlenk terpisah yang berisi ≈5 mL tetrahidrofuran, NaBH4 ( 9,80 mg, 0,260 mmol, 2 eq) ditambahkan. Dengan menggunakan teknik jalur Schlenk, kedua larutan didegaskan melalui metode beku-pompa-cair, diikuti dengan penambahan CO ke dalam labu. Dengan menggunakan kanula, larutan NaBH4 perlahan-lahan ditambahkan tetes demi tetes. Larutan dibiarkan teraduk selama 30 menit untuk menghasilkan larutan hijau tua. Pelarut dihilangkan di bawah vakum, dan labu dipindahkan ke kotak sarung tangan berisi N2 . Zat berminyak berwarna hijau dicuci dengan dietil eter dan toluena dan dikeringkan di bawah vakum untuk menghasilkan padatan berwarna hijau.
IR (FTIR) dalam THF ν maks (CO) [cm −1 ]: 2023, 1969, 1936, 1920, 1742.





Tinggalkan Balasan