Abstrak
Identifikasi biomarker adalah kunci untuk deteksi dini disfungsi fisiologis. Transistor efek medan (FET) skala nano yang dimodifikasi dengan reseptor target-spesifik memungkinkan penginderaan target langsung, menawarkan sensitivitas yang ditingkatkan karena pembatasan saluran skala nano. Dalam hal ini, tabung nano karbon berdinding tunggal (SWCNT) telah muncul sebagai kandidat kuat untuk pengembangan biosensor berbasis transistor. Memahami parameter struktural yang memengaruhi kinerja penginderaan dalam platform deteksi listrik skala nano tersebut sangat penting untuk penggunaannya yang andal dan terkendali. Di sini, diselidiki bagaimana strategi perakitan yang berbeda yang digunakan dalam konstruksi biosensor SWCNT-FET berbasis aptamer skala nano dapat secara dramatis memengaruhi pembangkitan sinyalnya, dengan konduktansi meningkat atau menurun untuk peristiwa pengenalan aptamer-kortisol yang sama. Aptamer DNA pengikat kortisol yang menunjukkan perilaku konformasi yang berkarakterisasi dengan baik digunakan, sebagai reseptor model untuk mengeksplorasi pengaruh strategi fungsionalisasi permukaan yang berbeda pada kinerja biosensor berbasis SWCNT. Melalui karakterisasi listrik dan optik gabungan, dijelaskan bagaimana konformasi aptamer mengatur perubahan elektrostatik lokal dalam panjang Debye, yang pada gilirannya memodulasi gerbang elektrostatik perangkat. Karya ini menawarkan wawasan tentang strategi desain yang efektif untuk konstruksi biosensor yang difungsikan dengan reseptor molekuler yang aktif secara elektrostatik.
1 Pendahuluan
Pengungkapan biomarker sangat penting untuk deteksi dini disfungsi fisiologis. [ 1 ] Berbagai jenis metodologi analitis tersedia untuk tujuan ini, dari kromatografi [ 2 ] dan uji imunosorben terkait enzim, [ 3 ] hingga spektroskopi [ 4 , 5 ] dan elektrokimia, [ 6 – 8 ] serta penggunaan perangkat optik dan listrik. [ 9 , 10 ] Dalam konteks ini, sensor skala nano yang dibangun dari transistor efek medan (FET) dapat memberikan sensitivitas tinggi, pengukuran waktu nyata, dan portabilitas, yang merupakan salah satu fitur yang paling dicari dalam teknologi penginderaan. [ 11 – 13 ] FET skala nano khususnya dapat memungkinkan penginderaan target langsung, dengan keuntungan sensitivitas yang ditingkatkan karena pembatasan saluran skala nano. [ 14 ] Dalam hal ini, karbon nanotube berdinding tunggal (SWCNTs) muncul sebagai kandidat kuat untuk pengembangan biosensor berbasis transistor, karena sifat mekanik dan elektroniknya yang sangat baik ditambah dengan kemudahan fungsionalisasi dan rasio luas permukaan per volume yang besar. [ 15 , 16 ]
Transduksi sinyal dalam sensor FET muncul dari gating elektrostatik saluran semikonduktor melalui interaksi dengan molekul target, melalui efek penyaringan pada skala panjang tertentu, yang disebut panjang Debye. [ 11 , 17 , 18 ] Namun, biosensor berbasis FET, termasuk yang berbasis SWCNT, dapat mengalami kekurangan selektivitas karena penyerapan biomolekul yang tidak spesifik. Oleh karena itu, sangat penting untuk mengintegrasikan elemen pengenalan target, seperti protein/antibodi dan aptamer asam nukleat, ke transduser (misalnya ke SWCNT). [ 19 – 21 ]
Berbagai strategi telah dikembangkan untuk mengeksploitasi antarmuka transduser-biomolekul menuju pembangkitan sinyal optimal dalam biosensor FET. [ 11 , 21 – 27 ] Aptamer, khususnya, telah ditemukan menjadi kelompok pengenalan yang efisien untuk desain rasional platform penginderaan FET yang sangat selektif, karena afinitas dan spesifisitasnya yang tinggi (sebanding dengan antibodi) bahkan untuk molekul kecil yang bermuatan diabaikan, dan kemudahan dalam desain dan rekayasanya dengan sedikit atau tanpa variasi antar-batch dalam produksinya (tidak seperti antibodi). [ 27 – 36 ]
Khususnya, sangat penting untuk mengendalikan geometri gugus biopengenalan seperti aptamer saat imobilisasi permukaannya, dan untuk memahami perubahan konformasi mereka saat peristiwa pengikatan target; hal ini memengaruhi aksesibilitas elemen pengenalan dan distribusi fitur elektrostatik yang termasuk dalam medan Debye, yang pada gilirannya mendorong gating konduktansi dalam biosensor FET. [ 11 , 17 , 19 , 32 , 37 ] Dengan cara ini, keluaran sinyal dapat dioptimalkan, meminimalkan variasi perubahan sinyal antara perangkat, dan mengurangi potensi pembatalan sinyal sehingga meningkatkan sensitivitas sensor. [ 38 – 40 ]
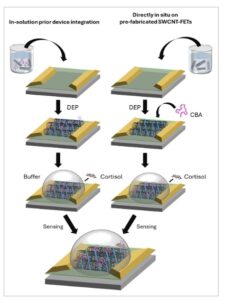
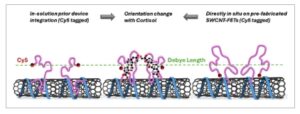
Upaya menuju fabrikasi skalabel biosensor CNT-FET telah memungkinkan penggunaannya dalam aplikasi point-of-care, namun kinerja perangkat tetap sangat sensitif terhadap protokol fungsionalisasi. [ 41 , 42 ] Kimia permukaan dan strategi imobilisasi probe telah terbukti memengaruhi karakteristik listrik dan keseragaman perangkat, yang menggarisbawahi perlunya kontrol yang tepat pada antarmuka sensor. Dalam karya ini, kami menyelidiki strategi perakitan berbeda yang digunakan dalam fabrikasi biosensor SWCNT-FET berbasis aptamer, dan efeknya pada pembangkitan sinyal perangkat saat penginderaan. Secara khusus, kami menemukan konduktansi FET meningkat atau menurun untuk peristiwa pengenalan aptamer-kortisol yang sama, tergantung pada rute fungsionalisasi yang dipilih untuk menambatkan aptamer ke SWCNT, yaitu integrasi perangkat sebelum larutan vs. langsung in situ pada SWCNT-FET pra-fabrikasi (lihat Gambar 1 ). Kami menggunakan kombinasi pengukuran listrik dan optik untuk mengkarakterisasi respons perangkat dan membahas perbedaan dalam perubahan konformasi aptamer dalam panjang Debye yang mendorong gerbang elektrostatik perangkat saat penginderaan. Studi kami memberikan wawasan tentang strategi desain untuk konstruksi biosensor aptamer-SWCNT yang optimal, dan secara umum biosensing-FET yang difungsikan dengan reseptor bermuatan elektrostatik.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Ilustrasi skema perakitan perangkat dan penginderaan menggunakan metode pemrosesan larutan dan substrat.
2 Hasil dan Pembahasan
2.1 Pembuatan FET SWCNT Berbasis Aptamer
Dalam penelitian kami, kami membungkus SWCNT dengan ss-DNA yang telah difungsikan sebelumnya secara komersial: pembungkusan ssDNA memberikan proses larutan SWCNT, sementara fungsionalitas pada ssDNA memperkenalkan tempat reaksi kimia untuk penggabungan aptamer penginderaan kortisol (CBA, yang dikenal sebagai urutan 15-1 dalam literatur) berikutnya [ 43 ] melalui kimia klik (lihat Gambar S1 (Informasi Pendukung) dan bagian Eksperimental), mirip dengan apa yang telah kami tunjukkan sebelumnya. [ 21 , 23 , 32 ]
Kami menggunakan dua strategi perakitan yang berbeda untuk pembuatan biosensor SWCNT-FET kortisol kami: i) aptamer diikatkan ke ssDNA-SWCNT dalam larutan dan hibrida kemudian disejajarkan pada elektroda berpola sebelumnya melalui Dielektroforesis (DEP), atau ii) ssDNA-SWCNT pertama-tama diimobilisasi pada chip melalui DEP, diikuti oleh fungsionalisasi in situ dengan CBA langsung pada perangkat yang dibuat. Gambar 1 menunjukkan ilustrasi skematis dari dua strategi perakitan perangkat (“dalam larutan” vs. “in situ”), sementara Gambar S2 (Informasi Pendukung) menampilkan gambar mikroskopi gaya atom representatif dari SWCNT yang diimobilisasi di antara elektroda berpola sebelumnya melalui DEP.
2.2 Pengukuran Penginderaan Konduktansi
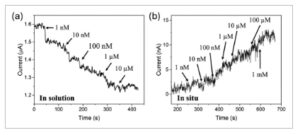
Setelah perangkat dirakit sesuai dengan strategi yang disebutkan di atas, perangkat tersebut direndam dalam larutan penyangga; konsentrasi kortisol yang berbeda kemudian ditambahkan pada interval waktu yang berbeda dan perubahan arus sumber-drain dipantau (lihat bagian 2.4 untuk detailnya). Biosensor yang dibuat melalui kedua strategi (Gambar 1 ) menunjukkan perilaku listrik yang kontras saat mendeteksi kortisol pada berbagai tingkat konsentrasi. Untuk perangkat yang dibuat “dalam larutan”, konduktansi menurun dengan meningkatnya konsentrasi kortisol ( Gambar 2a ), sedangkan untuk perangkat yang dibuat “in situ”, konduktansi meningkat secara proporsional dengan konsentrasi kortisol (Gambar 2b ).
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Respons kelistrikan sensor CBA-CNT setelah penambahan kortisol melalui a) larutan sebelum integrasi perangkat dan (b) langsung in situ pada SWCNT-FET yang telah dibuat sebelumnya.
Selain itu, kami menghitung sensitivitas perangkat berdasarkan perubahan konduktansi dan menyajikan hasilnya sebagai kurva kalibrasi untuk biosensor yang diproses “in situ” (Gambar S3 , Informasi Pendukung). Ini melengkapi data kalibrasi yang kami terbitkan sebelumnya untuk strategi “dalam larutan”, [ 32 ] yang menunjukkan profil sensitivitas yang sedikit berbeda dan menyoroti pengaruh rute perakitan pada kinerja sensor.
Perubahan konduktansi dalam biosensor SWCNT-FET dikaitkan dengan gating elektrostatik dalam panjang Debye, didorong oleh perubahan konformasi dan/atau orientasi reseptor saat pengikatan target. [ 17 , 27 , 34 ] Dalam kasus perangkat yang dibuat “dalam larutan”, tulang punggung fosfat CBA bermuatan negatif kemungkinan menjauh dari panjang Debye saat mengikat kortisol, mengurangi kerapatan lubang pada transduser SWCNT tipe-p, [ 44 ] yang menyebabkan penurunan konduktansi. Sebaliknya, dalam perangkat yang dibuat “in situ”, CBA dapat bergerak lebih dekat ke panjang Debye saat mengikat, menghasilkan peningkatan konduktansi.
Hasil ini menunjukkan bahwa CBA mengadopsi geometri yang berbeda pada SWCNT-FET tergantung pada strategi perakitan yang digunakan. Konfigurasi spasial yang berbeda dari CBA bermuatan negatif pada SWCNT baik sebelum maupun selama peristiwa penginderaan dapat memengaruhi distribusi muatan elektrostatik dalam panjang Debye, yang pada akhirnya menentukan perilaku sinyal listrik perangkat.
2.3 Pengaruh DNA Spacer terhadap Kinerja Penginderaan
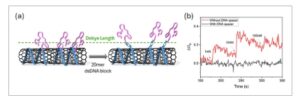
Bahasa Indonesia: Untuk mengonfirmasi respons dalam perangkat penginderaan listrik kami disebabkan oleh perubahan dalam lingkungan elektrostatik yang disebabkan oleh aptamer CBA yang jatuh dalam panjang Debye dari SWCNT, kami menyelidiki efek dari pengenalan spacer DNA antara aptamer dan SWCNT. Kami mengantisipasi bahwa kami dapat dengan cara ini memodulasi kinerja penginderaan perangkat kami, dengan mengendalikan jarak antara reseptor dan transduser. [ 45 ] Spacer DNA untai tunggal (ssDNA) 20-mer, komplementer ke bagian aptamer CBA yang lebih dekat ke nanotube, dirancang untuk mendorong CBA menjauh dari panjang Debye, seperti yang diilustrasikan dalam Gambar 3 . Kami menguji pendekatan ini pada sensor SWCNT-CBA yang dibuat menggunakan metode “in situ”. Sementara biosensor tanpa spacer menunjukkan sensitivitas yang baik melalui respons listrik terhadap penambahan kortisol (garis merah pada Gambar 3b ), setelah hibridisasi dengan spacer ssDNA 20-mer, perangkat tersebut kehilangan respons kortisolnya. Ini menunjukkan urutan aptamer CBA sekarang berada di luar panjang Debye efektif karena efek spacer DNA yang menguatkan. Selain itu, kami memodulasi panjang Debye dengan mengubah konsentrasi buffer dari Tris-HCl 50 mM yang digunakan dalam percobaan yang ditunjukkan sejauh ini. Kami memantau respons biosensing listrik perangkat SWCNT-CBA yang dibuat dengan metode in situ, pada konsentrasi Tris-HCl 1 mM dan 100 mM, yaitu masing-masing meningkatkan dan menurunkan panjang Debye secara signifikan (Gambar S4 , Informasi Pendukung). Seperti yang diharapkan dalam kedua kasus, kami tidak mengamati perubahan signifikan dalam respons perangkat saat ini setelah penambahan kortisol.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
a) Ilustrasi skema kontrol orientasi aptamer dengan menambahkan spacer DNA 20 mer; b) Respons listrik sensor CNT dengan (kurva hitam) atau tanpa (kurva merah) spacer DNA dari strategi perakitan “in situ”.
2.4 Karakterisasi AFM dan Fluoresensi
Bahasa Indonesia: Untuk menyelidiki lebih lanjut perbedaan yang diamati dalam respons listrik sensor CBA-CNT, nanohibrida CBA-SWCNT yang disiapkan menggunakan kedua strategi perakitan dihibridisasi dengan ssDNA komplementer, dan struktur DNA untai ganda yang dihasilkan kami gambar melalui AFM. Formasi untai ganda ini diamati sebagai titik-titik diskret di sepanjang SWCNT, seperti yang ditunjukkan oleh panah kuning pada Gambar 4a,b , dan Gambar S5a–d (Informasi Pendukung). Analisis kuantitatif mengungkapkan bahwa kepadatan CBA dalam strategi perakitan “dalam larutan” ditemukan sebesar 9 ± 3 aptamer per 300 nm SWCNT. Ini hampir dua kali lebih tinggi daripada yang dicapai melalui metode “in situ” (5 ± 1 aptamer per 300 nm SWCNT) (Gambar S5e , Informasi Pendukung). Perbedaan ini kemungkinan berasal dari keuntungan inheren dari fungsionalisasi larutan, di mana mobilitas molekuler/gerakan Brown dan distribusi reagen seragam dimaksimalkan: laju difusi yang lebih tinggi dan tidak adanya kendala sterik meningkatkan kinetika reaksi dan hasil. [ 46 ] Sebaliknya, reaksi berbasis substrat terhambat oleh halangan sterik dan difusi terbatas di dekat permukaan, yang mengurangi aksesibilitas gugus fungsi dan membatasi kepadatan fungsionalisasi. [ 47 , 48 ] Temuan-temuan ini secara kolektif menjelaskan kepadatan CBA yang berkurang yang diamati dalam strategi “in situ”, yang menekankan peran penting kondisi reaksi dalam mengoptimalkan fabrikasi biosensor.

Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Gambar AFM representatif dari nanohibrida CBA-CNT dengan DNA komplementer CBA dengan metode a) larutan dan b) substrat yang diproses.
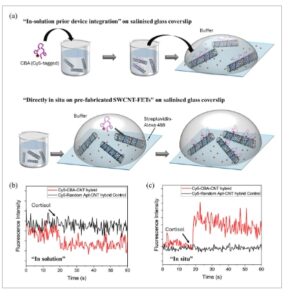
Bahasa Indonesia: Untuk menyelidiki perbedaan dalam konfigurasi aptamer CBA saat pengikatan kortisol untuk kedua strategi perakitan yang digunakan dalam studi ini, kami melakukan investigasi mikroskopi fluoresensi pada permukaan (lihat eksperimental). Kami menggunakan CBA yang ditandai dengan fluorofor Cy5 di ujung 3′, agar dapat berfungsi sebagai indikator jarak relatif antara aptamer dan SWCNT: dalam jarak dekat dengan nanotube, fluoresensinya dipadamkan melalui transfer energi resonansi Förster (FRET). [ 49 ] Kami menggunakan DNA fungsionalisasi biotin yang membungkus SWCNT sehingga memungkinkan imobilisasi nanotube pada penutup kaca biotin-silanized melalui interaksi biotin-streptavidin-biotin ( Gambar 5a ). Kehadiran nanohybrid SWCNT pada permukaan dikonfirmasi melalui AFM berkorelasi dan gambar mikroskopi confocal yang dilakukan pada penutup kaca (Gambar S6 , Informasi Pendukung).
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
a) Ilustrasi skema persiapan sampel mikroskop confocal; Perubahan intensitas fluoresensi nanohybrid Cy5-CBA-CNT setelah penambahan kortisol (kurva merah) dengan b) strategi “dalam larutan” dan c) “in situ”, dengan kelompok kontrol aptamer acak (kurva hitam).
Setelah penambahan kortisol, perubahan dalam intensitas fluoresensi Cy5 diamati untuk nanohybrid yang dirakit “dalam larutan” dan “in situ”, meskipun dalam arah yang berlawanan (kurva merah pada Gambar 5b,c ). Nanohybrid yang dibuat melalui metode “in situ” menunjukkan peningkatan yang signifikan dalam intensitas fluoresensi setelah pengikatan kortisol, dengan perubahan karakteristik hingga sekitar 45%. Sebaliknya, nanohybrid yang dirakit “dalam larutan” menunjukkan penurunan yang lebih kecil dalam intensitas fluoresensi, dengan perubahan maksimum sekitar 25%. Perbedaan yang kami amati dalam percobaan fluoresensi yang disebutkan di atas untuk dua strategi perakitan menunjukkan konformasi awal dan akhir yang berbeda dari CBA, sejalan dengan perbedaan dalam respons listrik yang sesuai yang diukur dalam perangkat. Selain itu, untuk menganalisis variabilitas dalam penginderaan berbasis fluoresensi, kami menyusun perubahan dalam intensitas fluoresensi CBA berlabel Cy5 di bawah dua strategi perakitan (Gambar S7 , Informasi Pendukung). Kelompok “dalam larutan” menunjukkan distribusi yang lebih sempit yang berpusat pada ≈0,15, yang mencerminkan perubahan sinyal yang lebih konsisten, kemungkinan karena kepadatan aptamer yang lebih tinggi dan kebebasan konformasi yang berkurang. Sebaliknya, kelompok “dalam situ” menunjukkan distribusi yang lebih luas dengan puncak ≈0,35, yang menunjukkan variabilitas sinyal yang lebih besar karena fleksibilitas struktural yang meningkat.
Sebagai percobaan kontrol, nanohybrid yang mengandung urutan DNA untai tunggal acak berlabel Cy5 (yaitu untai DNA yang tidak menunjukkan aktivitas pengikatan kortisol) [ 50 ] tidak menunjukkan perubahan intensitas fluoresensi setelah penambahan kortisol (kurva hitam pada Gambar 5b,c , kurva hitam). Hal ini menegaskan bahwa perubahan intensitas fluoresensi secara khusus dipicu oleh peristiwa pengikatan kortisol.
2.5 Model Hipotetis
Perbedaan fluoresensi dan perilaku sinyal listrik yang diamati untuk dua strategi perakitan berbeda yang digunakan dalam konstruksi chip penginderaan kortisol SWCNT-CBA kemungkinan besar disebabkan oleh perbedaan konformasi awal CBA yang terikat pada SWCNT yang dibungkus DNA. Penambahan kortisol menyebabkan perubahan struktural minimal pada CBA, yang menunjukkan perubahan konformasi yang dapat diabaikan atau tidak ada. [ 36 ] Pengamatan ini dikonfirmasi oleh spektroskopi dikroisme melingkar (Gambar S8 , Informasi Pendukung). Menariknya, meskipun tidak adanya perubahan struktural yang signifikan, CBA menghasilkan sinyal listrik yang kuat pada platform penginderaan berbasis Au ketika metilen biru ditandai pada ujung 3′ selama penginderaan kortisol. [ 36 ] Ini menyoroti peran penting interaksi reseptor-transduser dalam pembangkitan sinyal, yang tidak semata-mata bergantung pada perubahan konformasi reseptor. [ 36 ]
Dalam kasus kami, kami berspekulasi bahwa strategi dalam larutan memungkinkan penumpukan π-π yang signifikan [ 51 ] antara basa nukleotida aptamer CBA dan SWCNT, yang menginduksi konformasi awal CBA yang dekat dengan nanotube. Masuk akal untuk berasumsi bahwa ini tidak disukai ketika metodologi perakitan “in situ” digunakan karena SWCNT sudah berada di permukaan substrat, oleh karena itu dinding sampingnya kurang tersedia untuk berinteraksi dengan aptamer, dan DNA pembungkus cenderung kurang bergerak. [ 44 , 45 ] Ini dapat menjelaskan perilaku pengikatan kortisol yang berbeda yang diamati dengan dua strategi perakitan.
Dengan mempertimbangkan interaksi antara CBA dan SWCNT, kerapatan fungsionalisasi, dan cakupan DNA pembungkus pada SWCNT, kami membangun model hipotetis untuk secara visual mewakili perbedaan potensial dalam konformasi aptamer awal untuk dua strategi perakitan yang digunakan dalam studi ini (lihat Gambar 6 ). Untuk strategi perakitan “dalam larutan sebelum integrasi perangkat”, DNA pembungkus secara dinamis menempel pada permukaan SWCNT, yang memungkinkan segmen untai pembungkus untuk menyerap dan melepaskan karena halangan sterik dari untai yang berdekatan yang mengganggu penumpukan π-π. [ 52 ] Khususnya, guanin, yang menunjukkan interaksi π-π terkuat dengan SWCNT, [ 51 ] kemungkinan mendorong CBA kaya-G untuk bersaing secara efektif dengan DNA pembungkus untuk penyerapan pada nanotube, membawa CBA lebih dekat ke SWCNT.
Gambar 6
Buka di penampil gambar
Presentasi PowerPoint
Ilustrasi skema aptamer pengikat kortisol dengan orientasi berbeda pada SWCNT yang dibungkus DNA dari strategi perakitan “dalam larutan” / “in situ”.
Setelah berikatan dengan kortisol, bagian dari tulang punggung CBA bermuatan negatif terlepas dari SWCNT dan bergerak keluar dari lapisan Debye, yang mengakibatkan penurunan konduktansi SWCNT-FET. Bersamaan dengan itu, pergeseran struktural ini memaksa fluorofor Cy5 lebih dekat ke SWCNT, yang menyebabkan pemadaman fluoresensi dan penurunan intensitas fluoresensi. Karena kepadatan fungsionalisasi aptamer yang tinggi (Gambar S5e , Informasi Pendukung), pergerakan Cy5 dibatasi oleh halangan sterik dari aptamer yang berdekatan, yang mengakibatkan perubahan intensitas fluoresensi yang relatif sederhana (maksimum ≈25%).
Berbeda, strategi “in situ pada SWCNT-FET prafabrikasi” meminimalkan pergerakan DNA pembungkus dengan melakukan pra-imobilisasi SWCNT yang dibungkus DNA pada chip sebelum menambatkan aptamer. Ini tidak mendukung interaksi antara CBA dan SWCNT. Studi fluoresensi menyoroti bahwa fluorofor Cy5 yang bermuatan positif awalnya tertarik ke pembungkus DNA yang bermuatan negatif, yang mengakibatkan pemadaman oleh SWCNT. Setelah pengikatan kortisol, perubahan struktural dalam CBA membawa tulang punggung fosfat aptamer lebih dekat ke SWCNT, di dalam lapisan Debye, yang meningkatkan sinyal listrik. Secara bersamaan, peristiwa pengikatan mendorong Cy5 untuk menjauh dari SWCNT, yang mengarah ke peningkatan intensitas fluoresensi yang diamati hingga 45%. Strategi perakitan “in situ” menghasilkan kepadatan aptamer yang lebih rendah karena efisiensi reaksinya yang relatif lebih rendah dibandingkan dengan reaksi berbasis larutan. Namun, kepadatan aptamer yang berkurang ini memberikan kebebasan spasial yang cukup untuk perubahan konformasi ketika aptamer menangkap kortisol, yang berkontribusi terhadap perubahan sinyal yang diamati.
3 Kesimpulan
Singkatnya, studi ini menyajikan serangkaian investigasi ke dalam mekanisme kerja biosensor SWCNT-FET yang dibuat menggunakan dua strategi perakitan yang berbeda. Transduser nanotube difungsikan dengan aptamer pengikat kortisol baik i) “dalam larutan”, sebelum integrasi perangkat, atau ii) “in situ”, langsung pada SWCNT-FET yang telah dibuat sebelumnya. Sementara perangkat yang dibuat dari kedua pendekatan tersebut menunjukkan kemampuan deteksi kortisol, perilaku sinyal listriknya menunjukkan perbedaan yang signifikan. Mikroskopi Gaya Atom dan studi Fluoresensi yang dikaitkan dengan karakteristik struktural aptamer yang terikat CNT sebelum dan sesudah pengenalan kortisol, memungkinkan kami untuk membangun model hipotetis yang menggambarkan perubahan konformasi yang terjadi dalam panjang Debye. Berbagai faktor kunci yang memengaruhi perubahan ini diperhitungkan, dari kepadatan fungsionalisasi aptamer pada SWCNT hingga interaksi non-kovalen antara keduanya. Temuan kami menunjukkan bahwa di luar perubahan struktural pada aptamer setelah pengenalan target, antarmuka aptamer-SWCNT memainkan peran penting dalam pembangkitan sinyal dan modulasinya. Secara umum, studi kami menyoroti pentingnya pemilihan strategi perakitan dan fungsionalisasi yang digunakan untuk konstruksi biosensor FET berbasis aptamer skala nano, menuju kontrol yang lebih baik dan peningkatan kinerja penginderaan. Penerapan umum pendekatan kami dapat membantu dalam desain optimal biosensor listrik yang difungsikan dengan reseptor bermuatan elektrostatis.
4 Bagian Eksperimen
Bahan
(1R,8S,9s)-Bicyclo[6.1.0]non-4-yn-9-ylmethyl N-succinimidyl carbonate (BCN-NHS) dan SWCNT yang diperkaya (7,6) dibeli dari Sigma-Aldrich. Dulbecco’s phosphate-buffered saline (DPBS) diperoleh dari Thermo Scientific. Chip Si/SiO2 berpola elektroda Au dibeli dari ConScience AB. Semua bahan kimia lainnya dibeli dari Sigma Aldrich. DNA pembungkus untai tunggal dan aptamer pengikat kortisol (CBA, dikenal sebagai aptamer 15-1) [ 43 ] dibeli dari IDT. Urutannya adalah:
Pembungkus-DNA (Amina): 5′-Amina-TTT CCC CCT TT-3′
Pembungkus-DNA (Amina/Biotin): 5′-Amina-TTT CCC CCT TT-Biotin-3′
CBA (urutan 15-1): 5′-azide-GGA ATG GAT CCA CAT CCA TGG ATG GGC AAT GCG GGG TGG AGA ATG GTT GCC GCA CTT CGG CTT CAC TGC AGA CTT GAC GAA GCT T-3′
CBA bertanda fluoresensi: 5′-azide-GGA ATG GAT CCA CAT CCA TGG ATG GGC AAT GCG GGG TGG AGA ATG GTT GCC GCA CTT CGG CTT CAC TGC AGA CTT GAC GAA GCT T-Cy5-3′
Untai kontrol acak untuk CBA: 5′-ATG GGC AAT GCG GGG TGG AGA ATG GTT GCC GCA CTT CGG C-3′
Pembuatan SWCNT-FET
SWCNT yang dibungkus DNA diimobilisasi di antara pasangan elektroda Au pada chip SiO₂/Si dengan struktur transistor efek medan konvensional menggunakan dielektroforesis. Chip tersebut, yang dibeli dari ConScience AB, masing-masing berisi 16 pasangan elektroda dengan celah 300 nm di antara setiap pasangan. Pola nanoelektroda dicetak dengan litografi pada wafer Si/SiO₂ p-doped (SiO₂ 300 nm pada Si) menggunakan litografi laser dan berkas elektron. Lapisan Ti tipis (5 nm) dan lapisan Au tebal (45 nm) kemudian diendapkan ke pola melalui penguapan logam. Chip tersebut dibersihkan dengan sonikasi dalam aseton dan IPA masing-masing selama 5 menit, diikuti dengan pembersihan plasma selama 5 menit.
Untuk pendekatan ‘larutan sebelum integrasi perangkat’, tetesan 5 µL suspensi nanohibrid CBA-SWCNT yang diencerkan 10 kali ditempatkan pada chip. Bias tegangan Vp-p = 3 V dan f = 400 kHz diterapkan di seluruh elektroda sumber dan drain selama 2 menit. Chip kemudian dicuci dengan air Milli-Q dan dikeringkan di bawah N₂. Bundel CNT yang diimobilisasi dikonfirmasi menggunakan AFM.
Untuk ‘fungsionalisasi in situ pada FET SWCNT prafabrikasi,’ SWCNT yang difungsionalisasikan dengan BCN diimobilisasi dengan mengikuti prosedur yang sama. Selanjutnya, 50 µL larutan DPBS yang mengandung 1 µM CBA dituangkan ke dalam chip dan diinkubasi semalaman untuk mengikat Azide-CBA ke BCN-SWCNT yang diimobilisasi.
Fungsionalisasi SWCNT yang dibungkus DNA dengan Aptamer
Seperti yang diilustrasikan pada Gambar S1 (Informasi Pendukung), 0,5 mg SWCNT yang diperkaya (7,6) didispersikan dalam larutan NaCl 500 µL 0,M yang mengandung 1 mg Amina-DNA/Amina-DNA-Biotin melalui sonikasi probe selama 1 jam (daya keluaran 45%, rasio on/off 1:2). Campuran disentrifugasi selama 30 menit pada 15060 rpm sebanyak tiga kali. Supernatan dikumpulkan dan didialisis terhadap air melalui tabung Dialisis MINI Slide-A-Lyzer 20 kDa (Thermo Scientific) selama 2 jam untuk menghilangkan DNA pembungkus yang bebas.
1 mg (1R,8S,9s)-Bicyclo[6.1.0]non-4-yn-9-ylmethyl N-succinimidyl carbonate (BCN-NHS) dilarutkan dalam dimetil sulfoksida (DMSO) untuk menyiapkan larutan stok 0,25 mg/14 µL. 5 µL SWCNT yang diperkaya DNA (7,6) dan 7 µL larutan stok BCN-NHS (DMSO) 0,25 mg/14 µL ditambahkan ke larutan natrium tetraborat 37,5 µL, diikuti dengan penambahan air MilliQ hingga volume akhir 100 µL. Campuran yang diinkubasi semalam disentrifugasi pada 3000 rpm selama 30 menit untuk menghilangkan BCN-NHS yang tidak bereaksi. Supernatan didialisis terhadap air selama 2 jam dengan tabung Dialisis MINI Slide-A-Lyzer 20 kDa untuk menghilangkan BCN-NHS bebas lebih lanjut. 5 µL aptamer CBA 10 µM dan 5 µL DPBS 10× ditambahkan ke 40 µL air MilliQ lalu dicampur dengan 100 µL SWCNT DNA fungsionalisasi BCN yang telah disiapkan. Setelah inkubasi semalaman, suspensi didialisis lagi untuk menghilangkan aptamer bebas.
Pengukuran Konduktansi
Pengukuran listrik dilakukan pada stasiun probe (PS-100, Lakeshore) yang terhubung dengan penganalisa parameter semikonduktor Keithley 4200 SCS. Serangkaian larutan kortisol (Cor, Sigma Aldrich) dengan konsentrasi dari rendah ke tinggi disiapkan dengan mengencerkan larutan Cor 10 mM (dalam metanol) secara bertingkat dengan buffer penginderaan (50 mM Tris-HCl, 100 mM NaCl, 5 mM MgCl 2 , pH 7,4). Bias disapu dari −1 V ke 1 V, untuk memperoleh kurva I–V dari perangkat CNT-FET yang dibuat. Kami menguji tiga perangkat FET yang berbeda dalam pekerjaan ini untuk setiap pengukuran listrik ( n = 9 plus). Untuk eksperimen penginderaan kortisol secara real-time, 5 µL buffer penginderaan (50 mM Tris-HCl, 100 mL NaCl, dan 5 mM MgCl 2 , pH = 7,4) ditambahkan untuk menutupi perangkat; setelah 3 menit analit target ditambahkan. Arus sumber-drainase (I ds ) kemudian direkam setelah penambahan larutan kortisol dari konsentrasi rendah (nM) ke tinggi (mM), dengan interval 60 detik antara penambahan berturut-turut, sementara bias 100 mV diterapkan di seluruh sumber dan drain. Selanjutnya, setetes larutan urea 8 M dituangkan ke perangkat untuk membersihkan kortisol yang ditangkap, sehingga perangkat dapat digunakan kembali. Akhirnya, chip dibilas dengan air MilliQ dan dikeringkan dengan N 2 .
Pengukuran Fluoresensi
Pengukuran fluoresensi dilakukan pada penutup kaca yang diberi label Alexa-488-streptavidin menggunakan sistem mikroskop confocal Leica Stellaris 8. Panjang gelombang eksitasi 488 dan 647 nm digunakan. Perubahan intensitas fluoresensi setiap sampel direkam dengan waktu paparan 200 ms selama 20 dan 40 detik sebelum dan sesudah penambahan kortisol. Intensitas emisi Cy5 dari waktu ke waktu dianalisis dan diplot menggunakan ImageJ.
Nanohybrid SWCNT yang diberi label biotin diimobilisasi pada permukaan penutup kaca melalui streptavidin (SA). Penutup kaca, yang dibersihkan dengan larutan piranha, diinkubasi semalam dalam 40 mL metanol anhidrat yang mengandung 3 mg biotin-PEG-silane, 9 mg mPEG-silane, dan 30 µL asam asetat. Setelah modifikasi, penutup kaca dicuci dengan air dan etanol. Larutan 80 µL streptavidin (0,25 mg mL −1 , terdiri dari 1% Alexa-488-streptavidin dan 99% streptavidin dalam PBS, pH 7) dituangkan ke penutup kaca yang dimodifikasi biotin dan PEG dan diinkubasi pada pengocok selama 5 menit. SA yang berlebih dihilangkan dengan mencuci penutup kaca tiga kali dengan buffer B (10 mM MgCl₂, 5 mM Tris-HCl, pH 8, 1 mM EDTA, 0,05% Tween-20) diikuti dengan perendaman dalam PBS selama 5 menit untuk menghilangkan SA bebas.
Untuk pendekatan `dalam larutan`, 7 µL BCN-NHS (0,25 mg/14 µL dalam DMSO) dan 5 µL SWCNT yang diperkaya (7,6) yang dibungkus DNA berlabel biotin ditambahkan ke 37,5 µL buffer natrium tetraborat 0,1 M, diikuti dengan penambahan air Milli-Q untuk mencapai volume akhir 100 µL. Setelah inkubasi semalaman, campuran dimurnikan melalui dialisis selama 2 jam menggunakan Slide-A-Lyzer™ MINI Dialysis Devices (batasan 20 kDa, Thermo Scientific) untuk memperoleh SWCNT yang diperkaya (7,6) yang dibungkus DNA BCN. Selanjutnya, 5 µL Azide-CBA berlabel Cy5 10 µM dan 45 µL PBS ditambahkan ke larutan SWCNT 100 µL yang telah disiapkan yang dibungkus BCN-DNA dan diperkaya (7,6) dan diinkubasi semalaman. Nanohibrida CBA-SWCNT yang dihasilkan diencerkan dalam buffer C (PBS dengan 10 mM MgCl₂, 0,01% Tween-20), diteteskan ke penutup kaca SA yang telah disiapkan, dan diinkubasi selama 1–2 jam. Penutup kaca kemudian dicuci tiga kali dengan buffer penginderaan (50 mM Tris-HCl, 100 mM NaCl, 5 mM MgCl₂, pH 7,4) untuk menghilangkan nanohibrida CBA-SWCNT/BCN-SWCNT yang bebas. Pengukuran dilakukan dalam kondisi buffer.
Untuk pendekatan `in situ`, CNT yang difungsikan BCN ditempelkan pada penutup kaca SA yang telah disiapkan menggunakan prosedur yang sama. Kemudian, 50 µL aptamer CBA berlabel Cy5 1 µM dalam DPBS dituangkan ke penutup kaca dan diinkubasi semalaman. Terakhir, penutup kaca dicuci tiga kali dengan buffer penginderaan sebelum pengukuran fluoresensi dilakukan dalam kondisi buffer menggunakan mikroskop fluoresensi confocal.
Spektroskopi Dikroisme Sirkular (CD)
Spektrum CD dari nanohibrida CBA dan CBA-SWCNT, sebelum dan sesudah pengikatan kortisol, direkam menggunakan spektropolarimeter (Chirascan, Applied Photophysics). Untuk menyiapkan 500 µL sampel CD, 5 µL larutan CBA/CBA-SWCNT 100 µM dan 50 µL buffer penginderaan (50 mM Tris-HCl, 100 mM NaCl, 5 mM MgCl₂, pH 7,4) ditambahkan ke 445 µL air. Untuk sampel CD dengan pengikatan kortisol, 5 µL larutan CBA/CBA-SWCNT 100 µM, 5 µL larutan kortisol 1000 µM, dan 50 µL buffer penginderaan ditambahkan ke 440 µL air, sehingga volume totalnya menjadi 500 µL. Sampel yang telah disiapkan dipindahkan ke kuvet kuarsa dengan panjang lintasan cahaya 0,1 cm dan ditempatkan dalam wadah termostabil. Spektrum CD direkam dari 200 hingga 320 nm pada suhu ruangan, dengan tiga pemindaian dilakukan untuk setiap sampel.
Analisis Statistik
Data dari mikroskop floresensi confocal dan mikroskop gaya atom dianalisis menggunakan analisis ImageJ dan Nanoscope. Intensitas floresensi dan tinggi sampel yang diekstraksi diproses lebih lanjut di OriginLab untuk menghasilkan distribusi Gaussian yang sesuai. Untuk membandingkan antar perangkat, respons perangkat dinormalisasi dengan persamaan:
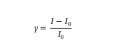
di mana I0 adalah arus dasar dan I adalah arus kondisi tunak. Arus dasar (I₀) diperoleh dengan merata-ratakan arus yang diukur sebelum analit dimasukkan. Untuk setiap konsentrasi analit, arus kondisi tunak (I) ditentukan dengan merata-ratakan arus dalam wilayah plateau. Kurva kalibrasi untuk deteksi kortisol dibuat dari pengukuran konduktansi waktu nyata. Selama setiap percobaan, penambahan kortisol secara bertahap menghasilkan penurunan arus secara bertahap, dengan setiap langkah stabil pada plateau yang berbeda. Arus dasar (I₀) diperoleh dengan merata-ratakan sinyal sebelum analit dimasukkan. Untuk setiap konsentrasi, arus kondisi tunak (I) dihitung dengan merata-ratakan nilai dalam wilayah plateau setelah penambahan analit. Titik data ini kemudian digunakan untuk menghitung sensitivitas sensor (S) pada setiap konsentrasi, seperti yang diuraikan dalam Persamaan ( 1 ).
![]()
Data diplot dan disesuaikan dengan menggunakan Persamaan ( 2 )
![]()





Tinggalkan Balasan