Pendanaan : Penelitian ini didukung oleh Uni Eropa di bawah proyek ATEBIO (Teknik Lanjutan untuk Diagnostik Biomedis, ID Proyek CZ.02.01.01/00/23_020/0008535). Pekerjaan ini juga didukung oleh Badan Hibah Republik Ceko [22-00236S], Kementerian Pendidikan, Pemuda, dan Olahraga Republik Ceko [9F23002], dan Rencana Penelitian Institusional [RVO:68081715].
ABSTRAK
Kemampuan sensitivitas tinggi dari deteksi fluoresensi terinduksi laser (LIF) terus-menerus mendorong pengembangan berbagai label dengan sifat fluoresensi yang berbeda. Namun, strategi ini juga memerlukan adaptasi sistem deteksi yang ada agar sesuai dengan karakteristik eksitasi dan emisi dari tag fluoresensi baru. Dalam studi ini, kami mengadaptasi detektor LIF dari instrumen elektroforesis kapiler komersial ke spektrum fluoresensi spesifik oligosakarida susu manusia berlabel 2-aminoakridon. Laser solid-state eksternal dengan panjang gelombang 405 nm dihubungkan ke instrumen elektroforesis kapiler komersial melalui adaptor laser-ke-pemandu cahaya cetak 3D sederhana, dan pengaturan filter optik yang berbeda dibandingkan berdasarkan rasio sinyal terhadap derau. Pengaturan yang dioptimalkan memberikan batas deteksi serendah 0,27 hingga 0,34 nM, yang sesuai dengan injeksi 3,4 hingga 4,6 attomoles oligosakarida berlabel 2-aminoakridon. Temuan ini menunjukkan bahwa konfigurasi laser dan filter yang dioptimalkan dapat meningkatkan sensitivitas pemisahan elektroforesis hingga beberapa kali lipat. Selain itu, pengaturan yang disajikan dapat digunakan sebagai panduan untuk menggabungkan berbagai laser ke instrumen komersial.
Singkatan
2′Lantai atas
2′-fukosillaktosa
2-AMAC
2-aminoakridon
3-Lantai
3-fukosillaktosa
3′SL
3′sialilaktosa
6′SL
6′sialilaktosa
APTS
aminopirenetrisulfonat
BGE
elektrolit latar belakang
CE
elektroforesis kapiler
Bahasa Indonesia: DSLNT
disialillakto- N -tetraosa
organisasi nirlaba
oligosakarida susu manusia
PENGENAL
diameter dalam
HIDUP
fluoresensi yang diinduksi laser
LNDFH Saya
lakto- N -difukoheksaosa I
LNDFH II
lakto- N -difukoheksaosa II
LNFP saya
lakto- N -fukopentaosa I
LNN
lakto- N -neotetraosa
LNT
lakto- N -tetraosa
DARI
kepadatan optik
1 Pendahuluan
Detektor fluoresensi dapat memberikan sensitivitas tinggi, lebih unggul daripada spektrometer massa atau detektor spektrofotometri penyerap cahaya [ 1 ]. Sensitivitas fluoresensi bergantung pada sifat fluorofor dan instrumentasi yang digunakan. Dari sudut pandang instrumental, sumber eksitasi, sebagai salah satu bagian penting dari setiap detektor fluoresensi, harus memberikan keluaran intensitas tinggi dan stabil dari panjang gelombang cahaya tertentu. Dalam kasus elektroforesis kapiler (CE), laser, yang memancarkan cahaya yang sangat intensif, monokromatik, dan koheren, telah menjadi sumber cahaya yang dominan, dan CE dengan deteksi fluoresensi yang diinduksi laser (CE/LIF) merupakan alat standar dalam berbagai bidang analitis, termasuk glikomik.
Derivatisasi dengan label fluoresensi merupakan langkah kunci dalam alur kerja analisis glikana dan oligosakarida dengan CE/LIF [ 2 ]. Aminopyrenetrisulfonate (APTS) merupakan tag fluoresensi yang paling umum digunakan untuk pelabelan glikana diikuti oleh CE/LIF [ 3 ]. Eksitasi maksimum sakarida berlabel APTS berada pada 455 nm, dan laser 488 nm biasanya digunakan untuk eksitasinya. Analit berlabel APTS menunjukkan fluoresensi yang kuat dengan emisi maksimum pada 512 nm, dan filter bandpass 520 nm biasanya digunakan dalam detektor. Pengaturan analitis ini dapat mencapai batas deteksi pikomolar. Beberapa label fluoresensi lain telah diperkenalkan untuk analisis oligosakarida dan glikana [ 2 ]. Namun, mereka biasanya mengalami sensitivitas deteksi yang lebih rendah dibandingkan dengan APTS. Misalnya, 2-aminoakridon (2-AMAC) telah digunakan untuk analisis glikosaminoglikan [ 4 ] dan oligosakarida [ 5 – 10 ] dengan CE/LIF dengan batas deteksi nanomolar.
2 Motivasi Protokol
Sistem CE/LIF yang tersedia secara komersial biasanya dilengkapi dengan laser 488 nm dan dengan demikian deteksi LIF dari analit berlabel 2-AMAC yang sejauh ini disajikan oleh kelompok penelitian lain juga diperoleh dengan menggunakan pengaturan ini [ 4 – 10 ]. Namun, spektrum eksitasi (Gambar 1 ) menunjukkan bahwa peningkatan sensitivitas yang signifikan dalam deteksi LIF dari senyawa berlabel 2-AMAC dapat dicapai dengan mengganti laser 488 nm yang umum digunakan dengan laser dengan garis emisi yang lebih dekat ke eksitasi maksimum dari label 2-AMAC (misalnya, efisiensi eksitasi 43 kali lebih tinggi menggunakan laser 405 nm). Oleh karena itu, protokol ini berfokus pada adaptasi pengaturan deteksi LIF dari sistem P/ACE MDQ Plus (Sciex, Brea, CA, AS) dengan menggabungkan laser solid-state 405 nm eksternal untuk mencapai deteksi sensitivitas tinggi dari analisis CE/LIF dari oligosakarida berlabel 2-AMAC dalam kolostrum manusia dan ASI.
Perlu diingat bahwa:
• Data menunjukkan bahwa eksitasi maksimum 2-AMAC dalam elektrolit latar belakang (BGE), buffer borat 100 mM, pH 10,5, berada pada 412 nm. Hal ini berbeda dari nilai yang dilaporkan (420–430 nm) yang digunakan untuk deteksi fluoresensi dalam analisis HPLC [ 11 ], yang mungkin disebabkan oleh perbedaan komposisi fase bergerak, yaitu 250 mM amonium format (pH 4,4) atau 100 mM amonium asetat (pH 6,6) dalam gradien asetonitril.
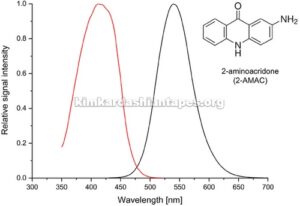
GAMBAR 1
3 Bahan Kimia dan Material
Lakto- N -difukoheksaosa I (LNDFH I), lakto- N -difukoheksaosa II (LNDFH II), lakto- N -neotetraosa (LNnT), (lakto- N -fukopentaosa I (LNFP I), 3′sialilaktosa (3′SL), disialillakto- N- tetraosa (DSLNT), 3-fukosilaktosa (3-FL), lakto- N- tetraosa (LNT), 2′-fukosilaktosa (2′FL), dan 6′sialilaktosa (6′SL) dibeli dari DextraUK dan Biosynth Carbosynth (90%–99%). Laktosa, 2-AMAC, natrium sianoborohidrida, asam asetat, dimetil sulfoksida, metanol, natrium hidroksida, asam klorida, dan natrium tetraborat dekahidrat dibeli dengan kemurnian tertinggi dari Merck (Praha, Republik Ceko).
Kapiler silika yang dilebur (diameter dalam (ID) 50 µm, diameter luar 365 µm) dibeli dari Molex (Lisle, IL, AS). Filter Amicon (3 kDa MWCO) dibeli dari Merck. Filter optik yang ditentukan oleh nomor komponen (PN) di Bagian 4 dipasok oleh Edmund Optics Ltd (York, Inggris). Laser solid-state 405 nm (RLDE405M-50-5) dibeli dari Roithner (Wina, Austria) dan laser eksternal 488 nm (56-CRN-488-050) dibeli dari Melles Griot (Carlsbad, CA, AS). Lensa bola silika yang dilebur, adaptor serat sekat SMA, dan kabel patch serat MM tahan solarisasi SMA–SMA dibeli dari Thorlabs (Newton, NJ, AS).
4 Solusi Teknis
Laser solid-state 405 nm RLDE405M-50-5 (Roithner, Vienna, Austria) dihubungkan ke input SMA 905 modul LIF sistem P/ACE MDQ Plus melalui adaptor cetak 3D dan serat optik seperti yang ditunjukkan pada Gambar 2 .
Adaptor laser melingkar sederhana yang dibangun sebelumnya [ 12 ] disesuaikan dengan tepi luar spesifik laser 50 mW 405 nm.
Adaptor laser-ke-lightguide dimodelkan secara 3D menggunakan perangkat lunak sumber terbuka FreeCAD versi 0.21.2. Berkas model 3D untuk pencetakan (adaptor laser 405 nm.3mf) disertakan dalam Informasi Pendukung .
Adaptor dirancang untuk dicetak sebagai dua bagian yang identik tanpa memerlukan dukungan selama proses pencetakan. Adaptor dicetak dari filamen polietilena tereftalat glikol hitam 1,75 mm (EkoMB, Praha, Republik Ceko) menggunakan printer 3D MK3S+ (Prusa Research, Praha, Republik Ceko).
Perakitan dilakukan dengan menempatkan tepi luar laser pada ceruk yang tepat di satu bagian adaptor, lensa bola silika lebur (diameter 5 mm) dipasang di bagian tengah adaptor, dan terakhir, adaptor serat sekat SMA dipasang pada sisi berlawanan dari adaptor.
Setengah bagian adaptor kedua ditambahkan di bagian atas dan sekrup M3 (panjang 33 mm) beserta mur digunakan untuk menghubungkan bagian adaptor. Kabel patch serat MM tahan solarisasi SMA–SMA (panjang 1 m, Ø200 µm, bukaan numerik 0,22, PN M112L01) digunakan untuk menghubungkan adaptor ke modul CE/LIF.
Filter takik 405 nm (OD 6, PN 86119) dan filter longpass 425 nm (OD 4, PN 84736) atau filter longpass 500 nm (OD 4, PN 62976) dipasang pada dudukan filter modul LIF sistem P/ACE MDQ Plus.
Perlu diingat bahwa:
• Modul LIF dari sistem P/ACE MDQ Plus CE mencakup laser 488 nm. Saat digunakan untuk pengukuran perbandingan, filter notch 488 nm (Sciex) dan filter bandpass 520 nm (Sciex) atau filter longpass 500 nm (kepadatan optik (OD) 4, PN 62976) dipasang di dudukan filter.
• Sistem P/ACE MDQ Plus CE dilengkapi dengan dua saluran untuk deteksi fluoresensi, namun saluran kedua tidak digunakan dalam percobaan untuk menghindari bias terkait dengan perbedaan antara jalur optik saluran.

GAMBAR 2
5 Pelabelan Oligosakarida dan Kondisi CE
Campuran uji lima HMO terdiri dari lacto- N -difucohexaose II (LNDFH II), 3-fucosyllactose (3-FL), lacto- N -tetraose (LNT), 2′-fucosyllactose (2′FL), dan 6′sialyllactose (6′SL). Struktur masing-masing HMO tercantum dalam Tabel S1 [ 13 ].
Pelabelan 2-AMAC pada HMO dilakukan melalui prosedur yang telah dipublikasikan sebelumnya [ 10 ]. Secara singkat, standar HMO (masing-masing 1–2 nanomoles) diberi label dalam campuran reaksi yang terdiri dari 25 µL 2-AMAC 25 mM (dilarutkan dalam campuran asam asetat:dimetil sulfoksida (3:17, v/v)) dan 25 µL natrium sianoborohidrida 1 M (dilarutkan dalam air). Sampel diinkubasi pada suhu 45°C selama 2 jam. Kemudian, sampel yang diberi label diencerkan 10 atau 100 kali dengan campuran dimetil sulfoksida–air (1:1, v/v) sebelum analisis CE/LIF.
Sampel-sampel tersebut diolah menggunakan prosedur yang dipublikasikan sebelumnya dengan beberapa modifikasi [ 14 ]. Singkatnya, ASI atau kolostrum (100 µL) dicampur dengan air ultra-murni (100 µL). Setelah diaduk, sampel disentrifugasi pada 6000 rpm, 4°C selama 10 menit. Dengan menghindari lapisan lemak bagian atas, 100 µL cairan dipipet dari lapisan air ke dalam tabung reaksi yang bersih. Kemudian, asetonitril (200 µL) ditambahkan, sampel diaduk, diultrasonikasi selama 5 menit, dan disentrifugasi pada 10.000 rpm, 4°C selama 10 menit. Supernatan (250 µL) diambil, dikeringkan, dan dilarutkan kembali dalam air ultra-murni (450 µL). Akhirnya, sampel yang mengandung HMO dilewatkan melalui filter Amicon MWCO 3 kDa, dan fraksi yang mengalir dikeringkan. HMO yang terkumpul diderivatisasi dengan 2-AMAC menggunakan prosedur yang sama seperti standar HMO.
Pemisahan CE dilakukan dalam kapiler silika lebur (ID 50 µm, panjang efektif 50 cm, panjang total 60 cm), BGE terdiri dari buffer natrium borat 100 mM, pH 10,5, dan HMO berlabel 2-AMAC dipisahkan sebagai kompleks poliol-borat anionik [ 15 ]. Sampel disuntikkan ke dalam kapiler pemisah dengan menerapkan tekanan 0,5 psi selama 15 detik (∼ 13 nL), dan pemisahan CE dilakukan pada suhu 25°C dengan menerapkan tegangan pemisah 15 kV. Perangkat lunak 32 Karat digunakan untuk akuisisi dan pemrosesan data CE.
Perlu dicatat bahwa, sebelum setiap hari pengukuran, kapiler dibilas dengan natrium hidroksida 1 M selama 10 menit dan dengan air selama 5 menit (dengan tekanan 20 psi) untuk memastikan pembersihan permukaan bagian dalam dan terciptanya kondisi aliran elektroosmotik yang konsisten. Karena alasan ini, kapiler dibilas pada tekanan 20 psi sebagai berikut: metanol selama 1 menit, asam klorida 1 M selama 2 menit, air selama 1 menit, natrium hidroksida 1 M selama 5 menit, dan elektrolit latar belakang (BGE) selama 5 menit di antara pengukuran sampel individual.
6 Evaluasi Kinerja Setup yang Disesuaikan
Kinerja beberapa pengaturan deteksi LIF dibandingkan berdasarkan elektroferogram standar HMO berlabel 2-AMAC dan rasio sinyal terhadap derau (S/N) yang sesuai dirangkum dalam Tabel 1. Rasio S/N tertinggi diperoleh dengan menggunakan pengaturan LIF yang menggunakan laser 405 nm dan filter emisi longpass 500 nm. Penurunan rasio S/N sebesar 43%–45% diamati dengan menggunakan pengaturan laser 405 nm/filter longpass 425 nm. Hasil serupa diperoleh dengan pengaturan LIF yang terdiri dari laser internal 488 nm dan filter longpass 500 nm. Terlepas dari anggapan kami, filter longpass 425 nm memberikan S/N yang lebih rendah daripada filter longpass 500 nm, yang disebabkan oleh pemblokiran laser yang lebih buruk sehingga menghasilkan latar belakang dan derau yang lebih tinggi. Rasio S/N terendah diperoleh dengan pengaturan deteksi yang terdiri dari laser internal 488 nm dan filter bandpass 520 nm. Pengaturan LIF komersial ini, yang umum digunakan dalam karya yang dipublikasikan, hanya menyediakan 7% S/N dari pengaturan khusus yang dilengkapi dengan kombinasi laser eksternal 405 nm/filter longpass 500 nm.
TABEL 1. Perbandingan kinerja pengaturan LIF untuk mendeteksi HMO berlabel 2-AMAC yang dinyatakan dalam rasio S/N (nilai absolut dan nilai relatif dalam %). Rasio S/N dihitung sebagai rasio tinggi puncak tertentu terhadap derau sinyal dasar di depan puncak. Kondisi eksperimen sama seperti pada Gambar 3 .
| Rasio S/N (nilai % relatif) | ||||
|---|---|---|---|---|
| Pengaturan asli—laser internal | Pengaturan khusus—laser eksternal | |||
| organisasi nirlaba | Laser 488nm/filter lolos pita 520nm | Laser 488nm/filter lintasan panjang 500nm | Laser 405nm/filter lintasan panjang 425nm | Laser 405nm/filter lintasan panjang 500nm |
| LNDFH II | 8,34 (7%) | 67,31 (56%) | 68,45 (57%) | 119,62 (100%) |
| 3-Lantai | 33,71 (7%) | 259,40 (52%) | 272,20 (55%) | 495,60 (100%) |
| LNT | 14,21 (7%) | 123,63 (59%) | 119,76 (57%) | 208,47 (100%) |
| 2′Lantai atas | 17,87 (6%) | 150,07 (49%) | 177,04 (57%) | 308,66 (100%) |
| 6′SL | 12,65 (6%) | 117,61 (60%) | 111,79 (57%) | 195,75 (100%) |
GAMBAR 3 menunjukkan lima pengulangan analisis CE/LIF dari HMO berlabel 2-AMAC di bawah kondisi deteksi berkinerja terbaik. Pengaturan LIF ini memberikan batas deteksi 0,27–0,35 nM (S/N = 3) dan batas kuantifikasi 0,89–1,18 nM (S/N = 10). Dalam nilai absolut, batas deteksi ditetapkan sebesar 3,4–4,6 attomoles yang disuntikkan ke dalam sistem CE/LIF. Ini sesuai dengan peningkatan hampir dua orde besaran dalam sensitivitas deteksi dibandingkan dengan data yang diterbitkan sebelumnya yang diperoleh dengan menggunakan pengaturan LIF laser 488 nm dan filter bandpass 520 nm [ 4 , 7 , 10 ]. Perlu disebutkan bahwa semua pengaturan LIF yang diuji memberikan hasil yang dapat diulang dengan RSD ( n = 5) dari tinggi puncak dan luas puncak di bawah 3,5% untuk semua HMO berlabel 2-AMAC.
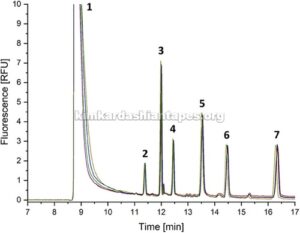
GAMBAR 3
7 Aplikasi Pengaturan CE/LIF yang Disesuaikan untuk Analisis Sampel Kolostrum Manusia dan ASI
Pengaturan deteksi LIF yang dioptimalkan (kombinasi laser 405 nm/filter longpass 500 nm) diterapkan pada analisis CE/LIF HMO dalam kolostrum manusia dan ASI manusia. Sampel dikumpulkan dari pasien di Rumah Sakit Universitas di Krakow, dan setelah pengumpulan, bahan biologis segera dibekukan pada suhu -21°C. Desain penelitian disetujui oleh Komite Bioetika dari Jagiellonian University Medical College (No: 1072.6120.133.2018). Elektroferogram yang diperoleh ditunjukkan pada Gambar 4B (kolostrum manusia) dan Gambar 4C (ASI manusia). Beberapa HMO yang ada dalam kolostrum dan ASI diidentifikasi berdasarkan waktu migrasi standar HMO berlabel 2-AMAC yang dianalisis dalam kondisi eksperimen yang sama (Gambar 4A ).

GAMBAR 4
8 Pembahasan Parameter yang Mempengaruhi Efektivitas Pengaturan Deteksi LIF yang Disesuaikan
Peningkatan yang diamati dalam S/N, ketika laser internal standar 488 nm digantikan oleh laser eksternal 405 nm (Tabel 1 ) jauh lebih kecil dari yang diharapkan (2 kali lipat vs. 43 kali lipat yang diharapkan). Berdasarkan hasil yang menunjukkan bahwa S/N dengan filter longpass 500 nm lebih tinggi daripada dengan filter longpass 425 nm, tampaknya kualitas (kepadatan optik) filter optik merupakan salah satu faktor penting. Faktor kedua adalah jumlah daya cahaya laser yang benar-benar memasuki titik deteksi kapiler.
Daya keseluruhan 50 mW lebih unggul daripada laser eksternal 405 nm (vs. daya keluaran 3 mW dari laser internal 488 nm), tetapi harus ditekankan bahwa laser yang diuji berbeda secara substansial dalam penggandengannya ke pemandu cahaya internal yang mengarah langsung ke sel deteksi. Laser eksternal memiliki lebih banyak sambungan, yang menyebabkan penyebaran dan pelemahan cahaya yang dipandu. Oleh karena itu, laser eksternal 50 mW 488 nm juga digandengkan ke sistem P/ACE MDQ Plus CE melalui adaptor cetak 3D dan pemandu cahaya seperti dijelaskan di atas untuk membandingkan daya pancar laser yang digunakan dalam studi ini. Daya cahaya yang dipancarkan dari pemandu cahaya menggunakan kedua laser ditentukan oleh Sensor Termal Kaca Mikroskop S175C (Thorlabs) yang terhubung ke Antarmuka Pengukur Daya dan Energi dengan Pengoperasian USB PM100USB (Thorlabs). Output pemandu cahaya dari laser 405 nm ditentukan sebesar 8,4 mW dan laser eksternal 488 nm mengeluarkan 1,4 mW dari pemandu cahaya. Perbedaan enam kali lipat dalam daya output disebabkan oleh kopling non-ideal yang disebabkan oleh desain laser 488 nm yang berbeda. Perbandingan sinyal yang diperoleh dari HMO berlabel 2-AMAC dalam kaitannya dengan daya yang ditransmisikan oleh pemandu cahaya ditunjukkan pada Gambar S1 . Sinyal fluoresensi yang direkam kemudian berbeda dengan rasio 500. Jadi, ketika memperhitungkan perbedaan daya output (enam kali), penurunan dua orde besaran dalam sinyal saat menggunakan laser eksternal 488 nm mengonfirmasi efisiensi emisi rendah dari label 2-AMAC pada panjang gelombang ini. Di bawah kondisi eksperimen ini, manfaat penggunaan laser 405 nm yang diharapkan berdasarkan spektrum emisi-eksitasi 2-AMAC ditunjukkan dengan jelas. Hasil ini menunjukkan bahwa jalur cahaya dari laser internal ke sel deteksi jauh lebih optimal daripada jalur cahaya untuk sambungan laser eksternal. Meskipun fitur modul LIF ini tidak dapat diubah dengan mudah, penyambungan laser eksternal ke pemandu cahaya eksternal yang lebih efisien dapat dimanfaatkan.
9 Penutup
Karena penggabungan laser hanya menggunakan lensa bola itu sederhana dan sedikit bervariasi dengan uji coba perakitan yang berbeda, pengoptimalan lebih lanjut dari penggabungan pemandu cahaya direncanakan dalam studi mendatang untuk meningkatkan daya pancar total. Meskipun demikian, kesederhanaan ini memberikan pengaturan yang universal dan mudah yang mungkin dapat melampaui parameter penggabungan yang tidak ideal. Secara keseluruhan, hasil menunjukkan manfaat penyesuaian pengaturan LIF instrumen CE komersial berdasarkan karakteristik fluoresensi label individual untuk meningkatkan sensitivitas deteksi analisis CE/LIF. Perlu dicatat juga bahwa biaya adaptasi yang dikembangkan dari pengaturan deteksi LIF (modul laser solid-state, catu daya laser, kipas pendingin, filter optik, pemandu cahaya, lensa bola, adaptor sekat SMA, dan material untuk pencetakan 3D) diperkirakan sekitar €1500, yang tidak ada duanya dibandingkan dengan modul LIF komersial. Pengaturan deteksi yang dimodifikasi ditunjukkan oleh analisis HMO dalam kolostrum manusia dan ASI, yang biasanya hadir dalam konsentrasi yang relatif tinggi. Namun, penyesuaian CE/LIF yang disebutkan merupakan langkah yang relatif mudah tidak hanya untuk meningkatkan secara signifikan penerapan metode pelabelan 2-AMAC tetapi juga untuk analisis oligosakarida dan glikana berkonsentrasi rendah.
Kontribusi Penulis
Filip Dusa : investigasi, supervisi, visualisasi, penulisan – draf asli. Marcelina Rusin : investigasi, analisis formal, penulisan – tinjauan dan penyuntingan. Denisa Smolkova : investigasi. Jozef Sestak : investigasi. Justyna Dowrowolska-Iwanek : penulisan – tinjauan dan penyuntingan, sumber daya. Michał Woźniakiewicz : penulisan – tinjauan dan penyuntingan. Jana Lavicka : konseptualisasi, supervisi, perolehan dana, administrasi proyek, penulisan – tinjauan dan penyuntingan.
Ucapan Terima Kasih
Penelitian ini didanai bersama oleh Uni Eropa di bawah proyek ATEBIO (Teknik Lanjutan untuk Diagnostik Biomedis, ID Proyek CZ.02.01.01/00/23_020/0008535). Pekerjaan ini juga didukung oleh Badan Hibah Republik Ceko [22-00236S], Kementerian Pendidikan, Pemuda, dan Olahraga Republik Ceko [9F23002], dan Rencana Penelitian Institusional [RVO:68081715].
Penerbitan akses terbuka difasilitasi oleh Ustav analyticke chemie Akademie ved Ceske republiky, sebagai bagian dari perjanjian Wiley – CzechELib.





Tinggalkan Balasan