Abstrak Grafis
Sebuah metodologi baru disajikan untuk mempelajari kinetika reaksi penggantian galvanik antara perak dan emas, yang memungkinkan, untuk pertama kalinya dalam pengetahuan kita, pemantauan waktu nyata terhadap dinamika reaksi redoks ini dengan mengukur kekuatan pendorong utama, yaitu potensial redoks yang bergantung pada waktu dan konsentrasi, yang tidak dapat ditangkap oleh metode mikroskopis, optik, atau sinar-X apa pun.
 Abstrak
Abstrak
Reaksi penggantian galvanik yang dipicu oleh perbedaan potensial elektrokimia antara dua logam memungkinkan perancangan nanostruktur multifungsi untuk katalisis, penginderaan, dan energi. Namun, masih ada pengetahuan terbatas tentang dinamika dalam ranah non-keseimbangan dan kesetimbangan untuk memaksimalkan akses material atau mencegah kerusakan struktur. Sebuah metodologi dilaporkan untuk menangkap peristiwa pertukaran galvanik antara atom-atom partikel Ag polos yang diendapkan secara elektrode dan spesies Au (III) Cl 4 − berair . Ketika populasi spesies Au (III) Cl 4 − meningkat dari nilai stoikiometris menjadi dua orde besaran, parameter potensial rangkaian terbuka yang menentukan pertukaran galvanik dalam domain non-keseimbangan dan kesetimbangan mengikuti bentuk kuasi-sigmoidal. Mekanisme jaringan reaksi autokatalitik dipostulatkan. Reaksi galvanik dapat diinterupsi kapan pun diperlukan untuk menghasilkan zat antara yang stabil dan dapat dipisahkan yang meningkatkan laju pembentukannya sendiri. Pengetahuan tentang kurva potensial-waktu yang bergantung pada konsentrasi Au (III) Cl 4 − memungkinkan pengurangan drastis durasi reaksi, dari 85 menjadi 13 menit, dengan tetap mempertahankan struktur dan sifat material, yang niscaya akan menginspirasi wawasan baru ke dalam proses pertukaran galvanik lainnya.
1 Pendahuluan
Dalam beberapa dekade terakhir, material bimetalik telah menarik minat di berbagai bidang seperti katalisis, ilmu lingkungan, kedokteran, dan energi. Di antara banyak rute sintetis untuk menyetel struktur, reaksi penggantian galvanik (GRR) adalah metode serbaguna untuk mendapatkan struktur bimetalik berpori dan hierarkis dengan sifat yang dapat beradaptasi. [ 1 – 8 ] GRR secara termodinamika, merupakan reaksi redoks spontan yang didorong oleh perbedaan potensial elektrokimia antara dua logam yang bertentangan dengan efek Kirkendall (KE) yang didorong oleh perbedaan koefisien difusi timbal balik dari dua materi. [ 9 – 11 ] Selain efek menguntungkan untuk mengendalikan struktur partikel pada skala atom, pengetahuan tentang data termodinamika dan kinetik dari GRR dan KE sangat berguna untuk mencegah atau membatasi kerusakan material yang parah (pembentukan rongga dalam paduan, pelarutan logam, pembentukan lumpur selama pelapisan logam, penurunan adhesi, dan melepuhnya lapisan). [ 3 ]
GRR melibatkan penggantian sebagian atau seluruh atom logam yang dikorbankan, yaitu logam dengan potensial redoks terendah. Akibatnya, atom logam dengan potensial redoks tertinggi menggantikan atom yang keluar, sehingga menghasilkan struktur bimetalik berpori dan/atau regangan kisi tergantung pada stoikiometri reaksi keseluruhan. [ 1 , 12 , 13 ] Hal ini berlaku untuk GRR antara Ag(0) dan Au(III), karena potensial redoks standar AuCl4 − / Au ( E 0 = 1,00 V SHE (elektroda hidrogen standar (SHE)) lebih positif daripada Ag + /Ag ( E 0 = 0,80 V SHE ) ketika mempertimbangkan material massal. Memang, Pattadar et al. [ 4 ] menunjukkan bahwa pengurangan ukuran partikel menghasilkan pembalikan termodinamika GRR antara perak dan emas atau platinum, disebut sebagai antigalvanik, [ 14 ] yang membangkitkan model Plieth yang penting [ 14 , 15 ] yang menghubungkan potensial oksidasi logam dengan ukuran partikel dan tegangan permukaan. [ 16 ] Meskipun ada sejumlah strategi dalam beberapa tahun terakhir untuk menginterogasi GRR antara perak dan emas, [ 1 , 4 , 10 , 17 – 20 ] Pemantauan dinamika reaksi redoks ini secara real-time terbatas. Berbagai bentuk kristal perak biasanya merupakan templat pengorbanan untuk mensintesis bahan bimetalik berpori (karena setidaknya dua atom perak digantikan oleh satu atom logam yang masuk) berdasarkan Au, Cu, Pt, Pd, dll. [ 3 , 8 , 10 , 17 , 18 , 20 , 21 ] Namun, sebagian besar penelitian difokuskan pada persiapan partikel logam yang tidak didukung yang sering kali terdispersi dalam larutan dengan agen penutup organik, yang menghadirkan beberapa tantangan untuk mengakses parameter potensial sirkuit terbuka (OCP) sebenarnya yang menentukan evolusi GRR baik dalam ranah nonequilibrium maupun ekuilibrium. [ 22 – 24 ] Pendekatan yang umum digunakan melibatkan persiapan partikel logam yang kurang mulia terlebih dahulu dalam larutan sebelum dimasukkan ke dalam campuran pengganti galvanik yang mengandung spesies ionik dari logam yang lebih mulia, atau sebaliknya. [ 25 – 27 ]Metode ini menimbulkan tantangan dalam mengumpulkan partikel setelah GRR dan memindahkannya ke penyangga, karena partikel tersebut mungkin tetap terkontaminasi dengan surfaktan organik, yang merugikan pengoptimalan respons elektrokimianya. [ 4 ] Oleh karena itu, menyiapkan logam murni langsung pada elektroda sangat penting untuk mengatasi tantangan ini dengan menangkap peristiwa GRR dan memanfaatkan sepenuhnya potensi material turunannya. [ 4 , 28 , 29 ] Sintesis langsung partikel pada substrat dapat dicapai melalui beberapa metode. [ 30 – 32 ] Di antaranya, elektrodeposisi memungkinkan produksi partikel dengan kemurnian tinggi dengan kontrol presisi kerapatan permukaan dengan menyesuaikan parameter berbeda (arus, potensial, elektrolit, durasi, dll.). Rasouli dkk. [ 24 ] mengusulkan Pd-Ni yang disiapkan oleh GRR antara nikel yang diendapkan secara elektrode pada karbon kaca dan [PdCl 4 ] 2- dalam larutan berair, yang menyoroti bentuk sigmoid profil waktu OCP tanpa dampak reaktan pada durasi GRR. Sementara studi kami sebelumnya tentang GRR antara emas dan perak yang diendapkan secara elektrode pada elektroda difusi gas [ 18 ] menunjukkan bentuk sigmoid, studi penting dari Lo et al. [ 23 ] tidak menyaksikan hal itu ketika melakukan GRR perak dengan paladium. Kami mempertanyakan di sini apakah peristiwa GRR antara perak dan emas dengan kontrol halus atas konsentrasi garam emas dapat dipantau secara elektrokimia dengan menghubungkan profil waktu OCP ke mekanisme jaringan reaksi autokatalitik, [ 33 , 34 ] di mana zat antara adalah senyawa yang stabil dan dapat dipisahkan. Untuk tujuan ini, kami berhipotesis bahwa pemantauan OCP sebagai fungsi waktu dan konsentrasi reaktan akan memberikan pengetahuan yang akurat tentang peristiwa GRR, karena OCP menangkap gerakan kolektif dan sinkron dari elektron, ion, dan atom yang berpartisipasi.
2 Hasil dan Pembahasan
2.1 Dinamika Reaksi Penggantian Galvanik Perak oleh Emas
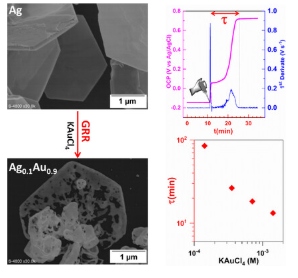
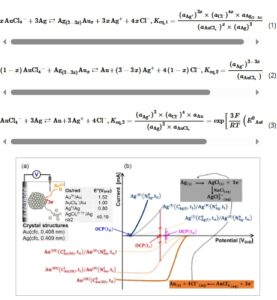
Untuk menguji hipotesis di atas, kami melakukan elektrodeposisi partikel Ag polos pada elektroda karbon kaca (GCE) dan kemudian mengendalikan kinetika GRR antara perak dan emas dengan mengatur populasi spesies Au(III) dalam larutan sambil memantau OCP untuk meningkatkan pemahaman dinamika GRR. Mengoperasikan GRR pada Gambar 1a dengan kelebihan besar Au (III) Cl4− mendorong OCP ( t > t0 ) ke arah potensial kesetimbangan Au (III) Cl4− / Au (0) seperti yang ditunjukkan pada Gambar 1b karena potensial campuran dari pasangan redoks yang terlibat diharapkan meningkat saat GRR berjalan. [ 35 ] Karena GRR adalah reaksi redoks, persamaan bersih dapat dijelaskan oleh tiga skenario: 1) reaksi paduan (Persamaan ( 1 ); 2) reaksi dealloying (Persamaan ( 2 )); dan 3) penggantian penuh (Persamaan ( 3 )), di mana K eq disebut sebagai konstanta kesetimbangan dan a disebut sebagai aktivitas. Untuk material mikro atau massal, data potensial redoks pada Gambar 1a menunjukkan bahwa Persamaan ( 3 ) adalah reaksi kuantitatif dengan konstanta kesetimbangan K eq,3 = 1,4 × 10 10 pada 25 °C. Faktanya, Gambar 1b dari kurva potensial arus menunjukkan bahwa selama GRR, jika tidak ada reaktan yang terlibat berlebih, amplitudo arus yang sesuai dengan setiap setengah sel berkurang, yang menyebabkan perubahan OCP. Pada awal reaksi, sistem tersusun atas atom perak (mampu menjalani reaksi oksidasi, anoda sel galvanik) dan ion emas(III) (mampu menjalani reaksi reduksi, katoda sel galvanik). Oleh karena itu, kinetika transfer elektron dan transpor massa juga termasuk dalam sistem GRR.
Gambar 1
Buka di penampil gambar
Mengembangkan metodologi untuk mengakses dinamika GRR. a) Pengukuran OCP. b) Perilaku kurva potensial arus sepanjang GRR: Penentuan setengah sel OCP, C menyatakan konsentrasi spesies terlarut (ion), N menyatakan jumlah atom untuk spesies padat (partikel), t 0 menyatakan waktu awal, t n menyatakan waktu kesetimbangan akhir, dan t i menyatakan waktu antara ( t 0 < t i < t n ).
Diketahui bahwa potensial redoks standar menurun ketika ukuran partikel mengecil, yang bahkan mengarah pada reaksi antigalvanik. [ 4 , 14 , 15 ] Jadi untuk menghindari efek tersebut dan juga orientasi kristalografi, kami menargetkan partikel berukuran mikrometer dan lebih disukai permukaan Ag(111) ( Gambar 2a–f ). Seperti yang ditunjukkan pada Gambar 1b , presipitasi AgCl dapat mengganggu GRR, jadi kami melakukan GRR dalam larutan air garam yang memungkinkan penekanan tersebut menurut diagram spesiasi perak-klorida. [ 36 , 37 ] Salah satu tujuan utama GRR sistem Ag–Au adalah menargetkan Persamaan ( 1 ) di mana tersisa 5–20 at% Ag yang dipadukan dengan 95–80 at% Au untuk membentuk struktur berpori dengan tiga efek menguntungkan kumulatif, yaitu, deformasi kisi geometri jarak jauh (regangan), sinergi (banyak logam), dan efek transfer muatan elektronik jarak pendek. [ 38 ]
Gambar 2
Buka di penampil gambar
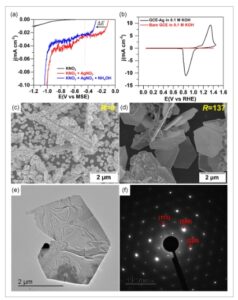
Elektrodeposisi partikel Ag yang dimediasi amonia pada GCE. a) LSV dalam larutan jenuh Ar [20 mV s −1 , 25 °C, 200 mm KNO 3 , 0,06 mm AgNO 3 , 8,2 mm NH 4 OH ( R = n (NH 4 OH)/ n (AgNO 3 ) = 137)]. b) CV (20 mV s −1 , 25 °C, 0,1 m KOH) sebelum (GCE) dan setelah elektrodeposisi (GCE-Ag). SEM dari GCE-Ag yang disintesis: c) tanpa dan d) amonia. e) Gambar TEM, dan f) Pola SAED dari GCE-Ag.
2.2 Karakterisasi Perak Elektrodeposisi Elektroda (GCE-Ag)
Bertujuan untuk menemukan potensi yang sesuai untuk elektrodeposisi Ag mikroplat yang dimediasi amonia pada GCE, pertama-tama kami melakukan pengukuran voltametri sapuan linier (LSV). Eksperimen kontrol ditunjukkan pada Gambar 2a , rasio molar R = n (NH 4 OH)/ n (AgNO 3 ) ditetapkan menjadi 137 (data yang diperluas pada Gambar S1a, Informasi Pendukung, R = 0–1666). Pergeseran drastis dalam potensi permulaan reduksi Ag(I) menjadi Ag(0), dari -0,16 menjadi -0,35 V MSE (elektroda merkuri-merkuri sulfat) mengonfirmasi kompleksasi dan kemampuan untuk mengatur termodinamika dan kinetika elektrodeposisi. Nilai-nilai eksperimen ini mendekati potensi Nernstian dari E eq = -0,09 dan -0,27 V MSE untuk Ag + /Ag dan Ag + (NH 3 ) 2 /Ag, berturut-turut. Peningkatan kerapatan arus tajam pada potensial yang lebih negatif disebabkan oleh reaksi evolusi hidrogen (HER) pada gugusan perak yang diendapkan secara elektrodeposisi pertama yang mengkatalisis HER, yang merupakan dasar dari sintesis kejut listrik tempat koalesensi dan fusi gugusan menjadi partikel yang lebih besar diatur. [ 31 , 39 ] Berdasarkan hasil ini, kami mengoperasikan kronoamperometri (Gambar S1b, Informasi Pendukung) pada potensial yang berbeda dari −0,38 hingga −0,70 V MSE dan durasi reaksi dari 15 menit hingga 4 jam.
Kami menguji efektivitas pengendapan perak pada elektrode kerja (GCE-Ag) dengan tiga metode komplementer, voltametri siklik (CV) dalam elektrolit KOH 0,1 m (Gambar 2b ), mikroskopi elektron (Gambar 2c–e ), dan difraksi elektron (Gambar 2f ). CV pada Gambar 2b mengonfirmasi keberhasilan elektrodeposisi Ag karena puncak reduksi utama untuk GCE-Ag pada ≈0,9 V RHE (elektrode hidrogen reversibel, kurva kalibrasi pada Gambar S2, Informasi Pendukung) merupakan karakteristik reduksi Ag 2 O (muatan listrik Q = 291 μC) yang terbentuk selama pemindaian maju. [ 40 , 41 ] Menggunakan muatan metrik Q 0 = 420 μC cm −2 untuk lapisan tunggal Ag 2 O [ 40 ] menghasilkan luas permukaan aktif secara elektrokimia sebesar Q / Q 0 = 0,69 cm 2 , yang relatif rendah untuk 73 μg Ag (Gambar S1b, Informasi Pendukung) pada GCE sebesar 0,20 cm 2 sehingga menunjukkan pembentukan partikel yang agak besar. Untuk menguji hipotesis tersebut, kami melakukan mikroskop elektron pemindaian (SEM, Gambar 2c–e dan S3, Informasi Pendukung). Sementara ukuran skala mikro dikonfirmasi, morfologi yang berbeda diperoleh sebagai fungsi dari rasio molar R = n (NH 4 OH)/ n (AgNO 3 ). Morfologi berubah dari bentuk dendritik untuk R = 0 (Gambar 2c ) ke bentuk berbentuk bola metalik untuk R = 1666 (Gambar S3, Informasi Pendukung) melalui bentuk pelat (Gambar 2d ), yang menunjukkan bahwa morfologi perak yang diendapkan dapat dikontrol dengan menyesuaikan konsentrasi amonia. Berdasarkan parameter tambahan yang diselidiki dari potensi yang diterapkan (dari -0,38 hingga -0,70 V MSE , Gambar S4, Informasi Pendukung) dan durasi (dari 15 menit hingga 4 jam, Gambar S5, Informasi Pendukung) untuk memperhitungkan tahap nukleasi dan pertumbuhan, kondisi yang dioptimalkan adalah -0,45 V MSE , R = 137, dan 4 jam untuk partikel berbentuk heksagonal yang ditargetkan yang kemungkinan mengekspos Ag(111). Untuk mengonfirmasi hal ini, kami menerapkan mikroskopi elektron transmisi (TEM, Gambar 2e ). Profil intensitas yang diekstraksi dari TEM resolusi tinggi (HRTEM) (Gambar S6, Informasi Pendukung) menunjukkan-nilai jarak 2,55 Å yang sesuai dengan Ag(111) karena komposisi atom akhir adalah 92 at% Ag dan 8 at% O dari analisis mikroskop elektron transmisi pemindaian yang digabungkan dengan spektroskopi sinar-X dispersif energi (STEM-EDX) yang dilaporkan pada Gambar S7, Informasi Pendukung. Keberadaan oksigen dapat dijelaskan oleh oksidasi alami logam saat terpapar udara. Untuk menilai kristalinitas partikel Ag yang disintesis, kami melakukan difraksi elektron area terpilih (SAED). Pola SAED GCE-Ag pada Gambar 2f terbuat dari bintik-bintik kecil yang membentuk cincin, sehingga menyoroti kristalinitas partikel Ag.
2.3 Pemantauan Reaksi Penggantian Galvanik (GRR) Perak pada Elektroda Karbon Kaca (GCE) oleh Emas (III) dalam Larutan
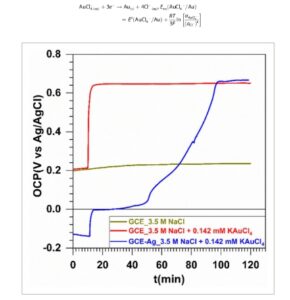
Setelah mengkarakterisasi template GCE-Ag, kami selanjutnya melakukan pemantauan real-time terhadap dinamika GRR melalui OCP berdasarkan teori Gambar 1b dan set-up eksperimen Gambar 1a di mana GCE-Ag dihubungkan ke elektroda kerja. Elektroda referensi adalah Ag/AgCl. Perlu dicatat bahwa hasil Gambar 3 untuk eksperimen kontrol pada pengukuran OCP dengan GCE murni (tanpa partikel perak), tetapi dengan spesies emas(III) dalam larutan elektrolit, hanya menunjukkan respons Nernstian berupa peningkatan spontan potensial onset, di mana reaksi reduksi elektrokimia Au(III) menjadi Au(0) seharusnya dimulai secara eksperimental (Persamaan ( 4 )). Setelah stabilisasi OCP, analisis GCE tidak menunjukkan jejak emas, yang diharapkan karena tidak ada elemen pereduksi untuk mengubah Au(III) menjadi Au(0), disebut sebagai “elektrodeposisi emas,” medan yang terkenal. [ 39 , 42 , 43 ] Menurut Persamaan ( 4 ), potensial termodinamika (teoretis) tempat reduksi Au (III) Cl 4 − menjadi Au (0) akan dimulai adalah E eq (Au (III) Cl 4 − /Au (0) ) = 0,89 V versus SHE = 0,69 V versus Ag/AgCl untuk 0,142 mm KAuCl 4 . Kita dapat melihat bahwa dalam kehadiran perak, profil OCP(t) hingga potensial kesetimbangan sangat berbeda. Jadi, penekanan selanjutnya diberikan pada variasi konsentrasi KAuCl 4 dari 0,014 hingga 1,419 mm , yang sesuai dengan rasio molar R GRR = n (KAuCl 4 )/ n (Ag) = 0,31–31,30. Secara teoritis, pertukaran penuh perak oleh emas sesuai dengan R GRR = 0,33, Persamaan ( 3 ). Gambar 4a menunjukkan profil OCP, sebelum ( t < 10 menit) dan setelah ( t > 10 menit) penyuntikan KAuCl4 ( 0,014 mm ( R GRR = 0,31) dilaporkan pada Gambar S8, Informasi Pendukung, karena kinetika GRR terlalu lambat untuk mencapai kesetimbangan), yang memanifestasikan bentuk kuasi-sigmoid yang sering kali merupakan tanda perilaku autokatalitik. [ 33 , 34 , 44 , 45 ] Karena GRR dapat dihentikan kapan saja untuk menghasilkan perantara Ag yang stabil dan dapat dipisahkan1− x Au x yang meningkatkan laju pembentukannya sendiri, [ 4 ] kami mendalilkan mekanisme jaringan reaksi autokatalitik, yang diperhitungkan dalam reaksi kimia dalam larutan. Secara mekanis, Ag pertama-tama bereaksi dengan Au(III) untuk membentukmathematical equation, yang terakhir bereaksi dengan sisa Au(III) untuk menghasilkanmathematical equationdan seterusnya secara berjenjang sampai struktur stabilmathematical equation(0 < x n <1) pada kesetimbangan dengan media pengganti galvanik tercapai.
Gambar 3
Buka di penampil gambar
Percobaan kontrol tentang efek emas(III) dan perak(0) pada perilaku OCP terhadap waktu tanpa adanya partikel Ag pada GCE dan dengan adanya partikel Ag pada GCE (disebut sebagai ‘GCE-Ag’): GCE dalam 3,5 m NaCl, GCE dalam 3,5 m NaCl + 0,142 m m KAuCl 4 , dan GCE-Ag dalam 3,5 m NaCl + 0,142 m m KAuCl 4 .
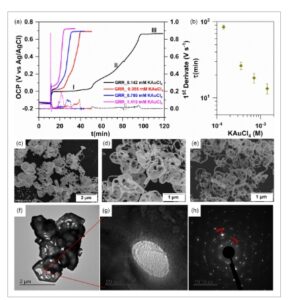
Gambar 4
Buka di penampil gambar
a) OCP versus waktu selama GRR dengan konsentrasi KAuCl4 yang berbeda [ 25 °C, pengadukan magnetik, 3,5 m NaCl + KAuCl4 ] . b) Efek konsentrasi Au(III) pada waktu (dilambangkan “ τ ”) yang diperlukan untuk mencapai kesetimbangan pada panel (a). c,d) Gambar SEM struktur perak-emas setelah GRR: c) 0,142, d) 0,709, dan e) 1,419 mm KAuCl4 . f ,g) Gambar TEM, dan h) Pola SAED.
Di sini, baik panjang periode induksi atau fase lag (I) dan fase eksponensial (II) sangat dipengaruhi oleh populasi spesies AuCl4 − di dekat antarmuka GCE-Ag sementara nilai OCP pada fase saturasi (III) cukup mirip, sekitar 0,72 V Ag /AgCl (0,92 V SHE ), yang mendekati E eq (Au (III) Cl4 − /Au (0) ) = 0,89–0,92 V versus SHE = 0,69–0,72 V versus Ag/ AgCl untuk 0,142–1,419 mm KAuCl4 ( Persamaan ( 4 )). Untuk material GCE-Ag (Gambar 3 dan 4a ), setelah memperkenalkan AuCl4− , pergeseran cepat dalam potensial dan stabilisasi dikaitkan dengan peningkatan konsentrasi Ag(I) karena difusi ion AuCl4− di dekat permukaan elektroda [ 18 , 23 , 24 , 46 ] karena elektroda GDE tidak stabil sekitar 0 V versus elektroda Ag/AgCl (Gambar 3 ) . Selama fase jeda (I), potensial kuasi-stabil 0–0,05 V Ag /AgCl berada di bawah kinetika transfer elektron reaksi katoda dan difusi AuCl4− . Situs reaksi anoda beralih dari atom perak awalnya ke Ag1 − xAux di mana difusi atom Ag dan Au (kemungkinan kontribusi efek Kirkendall tersembunyi [ 9-11 ] ) menghasilkan peningkatan potensial yang substansial di wilayah (II).
Gambar 4b menunjukkan hubungan log–log antara konsentrasi AuCl 4 − dan durasi kumulatif fase lag (I) dan fase eksponensial (II), yang disebut sebagai τ dan adalah 85 ± 5, 26 ± 3, 18 ± 2,7, dan 13 ± 2 menit untuk 0,142, 0,355, 0,709, dan 1,419 mm AuCl 4 − , berturut-turut. Penurunan τ yang signifikan saat menambah populasi spesies AuCl 4 − mendukung mekanisme jaringan reaksi autokatalitik yang kami hipotesiskan. Upaya untuk menemukan model (teoretis atau numerik) yang sesuai dengan data eksperimen ini belum meyakinkan hingga saat ini. Namun demikian, kami akan berpendapat bahwa jawabannya, yang akan sangat menarik bagi seluruh komunitas ilmiah, terletak pada memperhitungkan baik transfer elektron maupun kinetika transpor massa (migrasi dalam medan listrik, difusi karena gradien potensial kimia, konveksi dalam medan kecepatan, efek sterik, koreksi Frumkin). [ 47 – 51 ] Dengan demikian, penerapan Frumkin–Butler–Volmer size-modified Poisson–Nernst–Planck (FBV-SMPNP) yang baru-baru ini dikembangkan untuk elektrolisis CO 2 [ 50 ] mungkin bekerja untuk GRR. Gambar 4c–e dan S9, Informasi Pendukung, menunjukkan evolusi morfologi struktur Ag 1− x Au x ketika GRR dihentikan setelah mencapai fase saturasi. Ketika populasi spesies AuCl 4 − bertambah, pembentukan lubang menjadi lebih jelas, sementara morfologi keseluruhan pelat mikro tetap integral. Pada 0,142 mm , tidak semua atom perak diserang oleh ion Au(III), yang menjelaskan peningkatan bertahap pada kurva OCP. Sebaliknya, pada 1,419 mm , pengenalan Au(III) menghasilkan pembentukan struktur yang sangat berpori, yang mendukung durasi pendek fase lag, didorong oleh oksidasi cepat Ag(0) oleh populasi besar spesies Au(III). [ 52 ] Dalam situasi seperti itu, ada kemungkinan juga bahwa endapan emas berikutnya dapat terbentuk di lokasi emas pertama daripada menggantikan posisi perak secara tepat dalam struktur, karena penghalang energi yang lebih menguntungkan dan kemungkinan kontribusi efek Kirkendall yang disebabkan oleh perbedaan koefisien difusi timbal balik dari kedua logam.
2.4 Analisis Komposisi dan Sifat Elektrokimia Penggantian Pasca Galvanik
Memiliki potensi yang hampir sama di wilayah (III) menunjukkan bahwa, terlepas dari konsentrasi AuCl4− awal , komposisi atom Ag1− x Aux akan sama, yang membutuhkan analisis unsur. Oleh karena itu, kami telah melakukan analisis komposisi dengan STEM-EDX. Memang, analisis TEM (Gambar 4f,g ) dan SAED (Gambar 4h ) mengonfirmasi struktur berpori dan kristalinitas partikel setelah GRR; namun, profil intensitas TEM setelah GRR tidak meyakinkan karena perak dan emas memiliki parameter kisi yang sama (Gambar 1a ) , alasan mengapa difraksi sinar-X tidak dilakukan. Pemetaan unsur ( Gambar 5a–c ) dan profil garis STEM-EDX (Gambar 5d ) mengungkapkan koeksistensi Ag dan Au dan distribusi homogennya pada tingkat atom. Bentuk heksagonal pelat Ag dipertahankan selama GRR, bahkan pada rasio molar tinggi R GRR = 31,30, yang merupakan 100 kali lipat dari stoikiometri (Persamaan ( 3 )). Komposisi atom yang ditentukan (Gambar S10, Informasi Pendukung) sebesar 8 at% Ag dan 92 at% Au konsisten dengan pengukuran massal (Tabel S1, Informasi Pendukung), di mana emas mewakili 90 ± 2 at%. Akibatnya, meskipun SEM pada Gambar 4c–e menunjukkan perbedaan morfologi, analisis komposisi menyoroti bahwa komposisi kesetimbangan akhir tidak bergantung pada konsentrasi KAuCl4 dalam kondisi kerja ini. Hasil baru ini, yang diperoleh dengan menggabungkan pemantauan langsung dan analisis ex situ, dengan jelas menunjukkan pengurangan waktu yang signifikan dalam GRR Ag oleh Au, dari lebih dari 85 menit menjadi sekitar 13 menit.
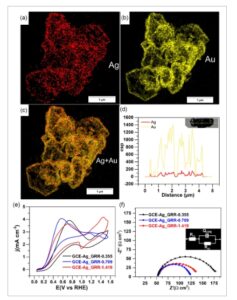
Gambar 5
Buka di penampil gambar
Pemetaan unsur STEM-EDX dari a) Ag, b) Au, dan c) Ag + Au. d) Profil intensitas pemindaian garis EDX dan citra medan terang STEM dalam sisipan. e,f) Kinerja komparatif, dalam 0,1 m KOH + 0,1 m D-glukosa, dari GCE-Ag_GRR- x , x = konsentrasi KAuCl 4 (m m ): e) CV (50 mV s −1 , 25 °C) dan f) Impedansi Nyquist bidang kompleks pada 0,25 V RHE (sisipan rangkaian listrik ekivalen R Ω + Q CPE // R ct ) untuk 0,1 m KOH + 0,1 m D-glukosa pada 25 °C.
Kami kemudian menyelidiki apakah atau tidak perolehan dalam waktu reaksi ini dapat disertai oleh setidaknya pemeliharaan aktivitas katalitik bahan-bahan tersebut. Oleh karena itu kami mempertimbangkan elektrooksidasi glukosa sebagai reaksi model untuk peningkatan elektrokatalitik biomassa selulosa menjadi molekul platform. Hasil CV dari Gambar S11a, Informasi Pendukung, mengonfirmasi bahwa perak sendiri memiliki aktivitas elektrokatalitik yang penting untuk oksidasi glukosa, puncak positif pada 1,30 V RHE sesuai dengan konversi Ag-ke-Ag 2 O, dan proses sebaliknya adalah puncak pada 0,85 V RHE . Katalis berbasis emas telah dipelajari secara ekstensif untuk oksidasi glukosa karena aktivitas katalitiknya yang ditingkatkan dan ketahanan yang lebih besar terhadap keracunan permukaan. [ 42 , 53 , 54 ] Oleh karena itu, menggabungkan emas dan perak dengan GRR untuk membuat katalis paduan berpori berpotensi meningkatkan kinerja. CV elektroda Ag 1− x Au x tanpa adanya D-glukosa pada Gambar S11b, Informasi Pendukung, menyoroti perubahan CV Ag murni, yang mengonfirmasi keberadaan emas. Meskipun komposisi atom serupa, perilaku elektrokimia sedikit berubah di wilayah pembentuk oksida, yang memengaruhi proses oksidasi glukosa (Gambar 5e ). Oksidasi glukosa dimulai pada ≈0,1 V RHE ; namun, katalis yang disiapkan dengan kondisi GRR 0,7–1,4 mm KAuCl4 menunjukkan kinetika elektrokatalitik yang lebih tinggi dalam rentang potensial 0,2–0,5 V RHE , yang dapat dijelaskan oleh peningkatan porositas (gambar SEM) yang menambah jumlah situs aktif. Memang, pada Gambar 5e , luas puncak oksida lebih rendah untuk GCE-Ag_GRR-1.419 daripada untuk GCE-Ag_GRR-0.355, yang berarti bahwa normalisasi Gambar 4g oleh luas permukaan yang aktif secara elektrokimia akan menghasilkan aktivitas spesifik yang jauh lebih tinggi untuk GCE-Ag_GRR-1.419 daripada untuk GCE-Ag_GRR-0.355. Ini berkontribusi pada pengurangan resistansi transfer muatan ( R ct ) seperti yang ditunjukkan oleh spektroskopi impedansi elektrokimia potensiostatik (EIS) pada 0,25 V RHE (Gambar 5f dan Tabel S2, Informasi Pendukung), R ct = 127, 71, dan 87 Ω cm 2 untuk GCE-Ag_GRR-0.355, GCE-Ag_GRR-0.709, dan GCE-Ag_GRR-1.419, masing-masing. Ke depannya, tentu akan sangat menarik untuk mencari model teoritis yang mampu memprediksi hasil eksperimen ini atau, dalam konteks yang lebih praktis, untuk mengintegrasikan metodologi sintesis katalis ke dalam pendukung elektroliser praktis, seperti elektroda difusi gas.
3 Kesimpulan
Singkatnya, karya ini memberikan kontribusi elemen baru pada pemahaman kita tentang reaksi penggantian galvanik, di mana penggantian sebagian atau lengkap logam dengan potensial redoks terendah oleh atom logam dengan potensial redoks tertinggi yang menempati tempat atom yang keluar umumnya menghasilkan struktur multilogam berpori dan/atau deformasi kisi tergantung pada stoikiometri keseluruhan reaksi. Menangkap dinamika proses redoks ini secara langsung dalam ranah non-keseimbangan dan keseimbangan melalui transien OCP memungkinkan pengajuan mekanisme jaringan reaksi autokatalitik. Durasi periode induksi atau fase lag dan fase eksponensial sangat dipengaruhi oleh populasi spesies Au (III) Cl 4 − di dekat antarmuka Ag (0) , sedangkan nilai OCP pada fase saturasi (III) adalah sekitar 0,92 V SHE , yang tertutup untuk E eq (Au (III) Cl 4 − /Au (0) ) = 0,89–0,92 V SHE untuk 0,142–1,419 m m KAuCl 4 . Sementara menawarkan rute sintesis serbaguna yang secara drastis mengurangi durasi reaksi galvanik, dari 85 menjadi 13 menit, tanpa mengubah struktur dan sifat material, upaya untuk memodelkan pola kuasi-sigmoidal dari data eksperimen ini masih belum meyakinkan hingga saat ini. Oleh karena itu, kami merilis temuan penelitian kami untuk memungkinkan orang lain untuk bergerak maju di mana kami, untuk saat ini, tidak dapat melakukannya. Memang, jawabannya, yang akan sangat menarik bagi seluruh komunitas ilmiah, akan terletak pada pertimbangan kinetika perpindahan elektron dan kinetika transportasi massa (migrasi, difusi, konveksi, efek sterik, koreksi Frumkin). Metodologi saat ini, yang berkontribusi pada pengetahuan tentang bagaimana elektron, atom, dan ion bergerak secara serempak untuk membentuk struktur berpori yang stabil dari rasio pertukaran 3Ag per 1Au untuk sistem perak-emas, dapat menginspirasi kemajuan baru dalam sintesis nanostruktur dengan mengeksplorasi sistem reaksi yang lebih kompleks melalui rasio pertukaran galvanik yang berbeda. Memang, mengukur gaya pendorong pertukaran galvanik dengan memperoleh data termodinamika dan kinetik yang hilang (konstanta laju dan potensial redoks sebagai fungsi waktu dan ukuran nanopartikel) merupakan hal mendasar untuk mengusulkan arsitektur katalitik baru seperti bahan berpori entropi tinggi untuk berbagai aplikasi praktis dalam katalisis, penginderaan, dan energi.
4 Bagian Eksperimen
Bahan Kimia dan Material
Batang baja tahan karat yang tidak berputar yang terhubung ke ujung PTFE Change Disk RDE (Glassy Carbon Disk Insert, 5,0 mm OD × 4,0 mm tebal) dibeli dari Pine Research Instrumentation (USA) dan digunakan sebagai elektroda kerja, yang selanjutnya disebut sebagai GCE. Sebelum setiap pengukuran elektrokimia, sisipan cakram karbon kaca dipoles secara mekanis dan berurutan dengan bubur alumina dengan ukuran partikel yang menurun sebesar 3, 1, dan 0,05 μm. Setelah dicuci dengan air murni, dibersihkan dengan sonikasi selama 5 menit. Kalium hidroksida (KOH, 99,98% (basis logam jejak), Acros Organics), kalium nitrat (KNO 3 , Sigma–Aldrich, 99,0% min), perak nitrat (AgNO 3 , Premium, 99,9995% (basis logam), Alfer aesar), kalium tetrakloroaurat (III) (KAuCl 4 · x H 2 O, 99,9%, Alfer aesar), larutan amonia (NH 4 OH, 30%, untuk analisis-ACS, Pereaksi Carlo Erba), natrium klorida (NaCl, 100%, VWR), dan D-(+)-glukosa (99,5%, Sigma–Aldrich) digunakan sebagaimana diterima. Gas Nitrogen (N 2 , 4,5) sangat murni (Air Liquide, Prancis) dan semua air sangat murni (MQ) yang disebutkan disediakan oleh sumber Milli-Q Millipore (18 m Ω cm pada 20 °C). Untuk percobaan elektrokimia, semua peralatan gelas yang digunakan pertama-tama direndam selama sedikitnya 12 jam dalam larutan kalium permanganat yang diasamkan untuk mengoksidasi semua pengotor, terutama yang organik (KMnO 4 pada 3 g L −1 dan H 2 SO 4 pada 2,25 mol L −1 ), yang diikuti dengan pencucian dengan larutan air + H 2 SO 4 + H 2 O 2 (masing-masing 1 vol.). [ 55 – 57 ] Untuk reaktor yang digunakan untuk sintesis, pencucian dengan aqua regia (2 vol. HCl + 1 vol. HNO 3 ) dilakukan selama 15–30 menit. Kita akhiri dengan membilas dengan air dingin dan panas dengan urutan sebagai berikut: dingin, panas, dingin.
Elektrodeposisi Perak pada Elektroda Karbon Kaca
Percobaan elektrodeposisi dilakukan pada suhu terkontrol 25 ± 2 °C dalam sel kaca tiga elektroda konvensional (kompartemen tunggal). Elektroda pelat karbon kaca (Alfer Aesar) dan elektroda merkuri-merkuri sulfat (Hg|Hg 2 SO 4 |K 2 SO 4 jenuh, MSE, OrigaLys ElectroChem SAS) digunakan sebagai elektroda pembanding dan elektroda pembanding. Partikel perak diendapkan ke GCE, yang berfungsi sebagai elektroda kerja dalam pengaturan elektrokimia. Biasanya, campuran yang terdiri dari 94 mL 200 mm KNO3 , 6 mL larutan stok AgNO3 1 mm (disiapkan dalam 200 mm KNO3 ), dan berbagai volume amonia untuk R = n (NH4OH ) / n (AgNO3 ) ( R = 0, 62, 137, dan 1666) diaduk perlahan dan dihilangkan udaranya dengan N2 selama sekitar 15 menit sebelum percobaan. Elektrodeposisi dilakukan dengan menggunakan kronoamperometri. Elektroda kerja pertama-tama dikenai pengukuran potensial rangkaian terbuka selama 30 detik (tidak termasuk langkah degassing sebelumnya), diikuti oleh pengukuran deposisi perak; potensiostat yang digunakan adalah VIONIC (Metrohm). Potensi deposisi, berkisar dari -0,38 hingga -0,70 V versus MSE, dipilih berdasarkan data LSV kontrol yang dikumpulkan pada Gambar S1, Informasi Pendukung. Untuk optimasi, elektrodeposisi dilakukan selama durasi yang berbeda: 15 menit dan 1, 2, dan 4 jam.
Reaksi Penggantian Galvanik antara Perak (0) dan Emas (III)
GRR antara perak (0) dan emas (III) dilakukan dengan perak yang diendapkan secara elektrodeposit yang diperoleh di bawah kondisi optimal R = n (NH 4 OH)/ n (AgNO 3 ) = 137, potensial −0,45 V versus MSE dan durasi 4 jam (sekitar 0,68 ± 0,03 μmol Ag , yaitu pemuatan 3,46 μmol Ag cm −2 atau 374 μg Ag cm −2 ). GRR dilakukan dalam sel kaca yang suhunya terkontrol pada 25 ± 2 °C. Reaksi penggantian dilakukan dalam larutan yang mengandung 12,872 mL NaCl 3,5 m dan 2,128 mL larutan stok dengan berbagai konsentrasi KAuCl4 untuk memperoleh konsentrasi akhir dalam reaktor sebesar x m KAuCl4 , di mana x = 0,014, 0,142, 0,355, 0,709, dan 1,419, yang masing- masing bersesuaian dengan 0,21, 2,13, 5,32, 10,63, dan 21,28 μmol Au . Pertama, elektroda direndam dalam larutan 12,872 mL NaCl 3,5 m yang telah dilepaskan gasnya , dan OCP direkam menggunakan elektroda referensi kecil (Ag/AgCl, CH Instruments, Inc.) sambil diaduk perlahan. Setelah stabilisasi, 2,128 mL KAuCl4 dimasukkan dengan laju 0,75 mL min −1 . Durasi reaksi penggantian bergantung pada konsentrasi KAuCl4 . Setelah potensial kesetimbangan tercapai, reaksi dihentikan dengan membilas elektroda beberapa kali dengan air MQ.
Karakterisasi Fisikokimia
Morfologi material dianalisis menggunakan Hitachi S4800 SEM. Analisis unsur dilakukan secara lokal melalui EDX. Analisis SEM-EDX juga dilakukan dengan mikroskop elektron Zeiss EVO HD15. HRTEM dan STEM dilakukan menggunakan mikroskop JEOL 2200FS yang dilengkapi dengan pistol emisi medan yang beroperasi pada 200 kV. STEM-EDX dilakukan dengan detektor SDD tanpa jendela Oxford Instrument X-Max N 100 TLE 100 mm 2 .
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan menggunakan potensiostat di atas (perangkat lunak VIONIC, Metrohm, VioIntello1.5). Elektroda referensi adalah Hg|HgO|KOH 0,1 m (MOE, Elektroda Referensi RE-61AP untuk larutan alkali, BAS Inc.). Pertama, kami melakukan kalibrasi menggunakan platina sebagai elektroda kerja, MOE sebagai elektroda referensi, dan pelat karbon kaca sebagai elektroda lawan. Untuk semua pengukuran yang dilakukan dalam KOH, potensial disesuaikan dengan elektroda hidrogen reversibel (RHE). Untuk tujuan ini, CV direkam pada rentang potensial -0,9 hingga -0,8 V versus MOE di bawah aliran kontinu H 2 dengan kemurnian tinggi dari elektroliser di lokasi (HYGEN 200, CLAIND, Italia). Hubungan kalibrasi diberikan oleh E (V vs RHE) = E (V vs MOE) + Δ E , Δ E = 0,85 V pada 25 °C dalam 0,1 m KOH, seperti yang ditunjukkan oleh kurva kalibrasi yang ditunjukkan pada Gambar S2, Informasi Pendukung. Reaksi oksidasi glukosa dilakukan dalam 0,1 m KOH yang mengandung 0,1 m D-glukosa. Spektroskopi impedansi elektrokimia potensiostatik (EIS, 100 kHz hingga 100 mHz, amplitudo 10 mV, 10 titik per dekade, larutan yang tidak diaduk) dilakukan pada 0,25 V versus RHE. Voltammogram yang dilaporkan dan potensial yang diterapkan selama EIS tidak dikoreksi oleh penurunan iR (resistansi ohmik 50–53 Ω cm 2 dalam 0,1 m KOH + 0,1 m D-glukosa). Semua pengukuran elektrokimia dilakukan menggunakan sel kaca konvensional tiga elektroda yang suhunya terkontrol pada (25 ± 2) °C.





Tinggalkan Balasan