Abstrak Grafis
Studi ini menggunakan strategi codoping Nb 5+ /Al 3+ untuk mengatur secara sinergis ketidakteraturan kation dan struktur mikro pada material katode nikel tinggi (LiNi 0,83 Co 0,12 Mn 0,05 O 2 ). Doping Nb menyempurnakan ukuran partikel primer sementara doping Al menekan ketidakteraturan Li + /Ni 2+ yang disebabkan Nb . Sinergi mereka mengurangi retakan mikro. Material yang didoping bersama mencapai retensi kapasitas 95,93% setelah 200 siklus dan 160,1 mAh g −1 pada suhu 5 C, memberikan ide desain untuk baterai dengan kepadatan energi tinggi.

Abstrak
Sistem pencitraan medis canggih memerlukan keandalan yang luar biasa dan masa pakai yang lebih lama. Sementara bahan katode berlapis nikel tinggi (Li[Ni x Co y Mn 1− x − y ]O 2 , Ni ≥ 80%) menawarkan kepadatan energi yang tinggi, ketidakstabilan strukturalnya mengancam operasi medis yang kritis. Studi ini membahas tantangan kinerja elektrokimia dan stabilitas struktural dalam bahan katode berlapis nikel tinggi. Strategi codoping menggunakan Nb 5+ dan Al 3+ digunakan untuk mengeksplorasi secara mendalam mekanisme modifikasi dan efek sinergis. Hasilnya menunjukkan bahwa doping Nb 5+ menginduksi kontraksi partikel primer, yang meningkatkan kepadatan struktur kristal dan memfasilitasi difusi Li + ; namun, itu juga meningkatkan pencampuran kation Li + /Ni 2+ , yang berpotensi menyebabkan hilangnya kapasitas ireversibel selama siklus awal. Sebaliknya, pengenalan Al 3+ secara efektif mengurangi pencampuran kation yang diperburuk oleh Nb 5+ , mempertahankan gangguan Li + /Ni 2+ dalam kisaran optimal. Penyesuaian ini secara signifikan mengurangi polarisasi elektroda selama siklus jangka panjang dan mencegah pembentukan retakan mikro. Akibatnya, setengah sel katode yang didoping bersama mempertahankan 95,93% kapasitasnya setelah 200 siklus, sekaligus menghasilkan kapasitas pelepasan 160,1 mAh g −1 pada laju 5 C. Selain itu, kinerja suhu tinggi dan suhu ruangan meningkat secara nyata. Efek sinergis dari doping bersama Nb 5+ dan Al 3+ tidak hanya menstabilkan struktur berlapis tetapi juga meningkatkan kinerja laju dan masa pakai siklus.
1 Pendahuluan
Sistem perawatan kesehatan modern semakin bergantung pada modalitas pencitraan medis canggih seperti pencitraan resonansi magnetik (MRI) dan tomografi terkomputasi (CT) untuk memberikan diagnostik yang presisi. Perangkat penting ini, khususnya unit bergerak dan sistem cadangan darurat, membutuhkan sumber daya yang menggabungkan kepadatan energi tinggi dengan stabilitas operasional yang tanpa kompromi. Baterai ion litium (LIB) telah muncul sebagai komponen penyimpanan energi penting untuk peralatan medis bergerak dan sistem daya darurat. [ 1 ] Pada tahun 1980-an dan 1990-an, terobosan kemajuan dalam teknologi LIB dicapai sebagian besar karena kontribusi penting Profesor Goodenough. Karyanya mengarah pada penemuan beberapa bahan katode utama, termasuk litium kobalt oksida (LiCoO 2 ), [ 2 ] litium mangan oksida (LiMn 2 O 4 ), [ 3 ] dan kemudian litium besi fosfat (LiFePO 4 ). [ 4 ] Bahan katode berlapis nikel tinggi (LiNi x Co y Mn z O 2 , NCM) sejak itu menarik perhatian yang signifikan karena kepadatan energinya yang tinggi. Namun, bahan-bahan ini rentan terhadap pencampuran kation Li + /Ni2 + selama penggunaan praktis, yang dapat memperburuk reaksi samping yang berbahaya dalam kondisi tegangan tinggi dan mempercepat penyebaran retakan mikro. [ 5 ] Akibatnya, masalah-masalah ini membatasi kemampuan laju dan stabilitas siklus jangka panjang baterai. [ 6 ]
Penelitian ekstensif telah mengungkapkan bahwa pencampuran Li + /Ni2 + yang diamati pada katode berlapis nikel tinggi terutama berasal dari dua faktor. [ 7 ] Dalam struktur kristal R-3m, Li + dan Ni2 + mengalami lingkungan kimia yang sangat mirip; kedua ion berada dalam oktahedra oksigen yang berbagi tepi dengan oktahedra yang berdekatan. [ 8 ] Mengingat jari-jari ionik Li + yang dekat (≈0,76 Å) dan Ni2 + (≈0,69 Å), ada kecenderungan lebih tinggi untuk pertukaran situs, yang mengarah pada pembentukan cacat antisitus Li + /Ni2 + . [ 8 , 9 ] Sampel dengan tingkat pencampuran Li + /Ni2 + yang tinggi rentan terhadap difusi ion yang terhalang dan peningkatan reaksi antarmuka, yang pada akhirnya mengurangi kinerja laju dan siklus hidup baterai. [ 9 ] Lebih jauh lagi, penelitian telah menunjukkan bahwa bahan NCM dengan pencampuran kation tinggi biasanya menunjukkan kristalinitas yang lebih rendah dan luas permukaan spesifik yang berkurang, yang keduanya menghambat transportasi Li + dan mengurangi koefisien difusi litium. [ 10 ] Namun, perlu dicatat bahwa efek pencampuran Li + /Ni 2+ tidak sepenuhnya merugikan. Memperkenalkan sejumlah kecil Li + nonmagnetik ke dalam lapisan logam transisi (TM) dapat mengurangi interaksi magnetik kompetitif antara situs yang berdekatan, sehingga menurunkan energi bebas sistem dan secara termodinamika mendukung pembentukan dan stabilisasi struktur berlapis. [ 8 , 11 ] Dengan kata lain, pencampuran kation yang terkontrol dapat berkontribusi untuk membangun struktur kristal berlapis yang lebih stabil dan pada akhirnya menguntungkan stabilitas keseluruhan bahan katode. [ 9 ]
Untuk mengatasi tantangan ini, berbagai strategi doping unsur telah dieksplorasi, [ 12 , 13 ] termasuk penggabungan Mg 2+ , [ 14 ] Al 3+ , [ 15 ] Zr 4+ , [ 16 ] Nb 5 , + [ 17 ] Mo 5+ , [ 18 ] dan W 6+ . [ 19 ] Penelitian menunjukkan bahwa doping Al 3+ dapat mengurangi masuknya Ni ke dalam lapisan Li dan meningkatkan difusi Li + . [ 20 ] Ikatan Al O, yang dicirikan oleh panjang ikatannya yang pendek dan energi ikatan yang tinggi, secara signifikan menekan degradasi struktural yang disebabkan oleh fase kelelahan selama siklus tegangan tinggi pada katoda berlapis nikel tinggi. [ 21 ] Penelitian menunjukkan bahwa doping Al 3+ dapat mengurangi masuknya Ni ke dalam lapisan Li dan meningkatkan difusi Li + . [ 15 , 22 ] Meskipun demikian, pengenalan Al 3+ sering menyebabkan pertumbuhan partikel primer, yang dapat membahayakan kekuatan mekanis keseluruhan material dan meningkatkan kerentanannya terhadap retakan mikro atau fraktur antar partikel. [ 23 ] Doping Nb 5+ , bahkan pada tingkat rendah (0,5–1 mol%), cenderung terpisah di sepanjang batas butir selama kalsinasi, membentuk senyawa Li Nb O. Distribusi terlokalisasi ini secara efektif menghambat pertumbuhan partikel primer, mempertahankannya pada ukuran kecil dan seragam. [ 24 ] Selain itu, sebagai ion valensi tinggi, Nb 5+ menyumbangkan elektron ekstra ke atom oksigen tetangga untuk membentuk ikatan Nb O yang lebih kuat, [ 25 ] dengan demikian meningkatkan stabilitas termal. [ 26 ] Namun, kalsinasi suhu tinggi dapat menyebabkan sebagian Nb 5+ memasuki kisi NMC811 dengan menempati situs TM—suatu proses yang mungkin disertai dengan pengurangan keadaan oksidasi lokal Ni (dari Ni 3+ menjadi Ni 2+ ). [ 17 , 27 ]Hal ini pada gilirannya memfasilitasi migrasi Ni ke dalam lapisan Li, meningkatkan derajat pencampuran Li + /Ni 2+ . Pencampuran kation yang berlebihan berdampak negatif pada efisiensi coulombik awal dan kinerja siklus material. [ 5 ]
Singkatnya, sementara penggunaan dopan Nb5 + dan Al3 + secara individual memiliki keterbatasan dalam memodifikasi bahan katode nikel tinggi, pekerjaan ini menggunakan strategi codoping menggunakan Nb5 + dan Al3 + . Kami secara sistematis menjelaskan efek sinergis dari dopan ini dalam mengatur pencampuran kation Li/Ni dan memediasi evolusi mikrostruktur bahan Li[Ni0,83Co0,12Mn0,05 ] O2 ( NCM83 ) . Hasil eksperimen kami mengungkapkan bahwa meskipun doping Nb5 + sendiri secara efektif memperbaiki ukuran partikel primer, ia juga cenderung memperburuk pencampuran kation, sehingga mengorbankan stabilitas struktural. Sebaliknya, doping Al3 + menekan peningkatan pencampuran yang disebabkan oleh Nb5 + , mempertahankan pencampuran Li/Ni secara keseluruhan pada tingkat yang lebih optimal. Strategi codoping tidak hanya mengoptimalkan ukuran dan distribusi partikel primer dan secara signifikan meningkatkan kepadatan partikel sekunder, tetapi juga secara efektif mengurangi polarisasi elektroda selama siklus yang berkepanjangan. Pada akhirnya, pendekatan sinergis ini meningkatkan stabilitas siklus material, mencapai keseimbangan yang lebih baik antara kapasitas awal dan kinerja jangka panjang.
2 Hasil dan Pembahasan
2.1 SEM/EDS
Mikroskopi elektron pemindaian emisi medan (FESEM) digunakan untuk mengkarakterisasi morfologi permukaan sampel NCM-Bare, NCM-Al, NCM-Nb, dan NCM-Nb/Al, seperti yang ditunjukkan pada Gambar 1 a–d . Keempat bahan yang disintesis melalui metode keadaan padat suhu tinggi tersusun dari partikel primer dengan morfologi seperti balok yang sangat kecil yang beragregasi menjadi partikel bulat sekunder dengan diameter rata-rata ≈8 μm. Baik NCM-Bare maupun NCM-Al menunjukkan morfologi dan ukuran partikel primer dan sekunder yang hampir identik, yang menunjukkan bahwa doping Al tidak mengubah morfologi permukaan bahan NCM. Sebaliknya, NCM-Nb dan NCM-Nb/Al menunjukkan tingkat kebulatan yang lebih tinggi serta peningkatan jumlah dan pengurangan ukuran partikel primer. Penyempurnaan ini disebabkan oleh doping Nb 5+ , yang menurunkan energi permukaan kristal selama kalsinasi. Pengurangan energi permukaan menurunkan penghalang nukleasi, yang mengarah pada pembentukan inti kristal yang lebih kecil yang kemudian tumbuh menjadi partikel yang lebih halus. Pengurangan ukuran partikel primer yang dihasilkan meningkatkan kepadatan struktural secara keseluruhan, yang pada gilirannya membantu mengurangi keretakan dan fraktur antara partikel primer—fenomena yang biasanya disebabkan oleh tekanan anisotropik selama siklus. Konfigurasi struktural ini berpotensi menyediakan jalur transportasi Li + tambahan. [ 26 ]

Gambar 1
Buka di penampil gambar
Kekuatan Gambar
a–d) Gambar SEM dari NCM-Bare, NCM-Al, NCM-Nb, dan NCM-Nb/Al; e–e6) Morfologi SEM dan peta EDS yang sesuai dari sampel NCM-Nb/Al; f–f5) Gambar SEM penampang melintang dan pemetaan unsur EDS dari sampel NCM-Nb/Al.
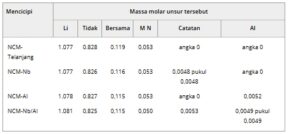
Analisis distribusi unsur melalui spektroskopi sinar-X dispersif energi (EDS) dilakukan pada partikel NCM-Nb/Al (Gambar 1e–e6 ). Pemetaan EDS menunjukkan bahwa Ni, O, Co, Mn, Nb, dan Al terdistribusi secara seragam pada permukaan partikel. Gambar 1f–f5 menunjukkan gambar SEM penampang melintang dan pemetaan unsur EDS dari sampel NCM-Nb/Al. Partikel sekunder mempertahankan morfologi bulat utuh setelah pemolesan penampang melintang, dengan partikel primer terikat erat satu sama lain dan tidak ada retakan atau rongga yang terlihat pada batas butir. Pemetaan unsur EDS mengungkapkan bahwa Nb dan Al menunjukkan distribusi seragam baik pada permukaan maupun dalam wilayah internal partikel, tanpa terdeteksi pengayaan terlokalisasi. Dikombinasikan dengan hasil plasma kopling induktif (ICP) pada Tabel 1 , ini menegaskan bahwa Nb dan Al berhasil dan homogen dimasukkan ke dalam kisi dalam rasio yang dimaksudkan melalui sintesis keadaan padat suhu tinggi.
Tabel 1. Rasio mol unsur keempat bahan ditentukan berdasarkan analisis ICP.
2.2 XRD/XPS
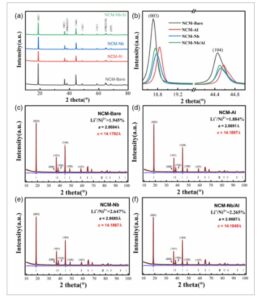
Difraksi sinar-X (XRD) digunakan untuk menyelidiki efek doping Nb dan Al pada struktur kristal bahan katode NCM. Gambar 2 menyajikan pola XRD dari NCM-Bare, NCM-Al, NCM-Nb, dan NCM-Nb/Al. Seperti yang ditunjukkan pada Gambar 2a , semua sampel yang didoping menunjukkan puncak difraksi yang homolog dengan bahan murni, tanpa terdeteksi fase pengotor yang mengandung Nb atau Al. Struktur kristal sesuai dengan struktur heksagonal berlapis tipe α-NaFeO2 dengan grup ruang R-3m. Pemisahan puncak (006)/(102) dan (108)/(110) menunjukkan struktur berlapis yang berkembang dengan baik, dan rasio intensitas puncak (003) hingga (104) berkorelasi dengan derajat pencampuran kation Li/Ni. Penyempurnaan Rietveld dilakukan untuk memeriksa perubahan parameter kisi, seperti yang dirangkum dalam Tabel 2. Kesalahan penyempurnaan (R wp ) semuanya di bawah 6%, yang membuktikan keandalan parameter struktural yang diperoleh.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
a) Pola XRD dari bahan katode NCM-Bare, NCM-Al, NCM-Nb, dan NCM-Nb/Al. b) Tampilan diperbesar dari puncak difraksi (003) dan (104) untuk keempat bahan; sisipan: Pola XRD yang disempurnakan Rietveld dari sampel LNCM: c) NCM-Bare; d) NCM-Al; e) NCM-Nb; dan f) NCM-Nb/Al.
Tabel 2. Perbandingan parameter struktural keempat bahan yang diperoleh dari penyempurnaan Rietveld.

Rasio c/a untuk keempat material adalah ≈4,94, yang menunjukkan struktur berlapis yang tertata dengan baik. Rasio I (003/104) melebihi 1,2, yang mengonfirmasi rendahnya derajat pencampuran kation dalam material NCM. Peningkatan parameter c untuk NCM-Al, NCM-Nb, dan NCM-Nb/Al menunjukkan keberhasilan penggabungan kisi Nb dan Al; ekspansi sepanjang sumbu-c memfasilitasi difusi Li + , sehingga meningkatkan kemampuan laju. Secara khusus, NCM-Al menunjukkan ketidakteraturan Li + /Ni2 + terendah (1,884%) karena ikatan Al O lebih kuat daripada ikatan Ni O, dengan tumpang tindih orbital Al(s) O(p) yang signifikan membentuk ikatan ionik/kovalen yang kuat. Selain itu, elektronegativitas Al3 + yang lebih rendah dibandingkan dengan Ni3 + meningkatkan kekuatan ikatan ikatan TM O, yang menekan pencampuran kation yang tidak diinginkan. Jari-jari ionik Al3 + (r = 53,5 pm, bilangan koordinasi CN = 6) mendekati jari-jari Ni2 + (r = 69,0 pm, CN = 6). Oktahedra AlO6 yang terbentuk selama doping tidak menyebabkan distorsi kisi yang signifikan. [ 28 ] Orbital 3s dan 3p dari Al3 + dapat berhibridisasi dengan orbital d dari Ni2 + , membentuk struktur oktahedral AlO6 yang terkoordinasi dengan oksigen kisi. [ 29 ] Hal ini mendukung peran penting pencocokan jari-jari antara Al3 + dan Ni2 + dalam menstabilkan struktur berlapis. Sebaliknya, NCM-Nb menampilkan ketidakteraturan tertinggi (2,647%), karena pengenalan Nb5 + valensi tinggi meningkatkan muatan positif dalam kisi, yang mendorong konversi sebagian Ni3 + menjadi Ni2 + untuk mempertahankan keseimbangan muatan. Nb 5+ (jari-jari ionik 0,64 Å) didoping ke dalam situs logam transisi (TM); keadaan valensinya yang tinggi dapat menggantikan sebagian Ni 3+ dan menginduksi reduksi beberapa Ni 3+ menjadi Ni 2+ melalui mekanisme kompensasi muatan. [ 30 ] Peningkatan Ni 2+ ini mendukung migrasinya ke dalam lapisan Li, sehingga mengintensifkan pencampuran kation. Sementara ketidakteraturan Li/Ni yang berlebihan mengurangi konsentrasi kekosongan Li—menghambat difusi Li + dan menyebabkan hilangnya kapasitas ireversibel siklus pertama—pencampuran kation sedang dapat menciptakan lapisan intermixing Li/Ni yang seragam yang mencegah keruntuhan antara lapisan Li, menekan reaksi samping dan transformasi fase yang berbahaya, dan bahkan menurunkan energi aktivasi difusi untuk meningkatkan Li+ mobilitas dan kinerja laju. Gangguan Li/Ni pada NCM-Nb/Al (2,265%) berada di antara gangguan NCM-Bare dan NCM-Nb, yang menunjukkan bahwa doping Al 3+ sebagian menangkal peningkatan gangguan kation yang disebabkan oleh Nb 5+ , sehingga mempertahankan keseimbangan optimal dan meningkatkan kinerja elektrokimia.
Spektroskopi fotoelektron sinar-X (XPS) dilakukan untuk memahami dampak kodoping Nb 5+ /Al 3+ pada bilangan oksidasi logam transisi. Dalam data tambahan, dua puncak pada energi pengikatan 206,5 dan 209,3 eV masing-masing berkorespondensi dengan puncak Nb 3d 5/2 dan Nb 3d 3/2 , sementara puncak Al 2p teramati pada sekitar 68,3 eV. Temuan ini mengonfirmasi bahwa Nb dan Al telah berhasil dimasukkan ke dalam material katode NCM melalui sintesis keadaan padat suhu tinggi. Setelah mengkalibrasi puncak C 1s ke energi pengikatan standar 284,8 eV, dekonvolusi puncak dilakukan pada spektrum XPS dari sampel yang tidak didoping dan didoping ( Gambar 3 ). Pada Gambar 3a , puncak Ni 2p 3/2 muncul pada 855,2 eV, dengan puncak komponen untuk Ni 2+ dan Ni 3+ masing-masing terletak pada 854,9 dan 856,6 eV. Jelas bahwa rasio Ni 2+ /Ni 3+ lebih tinggi di NCM-Nb/Al dibandingkan dengan NCM-Bare, yang dikaitkan dengan doping Nb 5+ yang mereduksi sebagian Ni 3+ menjadi Ni 2+ untuk mempertahankan keseimbangan muatan. Hasil ini konsisten dengan temuan XRD kami. Pada Gambar 3b , puncak pada 528,65 dan 531,75 eV masing-masing berhubungan dengan oksigen kisi (O_lattice) dan oksigen yang teradsorpsi permukaan (O_absorption)—yang terakhir berasal dari spesies seperti LiOH, Li 2 CO 3 , dan LiHCO 3 . Proporsi oksigen kisi dalam NCM-Nb/Al (7,82%) lebih tinggi dibandingkan dengan NCM-Bare (10,84%), yang mungkin disebabkan oleh energi ikatan yang lebih kuat dari ikatan Nb O dan Al O dibandingkan dengan ikatan Ni O. Hal ini memperlambat pembentukan fase parasit seperti Li 2 CO 3 , sehingga meningkatkan fraksi oksigen kisi pada permukaan material dan berkontribusi pada stabilitas struktural yang lebih baik serta peningkatan kinerja siklus.

Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Spektrum XPS NCM-Bare dan NCM-Nb/Al: a) Ni 2p dan b) O 2p.
2.3 TEKNOLOGI
Mikroskop elektron transmisi resolusi tinggi (HRTEM) digunakan untuk memeriksa struktur mikro permukaan NCM-Bare dan NCM-Nb/Al ( Gambar 4 a,b ). Kedua sampel menunjukkan pinggiran kisi yang jelas dan searah di permukaan dan di bagian dalam, yang menunjukkan kristalinitas yang sangat baik dan mengonfirmasi keberadaan fase berlapis R-3m yang tertata dengan baik. Titik-titik terang dalam gambar Fast Fourier Transform (FFT) dapat diindeks ke bidang kristalografi (003) dari struktur NCM. Khususnya, NCM-Nb/Al menampilkan pinggiran kisi yang sangat tertata dengan jarak 0,492 nm yang sesuai dengan bidang (003). Perluasan jarak kisi yang diamati dari 0,476 nm di NCM-Bare menjadi 0,492 nm di NCM-Nb/Al merupakan konsekuensi langsung dari pembesaran parameter kisi sumbu-c yang disebabkan oleh kodoping Nb 5+ /Al 3+ . Peningkatan jarak lapisan Li mendorong difusi Li + , sehingga meningkatkan kinerja laju, seperti yang kemudian dikonfirmasi oleh pengukuran GITT dan kemampuan laju kami.

Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Gambar HRTEM dari a) NCM-Bare dan b) NCM-Nb/Al.
2.4 Analisis Elektrokimia
2.4.1 Pengujian Kinerja Kecepatan dan Stabilitas Bersepeda
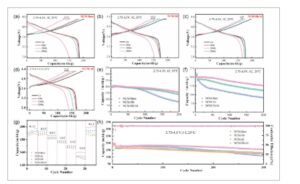
Untuk menyelidiki efek doping Nb5 + dan Al3 + pada struktur berlapis katode, setengah sel tipe koin dirakit menggunakan logam litium sebagai elektroda lawan dan dikenakan pengujian kinerja elektrokimia. Gambar 5 a–d menyajikan profil tegangan-kapasitas pengisian/pengosongan NCM-Bare, NCM-Nb, NCM-Al, dan NCM-Nb/Al pada nomor siklus yang berbeda di bawah laju 1 C (2,75–4,3 V vs. Li/Li + , 1 C = 180 mAh g −1 ). Katode NCM-Bare menunjukkan kapasitas spesifik pelepasan awal yang lebih tinggi dibandingkan dengan bahan yang didoping. Hal ini disebabkan oleh doping Nb5 + yang meningkatkan derajat pencampuran kation Li + /Ni2 + , di mana migrasi Ni ke dalam lapisan Li mengurangi konsentrasi kekosongan Li dan membatasi interkalasi Li + , yang mengakibatkan hilangnya kapasitas ireversibel selama siklus pertama. Setengah sel diuji menggunakan protokol arus-konstan/tegangan-konstan (CC/CV) untuk mempelajari efek polarisasi pada bahan katode. Proses pengisian daya menggunakan pendekatan gabungan CC/CV, dengan efek polarisasi yang terwujud sebagai plateau pada Gambar 5. Daerah plateau yang diamati pada akhir kurva pengisian daya pada Gambar 5a–d berasal dari pengisian daya tegangan-konstan yang mengompensasi kehilangan kapasitas yang disebabkan oleh polarisasi yang disebabkan oleh kelebihan potensial. Setelah 200 siklus, kapasitas spesifik plateau dari NCM-Bare, NCM-Nb, dan NCM-Al meningkat masing-masing sebesar 22,03, 13,16, dan 14,43 mAh g −1 , yang menunjukkan polarisasi signifikan karena kelebihan potensial. Doping tunggal dengan Nb atau Al secara parsial menekan efek polarisasi ini. Khususnya, NCM-Nb/Al hanya menunjukkan peningkatan kapasitas plateau sebesar 6,83 mAh g −1 , yang hanya mencakup 4,07% dari total kapasitas pengisian daya, yang menunjukkan bahwa kodoping Nb/Al secara sinergis menghambat polarisasi elektroda selama siklus yang diperpanjang.
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Kinerja elektrokimia NCM-Bare, NCM-Nb, NCM-Al, dan NCM-Nb/Al: a) Profil pengisian/pengosongan NCM-Bare, b) NCM-Nb, c) NCM-Al, dan d) NCM-Nb/Al pada berbagai siklus dengan laju 1 C. e) Perbandingan kinerja siklus suhu tinggi (55 °C) pada suhu 1 C antara 2,75 dan 4,3 V. f) Perbandingan kinerja siklus tegangan tinggi (4,5 V) pada suhu 1 C dan 25 °C antara 2,75 dan 4,5 V. g) Perbandingan kemampuan laju (0,1–5 C). h) Perbandingan kinerja siklus suhu ruangan (25 °C) pada suhu 1 C antara 2,75 dan 4,3 V.
Kami kemudian mengevaluasi stabilitas siklus sampel pada laju 1 C pada 2,75–4,3 V dan 25 °C setelah lima siklus aktivasi pada 0,1 C, seperti yang ditunjukkan pada Gambar 5h . Setelah 200 siklus, laju retensi kapasitas NCM-Bare, NCM-Nb, NCM-Al, dan NCM-Nb/Al masing-masing adalah 80,60, 89,60, 83,20, dan 95,93%. Hebatnya, NCM-Nb/Al mempertahankan retensi kapasitas 86,88% setelah 300 siklus.
Bahan yang didoping juga menunjukkan kinerja suhu tinggi yang unggul (Gambar 5e ). Ketika diuji pada suhu 55 °C (1 C, 2,75–4,3 V), NCM-Nb/Al menghasilkan kapasitas pelepasan maksimum 200,8 mAh g −1 dengan retensi 77,14% setelah 200 siklus—jauh lebih tinggi daripada NCM-Bare (38,38%) dan NCM-Nb (68,27%). Untuk memeriksa kinerja elektrokimia di bawah tegangan batas tinggi, pengujian dilakukan pada 2,75–4,5 V (1 C, 25 °C). Seperti yang ditunjukkan pada Gambar 5f , setelah lima siklus aktivasi 0,1 C, NCM-Nb/Al mencapai kapasitas pelepasan awal sebesar 198,0 mAh g −1 pada 1 C dengan retensi 75,40% setelah 200 siklus, mengungguli NCM-Bare (44,22%) dan NCM-Nb (66,31%) dalam kondisi tegangan tinggi. Khususnya, NCM-Nb menunjukkan kinerja siklus yang lebih baik daripada NCM-Bare dalam semua kondisi pengujian karena ikatan Nb O yang kuat meningkatkan stabilitas struktural dan mencegah keruntuhan kisi, sementara struktur partikel sekunder yang padat membantu mempertahankan integritas berlapis selama siklus. Kinerja NCM-Nb/Al yang lebih unggul daripada NCM-Nb muncul dari dua faktor: doping Al 3+ mengurangi derajat gangguan kation yang ditingkatkan oleh doping Nb 5+ , dengan pencampuran Li + /Ni 2+ yang optimal mencegah distorsi makroskopis dan menstabilkan kisi; Penggabungan Al 3+ mengurangi pertumbuhan polarisasi dan akumulasi tegangan lokal selama siklus jangka panjang, sehingga menghambat kerusakan kinetika elektrokimia.
Kemampuan laju dievaluasi pada berbagai laju C (0,1–5 C) seperti yang ditunjukkan pada Gambar 5g . Baik NCM-Nb maupun NCM-Al menunjukkan peningkatan kinerja laju tinggi (154,1 dan 152,6 mAh g −1 pada suhu 5 C, berturut-turut) dibandingkan dengan NCM-Bare (151,1 mAh g −1 pada suhu 5 C). Peningkatan ini berasal dari: doping Nb mengurangi ukuran partikel primer dan menciptakan lebih banyak saluran difusi Li + (konsisten dengan pengamatan SEM pada Gambar 1 ), sementara ikatan Nb O yang kuat memperluas jarak lapisan Li; doping Al 3+ membantu mengurangi polarisasi pada laju tinggi dan menstabilkan struktur kristal material dengan mengatur pencampuran kation untuk menekan transisi fase struktural dan reaksi samping antarmuka. NCM-Nb/Al mencapai kapasitas pelepasan 160,1 mAh g −1 pada 5 C, yang menunjukkan peningkatan signifikan dalam kinerja laju tinggi dibandingkan dengan NCM-Nb dan NCM-Al. NCM-Nb/Al menunjukkan kinerja laju terbaik, yang dikaitkan dengan efek sinergis dari Nb/Al codoping dalam menstabilkan struktur berlapis dan meningkatkan kinetika difusi Li + , sebagaimana dikonfirmasi oleh uji GITT dan EIS yang menunjukkan koefisien difusi litium ( D ) yang lebih tinggi dan resistansi transfer muatan yang lebih rendah. Pemudaran kapasitas pada laju tinggi terutama disebabkan oleh peningkatan polarisasi di bawah kerapatan arus yang lebih tinggi yang menyebabkan interkalasi Li + tidak lengkap .
2.4.2 Pengujian Kinerja Kecepatan dan Stabilitas Bersepeda
2.4.2.1 dQ/dV dan SEM sebelum dan sesudah Cycling
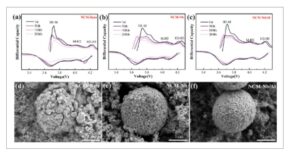
Transformasi fase merugikan H2 → H3 merupakan penyebab utama pemudaran kapasitas pada material katode. Seperti yang ditunjukkan pada Gambar 6 a–c , selama deinterkalasi Li + , ketiga sampel mengalami transisi fase berturut-turut dari fase heksagonal 1 (H1) ke monoklinik (M) ke fase heksagonal 2 (H2) dan akhirnya ke fase heksagonal 3 (H3). Transisi H2 → H3 yang merugikan, yang biasanya terjadi di dekat 4,20 V, disertai dengan kontraksi kisi sumbu-c yang merugikan yang menginduksi retak intergranular dan secara bertahap mengganggu kestabilan struktur. Dalam NCM-Bare, puncak H2 → H3 bergeser secara signifikan. Sebaliknya, NCM-Nb menunjukkan tumpang tindih puncak yang lebih baik, yang menunjukkan bahwa doping Nb secara efektif menekan keruntuhan kisi yang parah dan degradasi struktural selama siklus, sehingga mempertahankan arsitektur berlapis. Selain itu, NCM-Nb/Al menunjukkan tumpang tindih yang lebih baik dalam kurva dQ/dV setelah siklus jangka panjang, yang menunjukkan bahwa doping Al 3+ lebih lanjut menekan transisi H2 → H3 yang berbahaya dengan mengurangi distorsi kisi dan kontraksi volume, sekaligus mengurangi pembentukan retakan mikro. Secara keseluruhan, strategi doping gabungan menstabilkan gangguan Li + /Ni 2+ pada tingkat optimal, dan ikatan Nb O dan Al O yang lebih kuat mempertahankan struktur berlapis yang stabil. Akibatnya, kodoping Nb 5+ /Al 3+ secara signifikan meningkatkan kinerja laju dan stabilitas siklus material.
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
a–c) kurva dQ/dV dari NCM-Bare, NCM-Nb, dan NCM-Nb/Al yang direkam selama siklus ke-1, ke-50, ke-100, dan ke-200; d) gambar SEM dari NCM-Bare; e) gambar SEM dari NCM-Nb; dan f) gambar SEM dari NCM-Nb/Al setelah 200 siklus.
Setelah 200 siklus pada 1 C, 4,3 V, dan 25 °C, setengah sel dibongkar untuk analisis SEM. Gambar 6d menunjukkan bahwa NCM-Bare menunjukkan retakan mikro yang jelas dan fragmentasi partikel primer setelah 200 siklus. Selama siklus, khususnya pada tegangan di atas 4,2 V, transisi fase H2 → H3 menginduksi perubahan volume anisotropik yang menghasilkan tekanan dan regangan mekanis pada batas partikel, yang mengarah pada pembentukan retakan mikro. Masuknya elektrolit melalui retakan ini mempercepat reaksi samping, membentuk lapisan antarmuka seperti NiO garam batu yang meningkatkan resistansi dan polarisasi antarmuka. Partikel primer yang terlepas menjadi tidak aktif secara elektrokimia, sehingga dengan cepat menurunkan kinerja sel. Retakan mikro yang parah dan fragmentasi partikel di NCM-Bare kemungkinan merupakan penyebab kapasitas pelepasan yang relatif rendah sebesar 151,2 mAh g −1 dan retensi kapasitas 80,99% setelah 200 siklus. Pada Gambar 6e , NCM-Nb hanya menampilkan retakan mikro kecil di sepanjang batas butir setelah 200 siklus, tanpa bukti terlepasnya partikel primer. Hal ini disebabkan oleh pengurangan ukuran partikel primer dan peningkatan densitas partikel sekunder, serta ikatan Nb O yang lebih kuat yang secara efektif menekan transformasi fase yang berbahaya dan mempertahankan integritas lapisan. Pada Gambar 6f , NCM-Nb/Al tidak menunjukkan retakan mikro yang signifikan setelah 200 siklus, dan struktur partikel sekundernya tetap utuh. Pengamatan ini berkorelasi dengan transisi fase H2 → H3 yang ditekan dalam NCM-Nb/Al (seperti yang terlihat pada Gambar 6c ). Kehadiran Al 3+ mengurangi regangan volume selama siklus dan mengurangi reaksi samping dengan elektrolit, sehingga meningkatkan stabilitas mekanis dan kimia material. Singkatnya, efek sinergis dari doping Nb 5+ dan Al 3+ , dengan mengatur gangguan Li + / Ni 2+ , menstabilkan struktur kisi, menekan reaksi samping dengan elektrolit asam, mencegah penetrasi elektrolit, dan menjaga integritas struktur berlapis.
2.5 GITT/EIS
GITT (teknik titrasi intermiten galvanostatik) digunakan untuk mempelajari parameter seperti kerapatan arus pertukaran dan koefisien difusi Li + . Hasil untuk ketiga material ditunjukkan pada Gambar 7. Koefisien difusi Li + ( D ) untuk NCM-Bare, NCM-Nb, dan NCM-Nb/Al berada dalam kisaran 10 −9 –10 −11 cm 2 s −1 . Perhitungan DFT prinsip pertama menunjukkan bahwa doping Nb dan Al secara efektif memfasilitasi kinetika transpor ion litium. [ 31 , 32 ] Khususnya, NCM-Nb/Al menunjukkan koefisien difusi Li + yang lebih tinggi , yang dapat dikorelasikan dengan peningkatan jarak antarlapisan dan struktur berlapis yang stabil yang dicapai melalui kodoping. Saat nilai D meningkat, transpor Li + kurang terhambat—mendorong interkalasi/deinterkalasi Li + —dan dengan demikian meningkatkan kinerja laju dan stabilitas struktural jangka panjang. Pada Gambar 7d , setelah 200 siklus, NCM-Bare menunjukkan fluktuasi penting dalam D pada titik transisi fase tegangan tinggi, sedangkan NCM-Nb/Al mempertahankan D yang lebih tinggi dan lebih stabil , yang mencerminkan bahwa kodoping Nb 5+ /Al 3+ menstabilkan struktur kisi dan mengurangi polarisasi dan transisi fase selama siklus yang berkepanjangan.
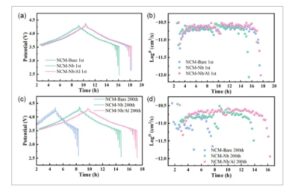
Gambar 7
Buka di penampil gambar
Kekuatan Gambar
Hasil GITT untuk NCM-Bare, NCM-Nb, dan NCM-Nb/Al pada 1 C: a) Kurva GITT setelah 1 minggu siklus; c) Kurva GITT setelah 200 minggu; b) Log D versus waktu setelah satu siklus; dan d) Log D versus waktu setelah 200 siklus.
Spektroskopi impedansi elektrokimia (EIS) dilakukan pada setengah sel yang dirakit dengan NCM-Bare, NCM-Nb, dan NCM-Nb/Al setelah 1 dan 200 minggu siklus. Plot Nyquist, yang dipasang menggunakan perangkat lunak ZView bersama dengan model rangkaian ekivalen, ditampilkan dalam Gambar 8. Spektrum EIS biasanya terdiri dari tiga setengah lingkaran. Setengah lingkaran frekuensi tinggi dan menengah sesuai dengan resistansi lapisan permukaan (R sf ) pada elektrode negatif litium dan elektrode positif NCM pada antarmuka elektrode-elektrolit, sedangkan setengah lingkaran frekuensi rendah mencerminkan resistansi transfer muatan (R ct ) dan impedansi Warburg (W o ) dari elektrode positif. Setelah 1 minggu siklus, ketiga sel menunjukkan nilai R sf dan R ct yang relatif rendah . Setelah 200 minggu, semua sel menunjukkan peningkatan ukuran setengah lingkaran, yang menunjukkan resistansi keseluruhan yang lebih tinggi. Namun, NCM-Bare menunjukkan peningkatan dramatis baik dalam R sf dan R ct , yang menunjukkan bahwa ia telah mengalami reaksi samping yang parah dan transisi fase setelah siklus yang diperpanjang. Doping Nb sebagian mengurangi degradasi struktural dan reaksi samping, sehingga mengurangi peningkatan dalam R sf dan R ct . Selain itu, NCM-Nb/Al menunjukkan karakteristik impedansi yang lebih stabil daripada NCM-Nb terutama karena efek regulasi Al 3+ pada gangguan kation, yang menstabilkan kisi dan mengurangi polarisasi elektroda selama siklus. Temuan ini konsisten dengan hasil XRD (Gambar 2 ) dan GITT (Gambar 7 ).
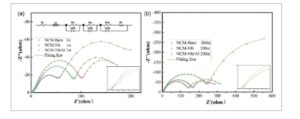
Gambar 8
Buka di penampil gambar
Kekuatan Gambar
Spektrum EIS dari tiga bahan setelah siklus: a) setelah satu siklus dan b) setelah 200 siklus.
HRTEM memungkinkan analisis evolusi struktur fase dalam sampel selama siklus. Karakterisasi mikroskop elektron transmisi (TEM) dilakukan pada NCM-Bare dan NCM-Nb/Al setelah 300 siklus pada 1 C, 4,3 V, dan 25 °C, dengan hasil yang ditunjukkan pada Gambar 9 a,b . Kedua material menunjukkan struktur fase garam batu (NiO) pada permukaannya, tetapi dengan perbedaan ketebalan yang signifikan. Pembentukan fase garam batu terutama berasal dari infiltrasi elektrolit melalui retakan partikel selama siklus, yang memicu pelarutan Ni 2 + dan hilangnya oksigen kisi, yang menyebabkan gangguan kation yang diperburuk. Fase isolasi ini secara signifikan meningkatkan impedansi antarmuka dan polarisasi, sehingga mempercepat peluruhan kapasitas. Pengamatan TEM mengungkapkan bahwa fase garam batu pada permukaan NCM-Bare mencapai ketebalan 7,778 nm (Gambar 9a ), dengan analisis FFT-nya menunjukkan wilayah II yang sesuai dengan fase garam batu (jarak bidang 003: 0,235 nm), sementara struktur berlapis massal (wilayah I, jarak bidang 003: 0,507 nm) tetap ada. Sebaliknya, NCM-Nb/Al menampilkan fase garam batu yang lebih tipis hanya 6,223 nm (Gambar 9b ), dengan struktur berlapis massal (jarak bidang 003: 0,494 nm) mempertahankan tatanan struktural yang tinggi. Al3 + menekan pencampuran kation Li/Ni, sehingga menghambat distorsi kisi dan perambatan retak untuk mengurangi infiltrasi elektrolit. Nb5 + membatasi pertumbuhan partikel primer untuk meningkatkan kepadatan partikel sekunder. Efek sinergisnya secara signifikan menghambat pertumbuhan fase garam batu.

Gambar 9
Buka di penampil gambar
Kekuatan Gambar
Citra HR-TEM dari a) NCM-Bare dan b) NCM-Nb/Al diperoleh sepanjang sumbu zona (003). Citra FFT/FFT terbalik dari (I) lapisan dan (II) garam batu pada area terpilih.
Gambar 10 secara skematis menggambarkan situs doping aktif dan mekanisme kegagalan yang terkait dengan codoping Nb/Al. Nb 5+ cenderung mengurangi ukuran partikel primer tetapi dapat meningkatkan pencampuran kation dalam lapisan Li/Ni ketika digunakan sendiri, sedangkan Al 3+ , dengan radius yang lebih kecil dan valensi yang lebih rendah, menekan peningkatan ketidakteraturan ini. Bersama-sama, mereka mempertahankan tingkat optimal pencampuran Li + /Ni 2+ dan secara signifikan mengurangi polarisasi elektroda selama pengisian-pengosongan, dengan demikian memastikan stabilitas keseluruhan struktur berlapis. Akibatnya, codoping sinergis Nb 5+ dan Al 3+ secara nyata meningkatkan kinerja laju dan stabilitas siklus material dengan menekan pembentukan retakan mikro karena konsentrasi tegangan selama siklus.
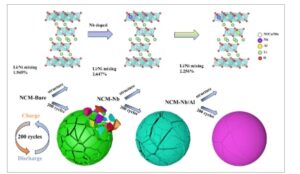
Gambar 10
Buka di penampil gambar
Kekuatan Gambar
Ilustrasi skema lokasi doping dan mekanisme kegagalan yang berkaitan dengan kodoping Nb/Al.
3 Kesimpulan
Pekerjaan ini secara sistematis mengeksplorasi efek Nb 5+ dan Al 3+ codoping pada struktur dan kinerja elektrokimia bahan katode nikel tinggi, secara efektif mengurangi banyak tantangan yang melekat pada sistem ini. Hasil eksperimen mengungkapkan bahwa sementara doping Nb 5+ sendiri menyempurnakan ukuran partikel primer dan meningkatkan distribusi rongga antar-partikel—dengan demikian mendorong struktur partikel sekunder padat yang mempertahankan arsitektur berlapis selama siklus berulang—ikatan Nb O yang kuat meningkatkan stabilitas struktural dan membantu mencegah keruntuhan kisi. Namun, doping Nb 5+ juga meningkatkan derajat pencampuran kation Li/Ni dari 1,884% awal menjadi 2,647%, yang berdampak buruk pada efisiensi Coulombik siklus pertama dan kepadatan energi. Sebagai perbandingan, penggabungan Al 3+ secara efektif mengurangi peningkatan yang disebabkan Nb 5+ dalam pencampuran kation, mempertahankan keseluruhan ketidakteraturan Li/Ni pada tingkat optimal 2,265%. Efek sinergis dari kedua dopan tidak hanya mengoptimalkan struktur mikro—yang menghasilkan kapasitas pelepasan awal yang lebih tinggi—tetapi juga secara signifikan mengurangi polarisasi elektroda selama siklus jangka panjang, sehingga meningkatkan kemampuan siklus baterai. Bahkan dalam kondisi ekstrem suhu tinggi dan tegangan tinggi, retensi kapasitas meningkat secara nyata. Singkatnya, strategi kodoping Nb 5+ /Al 3+ menawarkan pendekatan yang efektif untuk merancang material katode nikel tinggi berkinerja tinggi, meletakkan landasan teoritis dan praktis untuk menyeimbangkan kapasitas awal dengan siklus hidup jangka panjang, dan memberikan wawasan baru untuk lebih meningkatkan kinerja dan keamanan LIB secara keseluruhan.
4 Bagian Eksperimen
Persiapan Material Katoda
Prekursor Ni 0,83 Co 0,12 Mn 0,05 (OH) 2 diperoleh dari Ronbay New Energy Technology Co., Ltd. Untuk sintesis katode, LiOH·H 2 O dicampur dengan prekursor pada rasio molar Li:TM sebesar 1,08:1, dengan kelebihan litium mengompensasi kerugian penguapan selama kalsinasi. Empat varian material disiapkan melalui doping terkontrol: NCM-Bare (undoping), NCM-Al (doping 0,5 mol% Al 2 O 3 ), NCM-Nb (doping 0,5 mol% Nb 2 O 5 ), dan NCM-Nb/Al (codoping dengan 0,5 mol% Al 2 O 3 + 0,5 mol% Nb 2 O 5 ). Campuran bubuk dihomogenisasi melalui penggilingan mekanis dalam mortar akik selama 30 menit. Proses kalsinasi dua tahap digunakan, dengan perlakuan awal 4 jam pada suhu 500 °C untuk mencapai dehidrasi dan peleburan garam litium, dilanjutkan dengan reaksi 15 jam pada suhu 725 °C untuk memastikan interaksi keadaan padat menyeluruh antara LiOH, oksida logam transisi, dan spesies dopan.
Teknik Analisis
Analisis XRD dilakukan menggunakan difraktometer D8-ADVANCE (Nomor Seri 1821SMC0008) dengan radiasi Cu Kα. Pemindaian dilakukan pada rentang 2θ 10–100° dengan ukuran langkah 0,02°. Pola difraksi yang dihasilkan oleh interferensi sinar-X yang tersebar dari bidang kristal dianalisis menggunakan perangkat lunak TOPAS untuk penyempurnaan Rietveld guna memperoleh parameter kisi. Gemini 300 FE-SEM digunakan untuk mengamati morfologi permukaan. EDS digunakan untuk mengkarakterisasi distribusi unsur pada permukaan material. Pengukuran XPS dilakukan menggunakan sistem Thermo Fisher ESCALAB XI+. Ruang analisis mempertahankan vakum dasar lebih baik dari 5 × 10 −10 mbar. Sumber sinar-X Al Kα monokromatik (1486,6 eV) dengan ukuran titik variabel 300 μm hingga 2,5 mm digunakan untuk analisis keadaan oksidasi unsur dan spesiasi kimia kuantitatif. TEM dilakukan menggunakan instrumen JEM-F200 untuk menganalisis morfologi, komposisi, dan distribusi fase. TEM memberikan resolusi garis 0,1 nm dalam mode TEM dan 0,16 nm dalam mode STEM, yang memungkinkan pemeriksaan struktur kristal, cacat, dan susunan atom. Spektrometri emisi optik plasma yang digabungkan secara induktif (ICP-OES) dilakukan menggunakan sistem iCAP 7200. Batas deteksi mencapai sensitivitas tingkat ppm untuk kuantifikasi elemen jejak.
Pengujian Elektrokimia
Bahan katode Li[Ni 0,83 Co 0,12 Mn 0,05 ]O 2 yang disintesis melalui kalsinasi solid-state suhu tinggi, dikombinasikan dengan karbon konduktif Super-P dan pengikat PVDF dalam rasio massa 8:1:1 menggunakan N-metil-2-pirolidon (NMP) sebagai pelarut. Campuran dihomogenkan selama 15 menit menggunakan mixer planet vakum (SK-300SII, MTI Corporation) untuk memastikan dispersi yang seragam. Bubur yang dihasilkan ditaburkan dengan bilah dokter ke kolektor arus aluminium foil dan dikeringkan pada suhu 60 °C selama 4 jam dalam oven konveksi untuk menghilangkan sisa pelarut. Elektroda kemudian dipotong menjadi cakram berdiameter 12 mm dan dikeringkan dalam vakum pada suhu 120 °C semalaman untuk menghilangkan jejak kelembapan. Sel koin CR2032 dirakit dalam kotak sarung tangan berisi Ar (<0,1 ppm O 2 /H 2 O) dengan lapisan logam litium (ketebalan 400 μm, Honjo Metal) sebagai elektroda pembanding/referensi, 1 M LiPF 6 dalam etilena karbonat/dimetil karbonat (EC:DMC, 1:1 w/w) sebagai elektrolit, dan membran Celgard 2400 (ketebalan 20 μm) sebagai pemisah. Sel yang dirakit tersebut disimpan selama 12 jam sebelum pengujian elektrokimia untuk memastikan saturasi elektrolit yang lengkap.
Kinerja elektrokimia dinilai menggunakan sistem uji baterai LAND CT2001A. Siklus pembentukan awal terdiri dari 5 siklus pengisian-pengosongan pada 0,1 C (18 mA g −1 ) dalam rentang tegangan 2,75–4,3 V pada 25 °C untuk menstabilkan antarmuka elektroda-elektrolit. Setelah aktivasi, uji kemampuan laju dilakukan melalui siklus berurutan pada laju 0,2, 0,5, 1, 2, dan 5 C untuk mengevaluasi kinerja arus tinggi. Stabilitas siklus jangka panjang diperiksa lebih lanjut selama 100 siklus pada laju 1 C (180 mA g −1 ), dengan retensi kapasitas dihitung relatif terhadap siklus awal.
Stasiun kerja elektrokimia CHI604e digunakan untuk pengukuran EIS dan teknik titrasi intermiten galvanostatik (GITT). Analisis EIS dilakukan pada rentang frekuensi 100 kHz–0,1 Hz dengan amplitudo AC 5 mV, dan plot Nyquist yang dihasilkan disesuaikan menggunakan perangkat lunak ZView dengan model rangkaian ekivalen. Untuk pengukuran GITT, pulsa arus 0,1C (18 mA g −1 ) diterapkan selama 20 menit diikuti oleh periode relaksasi 1 jam hingga pergeseran tegangan stabil di bawah 1 mV. Koefisien difusi ion litium D Li+ dapat dihitung menggunakan rumus berikut
![]()
di mana τ melambangkan waktu relaksasi, m B adalah massa bahan aktif, M B adalah massa molar bahan aktif, V M adalah volume molar bahan aktif, dan S adalah luas efektif elektroda.





Tinggalkan Balasan