Abstrak Grafis
Kelas baru molekul organik redoks yang disebut isoindolinon dievaluasi secara elektrokimia untuk penggunaannya dalam baterai aliran organik nonair bertegangan tinggi. Molekul-molekul tersebut dicirikan oleh potensi formal yang reversibel dan sangat negatif di wilayah -2,8 V versus ferosena/ferosenium.
Abstrak
Studi ini mempertimbangkan sifat elektrokimia dan fisik dari enam isoindolinon fungsional, yang disintesis menggunakan rute hijau yang mudah. Senyawa tersebut menunjukkan aktivitas redoks pada potensial yang sangat negatif dengan potensial redoks kuasireversibel ≈−2,8 V versus Fc/Fc + , potensial di wilayah pengendapan dan interkalasi logam alkali. Untuk molekul-molekul dengan motif struktural tertentu, perilaku elektrokimia bersifat kuasireversibel secara elektrokimia, yang dikaitkan dengan pembentukan radikal karbanion yang distabilkan pada gugus karbonil. Sifat elektrokimia dari senyawa reversibel dinilai, dengan senyawa berkinerja timbal dicirikan secara galvanostatik secara ekstensif untuk menilai kandidatnya untuk penyimpanan energi tegangan tinggi non-air.
1 Pendahuluan
Karena tekanan pada rantai pasokan untuk bahan baterai anorganik konvensional seperti litium, vanadium, dan seng meningkat, ada kebutuhan untuk mendiversifikasi bahan elektroaktif yang tersedia dan menciptakan sistem yang berkelanjutan, berbiaya rendah, dan independen dari tantangan geopolitik. Salah satu rute yang berpotensi menguntungkan adalah menargetkan spesies redoks organik sepenuhnya; sistem bebas logam yang menggunakan molekul redoks organik kecil yang memiliki status muatan stabil. Dalam beberapa tahun terakhir, telah terjadi lonjakan yang sesuai dalam studi elektrokimia molekul organik aktif-redoks (ROM atau redoksmer) yang mungkin memiliki aplikasi di bidang baterai organik yang sedang berkembang. [ 1 ] Terutama, pekerjaan ini difokuskan pada aplikasi dalam baterai aliran redoks (RFB); sistem yang beroperasi menggunakan elektroda jinak yang mengisi dan mengeluarkan spesies aktif-redoks dalam larutan elektrolit. Namun, ada juga karya yang diterbitkan yang menargetkan penggunaan redoksmer dalam baterai solid-state berbasis polimer, mirip dengan baterai konvensional dengan elektroda aktif-redoks. [ 2 ]
Pekerjaan awal di bidang redoksmer dimulai dengan radikal bebas TEMPO pada tahun 2011 yang digunakan dengan pelarut non-air, [ 3 ] dengan kuinon terlarut dalam air yang muncul di bidang ini pada tahun 2014. [ 4 ] Sejak karya-karya penting tersebut, katalog molekul telah dikembangkan dalam media air dan non-air. 1 Yang paling baru, terobosan dalam pelarut non-air telah mengidentifikasi redoksmer yang dapat mencapai beberapa transfer elektron, [ 5 , 6 ] dan redoksmer siklopropana dengan potensi yang sangat positif, stabil, dan reversibel setinggi 1 V versus Fc, dengan siklus efisiensi tinggi yang melebihi 200 siklus. [ 7 ] Sementara bidang ini masih embrionik dibandingkan dengan RFB berbasis logam anorganik, ia berkembang pesat menjadi teknologi baterai yang kompetitif.
Sementara baterai berair memiliki keuntungan berupa pelarut berbiaya rendah dan kepadatan arus tinggi, baterai nonair menjanjikan dalam memanfaatkan jendela potensial yang sangat lebar dari pelarut aprotik. Memang, model telah menunjukkan bahwa redoksmer dengan potensial yang bersama-sama menghasilkan baterai lebih dari 3 V adalah satu-satunya cara yang layak untuk mencapai baterai aliran nonair yang layak secara ekonomi. [ 8 ] Mengidentifikasi redoksmer yang cocok yang bekerja dengan potensi penuh dari pelarut nonair merupakan suatu tantangan. Pekerjaan yang cukup besar telah dilaporkan untuk mengembangkan redoksmer posolit tegangan tinggi yang stabil, seperti turunan fenotiazin, [ 6 ] siklopropenium, [ 7 , 9 ] dan alkilbenzena. [ 10 ] Senyawa negolit juga telah dikembangkan dengan yang paling menjanjikan adalah benzothiodiazole, [ 11 ] benzofenon, [ 12 ] dan turunan benzotriazole. [ 13 ]
Biasanya, redoksmer organik membentuk keadaan radikal ionik yang stabil saat bermuatan. Posolit sering kali berupa kation radikal dalam keadaan bermuatan dan negolit biasanya berupa anion radikal yang stabil. [ 14 ] Hal ini berlaku untuk senyawa benzotriazol dan benzofenon yang hingga saat ini memiliki potensial redoks paling negatif dan stabil sebesar ≈−2,3 V versus Fc/Fc + . Untuk memperluas kelompok kandidat redoksmer ini, kami mempertimbangkan pilihan isoindolinon fungsional yang disintesis melalui reaksi yang dikatalisis kalsium. [ 15 ] Turunan isoindolinon telah diteliti untuk penggunaan medis, [ 16 ] dan telah menjadi produk teknik elektrosintesis eksperimental. [ 17 ] Namun, dalam karya ini sifat elektrokimia motif isoindolinon trisiklik dievaluasi secara komprehensif untuk mempertimbangkan aplikasinya sebagai redoksmer negolit potensial yang sangat tinggi.
2 Hasil dan Pembahasan
2.1 Sintesis Isoindolinon Fungsional
Isoindolinon yang difungsionalkan ( af ) disintesis melalui sikloadisi [4 + 2] yang sederhana secara operasional dengan menggunakan asiliminium yang dihasilkan secara katalitik sebagai dienofil dan berbagai diena yang tersedia secara komersial. [ 18 ] aR disiapkan langsung dari , melalui reduksi LiAlH 4 yang mudah . Semua senyawa dikarakterisasi sepenuhnya, dan strukturnya ditentukan secara jelas melalui spektroskopi NMR (lihat Informasi Pendukung). Kami beralasan, berdasarkan preseden literatur, bahwa perancah ini mungkin merupakan kandidat ideal untuk bertindak sebagai redoksmer organik, mengingat kecenderungannya untuk menjalani berbagai transformasi elektrokimia. [ 17 ]
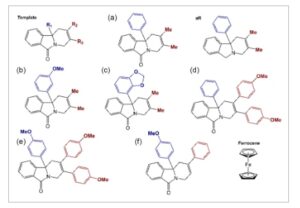
Seperti yang ditunjukkan pada Gambar 1 , keluarga enam isoindolinon terfungsionalisasi ( af ) yang dievaluasi dalam karya ini dikarakterisasi oleh struktur indolinonnya berupa cincin benzena dan pirol yang menyatu. Khususnya senyawa tersebut mengandung motif amida dengan situs gugus fungsi yang mudah tersubstitusi pada R1, R2, dan R3. Diharapkan bahwa karbonil dari fungsi amida akan menjadi situs elektroaktif reduktif untuk senyawa tersebut, yang memungkinkan pembentukan spesies radikal karbanion yang stabil. [ 3 , 19 ] Gugus fungsi pada posisi R1–3 kemudian divariasikan untuk mengubah struktur pendonor elektron dan resonansi senyawa tersebut. Senyawa ac memiliki gugus metil pada posisi R2 dan R3 dan dianggap sebagai molekul planar, d dan e memiliki fungsi metoksibenzena pada R2 dan R3, dan f disintesis dengan gugus benzena pada posisi R2 dan hidrogen pada R3. Gugus fungsi R1 bervariasi dari benzena sederhana hingga metoksibenzena dan untuk senyawa c , benzodioksol. Semua senyawa larut dalam asetonitril, meskipun konsentrasi lebih dari 5 mm dan batas kelarutan tidak dievaluasi.
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Diagram kimia molekul yang digunakan dalam penelitian ini: Redoksmer a–f) dengan variasi gugus fungsi R1, R2, dan R3 ditunjukkan dalam struktur templat. aR mewakili redoksmer a setelah reduksi kimia untuk menghilangkan gugus karbonil.
2.2 Evaluasi Elektrokimia
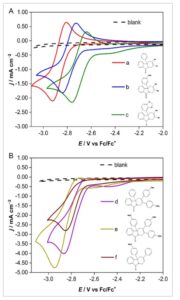
Dari molekul yang diuji, hanya molekul yang mempunyai gugus metil pada posisi R 2 dan R 3 yang menghasilkan voltametri reversibel secara kimia ( a–c ) ( Gambar 2 ). Molekul-molekul dengan substituen besar pada posisi R 2 dan R 3 ( d–f ) tidak menunjukkan voltametri reversibel secara kimia pada tingkat yang sama. Yang khususnya penting dari semua molekul adalah potensi reduksi yang sangat negatif jika dibandingkan dengan ferosenium—semuanya c.2,75 V (lihat Tabel 1 ). Potensi reduksi ini sangat dekat dengan potensi di mana asetonitril dielektrolisis, ≈−2,6 V versus SCE (≈−3,0 V vs Fc/Fc + ). [ 20 ] Dengan demikian, diragukan bahwa ada molekul redoks yang lebih negatif yang dapat berfungsi sebagai elektrolit baterai aliran redoks yang layak dalam asetonitril. Anolit paling negatif yang dilaporkan hingga saat ini adalah benzofenon dan benzotriazol [ 12 , 13 ] dengan −2,3 V versus Fc/Fc + . Ketika digabungkan dengan molekul aktif-redoks dengan potensial oksidasi yang lebih positif daripada ferosena, seperti TEMPO, perbedaan potensial yang lebih besar dari 3 V, [ 21 ] atau bahkan 4 V dalam kasus kation bis(diisopropylamino)siklopropenium-arena, [ 22 ] dapat dicapai. Mengingat bahwa kerapatan energi RFB berbanding lurus dengan perbedaan potensial antara reaksi setengah sel, beberapa molekul yang diperiksa dalam studi ini dapat menjadi kandidat yang menarik untuk aplikasi dalam RFB nonair tegangan tinggi.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
A) Hamparan CV untuk senyawa ac . B) Hamparan CV untuk senyawa df. Voltamogram yang direkam dalam asetonitril yang mengandung 0,1 mol dm −3 TBA ClO 4 dan, kecuali untuk blanko, 5 mmol dm −3 molekul yang diinginkan, menggunakan elektroda kerja GC, elektroda lawan Pt-wire, pada laju pemindaian potensial 100 mV s −1 dalam arah negatif.
Tabel 1. Potensial redoks isoindolinon terfungsionalisasi dalam asetonitril.
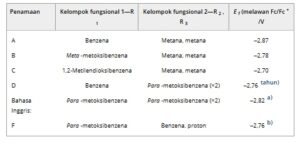
a) Puncak pembalikan (oksidasi) yang teramati sangat kecil;
b) Tidak ada puncak terbalik yang teramati, potensial reduksi dilaporkan sebagai potensial setengah gelombang.
Mengingat besaran relatif dari kerapatan arus puncak, molekul a , b , c , dan f diasumsikan mengalami reduksi 1 elektron, sedangkan d dan e , dengan sekitar dua kali kerapatan arus puncak katoda, diasumsikan mengalami reduksi 2 elektron ireversibel. Fitur voltametri seperti bahu yang mendahului peristiwa reduksi utama molekul c , d , dan e merupakan indikasi adsorpsi permukaan molekul aktif-redoks ke elektroda karbon-kaca (GC) sebelum elektroreduksi. Perbedaan struktural yang hanya ada pada d dan e adalah gugus para -metoksibenzena ganda besar yang kaya elektron tetapi mungkin menyediakan tempat untuk reduksi ireversibel cincin benzena pada potensial reduktif yang tinggi ini. Sementara reduksi 2 elektron akan menguntungkan untuk baterai aliran redoks, kurangnya reversibilitas kimia mencegah d dan e untuk dipertimbangkan.
Respon voltametri terhadap variasi laju pemindaian potensial dari tiga molekul isoindolinon yang menunjukkan reversibilitas kimia ditunjukkan pada Gambar 3 A–C , masing-masing. Setelah pemeriksaan pertama, ketiga molekul yang dimaksud menunjukkan perilaku elektrokimia kuasireversibel dengan voltametri bentuk puncak terbatas difusi simetris. Namun, pemisahan puncak-ke-puncak relatif tinggi, masing-masing sesuai dengan 116, 117, dan 125 mV. Hal ini mungkin disebabkan sebagian oleh pelarut nonair dan tidak adanya koreksi iR dalam data. Memang, pasangan ferosena/ferosenium memberikan Δ E p sebesar 120 mV.
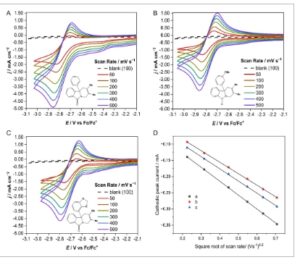
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
A–C) CV yang direkam dalam asetonitril yang mengandung 0,1 mol dm −3 TBA ClO 4 dan, kecuali untuk blanko, 5 mmol dm −3 molekul yang diinginkan, menggunakan elektroda kerja GC, elektroda lawan kawat Pt, pada laju pemindaian potensial berkisar dari 50 hingga 500 mV s −1 , semuanya dalam arah negatif. Kawat Ag digunakan sebagai elektroda pseudoreferensi. D) Arus puncak katoda diplotkan terhadap akar kuadrat laju pemindaian untuk setiap molekul.
Jelas dari voltamogram siklik (CV) yang disajikan pada Gambar 3 bahwa ada 2–3 reaksi katoda yang berlangsung sebelum elektroreduksi utama yang menghasilkan puncak yang jelas, E pc . Tidaklah tidak masuk akal untuk berasumsi bahwa beberapa adsorpsi permukaan terjadi pada permukaan elektroda yang menimbulkan kejadian katoda tambahan yang terekam. Analisis puncak pra-gelombang tidak meyakinkan apakah ini adalah puncak terbatas difusi atau puncak adsorpsi. Mungkin juga ada beberapa reduksi asetonitril itu sendiri dari potensial <−2,4 V versus Fc/Fc + . [ 23 ] Akan tetapi, perlu dicatat bahwa fitur katoda CV sebelumnya ini tidak diamati dalam semua kasus atau dalam blanko. Misalnya, CV dari a yang baru disintesis yang dilarutkan dalam asetonitril yang disajikan pada Gambar 4 tidak menunjukkan fitur voltametri seperti bahu yang diamati pada CV Gambar 2 hingga siklus voltametri kedua, setelah itu fitur tersebut muncul dan menjadi lebih jelas dalam siklus berikutnya.

Gambar 4
Buka di penampil gambar
Kekuatan Gambar
(Atas) CV yang direkam dalam asetonitril yang mengandung 0,1 mol dm −3 TBA ClO 4 dan, kecuali untuk blanko, 5 mmol dm −3 molekul a atau aR , menggunakan elektroda kerja GC, penghitung kawat Pt, dan referensi kawat perak. (Bawah) Mekanisme yang diusulkan untuk reduksi senyawa ac yang hampir reversibel .
Indikator lain dari reversibilitas elektrokimia (termodinamik) dalam CV adalah E p konstan saat ν berubah. Pada laju pemindaian potensial yang dipilih, E pc ditemukan berubah dengan ν , yang menunjukkan transfer elektron yang tidak dapat dibalik. Meskipun demikian, plot Randles–Ševčík (lihat Gambar 3D ) menunjukkan linearitas data untuk setiap molekul, yang secara tradisional menunjukkan bahwa tidak ada penyerapan molekul ke elektroda kerja dan bahwa transfer elektron heterogen yang dibatasi oleh difusi terjadi antara elektroda dan molekul dalam larutan.
Koefisien difusi dihitung menggunakan gradien garis regresi dari plot Randles–Ševčík menggunakan Persamaan (1) untuk transfer elektron reversibel elektrokimia, [ 20 ] di mana i pc adalah arus puncak katoda, 2,69 × 10 5 adalah konstanta yang berkaitan dengan kondisi standar, n adalah jumlah elektron yang ditransfer untuk menghasilkan satu molekul spesies tereduksi, C O adalah konsentrasi molekul analit dalam larutan elektrolit, D O adalah koefisien difusi bentuk teroksidasi dari molekul analit dalam larutan elektrolit, dan ν adalah laju pemindaian potensial.
![]()
Koefisien difusi sebesar 1,35 × 10 −5 , 1,60 × 10 −5 , dan 2,08 × 10 −5 cm 2 s −1 untuk redoksmer a , b , dan c , masing-masing, dihitung dari arus puncak katoda, memiliki besaran yang wajar dan sebanding, dan tidak menunjukkan indikasi mobilitas lambat dalam media nonair.
Untuk menentukan lokasi akseptor elektron dan mengidentifikasi sifat spesies kimia yang dielektroreduksi, litium aluminium hidrida digunakan untuk mereduksi a menjadi aR secara kimia (lihat Gambar 1 ). Struktur yang direduksi dikonfirmasi menggunakan NMR. Gambar 4 menunjukkan CV dari a dan aR dengan hilangnya puncak anoda yang sesuai dalam aR . Perbedaan dalam voltamogram ini menunjukkan bahwa pembentukan karbanion yang stabil setelah elektroreduksi sangat penting untuk voltametri yang dapat dibalik secara kimia, seperti yang digambarkan dalam skema yang diusulkan pada Gambar 4. Molekul karbanion yang stabil untuk digunakan dalam baterai aliran telah didokumentasikan sebelumnya, seperti N -metilftalimida. [ 3 , 24 ]
2.3 Stabilitas Voltammetri
Untuk menentukan stabilitas molekul a , sampel dilarutkan dalam asetonitril hingga konsentrasi 5 mmol dm −3 dan potensial elektroda GC diputar antara -0,34 dan -3,08 V (vs Fc/Fc + ) 100 kali pada 100 mV s −1 untuk mengamati setiap perubahan dalam keadaan elektroda atau molekul saat di bawah kendali potensiostatik berkelanjutan. Gambar 5 a menunjukkan modifikasi elektroda pada pemutaran potensial, ditunjukkan oleh peningkatan bertahap dalam intensitas gelombang reduksi dan hilangnya puncak terbalik (oksidasi). Pergeseran dalam potensial awal untuk reaksi juga terlihat jelas. Bentuk voltamogram yang berkembang yang dihamparkan pada Gambar 5 menyiratkan bahwa saat pemutaran berlangsung, reaksi E r C i ‘ autokatalitik muncul, kemungkinan karena reaksi isoindolinon tereduksi dengan pelarut asetonitril atau elektrolit pendukung TBA ClO 4 . Redoksmer dengan potensial ekstrem rentan bereaksi dengan lingkungan pendukungnya, dengan radikal anionik rentan melakukan serangan nukleofilik terhadap pelarut dan garam tertentu. [ 24 ] Hal ini diperburuk oleh kemungkinan dekomposisi asetonitril itu sendiri pada potensial yang sangat negatif ini. Ada beberapa catatan tentang asetonitril yang terurai secara elektrokimia dari <−2,4 V versus Fc/Fc + untuk membentuk anion 3-aminokrotonitril secara ireversibel. [ 23 ] Namun, pemindaian kosong asetonitril hingga potensial −3,05 versus Fc/Fc + tidak menunjukkan adanya kerusakan pelarut yang berarti. Stabilitas molekul isoindolinon yang direduksi secara elektro selanjutnya diselidiki dalam asetonitril dengan melakukan voltamogram laju pemindaian lambat. Gambar 5b menunjukkan hilangnya reversibilitas kimia dari a pada sapuan potensial yang lambat (5 mV s −1 ), tetapi tidak ada kehilangan dalam besarnya arus, yang selanjutnya mendukung mekanisme EC’ katalitik di mana bentuk a yang terelektroreduksi bereaksi secara kimia untuk membentuk spesies kimia yang tidak dapat dioksidasi pada potensial yang dipelajari dan dengan demikian membentuk kembali spesies netral a untuk reaksi lebih lanjut. Selain temuan bahwa elektroda GC dipasivasi selama 100 siklus, masuk akal untuk mengusulkan bahwa molekul isoindolinon yang terelektroreduksi menyerap dan mempasifkan elektroda GC. Molekul cjuga didaur ulang 100 kali dalam asetonitril, dan sebaliknya aktivitas redoks reversibel malah ditemukan pasif (Gambar S2, Informasi Pendukung). Hal ini disebabkan oleh pembentukan lapisan isolasi pada permukaan elektroda yang terlihat setelah pengayunan, terutama karena molekul menunjukkan gelombang awal yang jelas yang dianggap sebagai penyerapan pada ≈−2,5 V. Hal ini menunjukkan betapa berpengaruhnya gugus fungsi R1 dalam mencegah pembentukan lapisan dan mempertahankan elektroaktivitas reversibel.
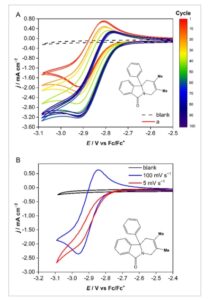
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
A) CV senyawa a direkam secara terus-menerus dalam asetonitril pada 100 mV s −1 . B) Hamparan senyawa a yang direkam pada 100 mV s −1 dan 5 mV s −1 . Kedua percobaan mengandung 0,1 mol dm −3 TBA ClO 4 dan, kecuali untuk blanko, 5 mmol dm −3 molekul a , menggunakan elektroda GC, elektroda lawan kawat Pt, dan pseudo referensi perak.
Degradasi redoksmer dan produk elektroreduksi/oksidasinya umum terjadi dalam sistem elektrokimia nonair. 1 , 14 Namun, penelitian telah menunjukkan bahwa beberapa merespons dengan baik dalam pelarut yang berbeda atau dengan garam pendukung yang berbeda. Gambar 6 menunjukkan respons senyawa a terhadap pelarut alternatif dan garam pendukung dengan tujuan menstabilkan molekul a elektroreduksi . Campuran karbamat tegangan tinggi klasik dari etilen karbonat:dimetil karbonat (EC:DMC) yang digunakan dalam baterai Li-ion dan pelarut amida dimetilformamida (DMF) keduanya dievaluasi. Selain itu, elektrolit pendukung alternatif litium bis(trifluromethanesulfonyl)imide (Li TFSI), Li PF 6 , dan TEA BF 4 dipilih pada konsentrasi yang sama yaitu 0,1 mol dm −3 . Dalam literatur, elektrolit Li TFSI ditemukan mampu menahan serangan nukleofilik oleh anion radikal N-MP; [ 24 ] namun, tampak bahwa semua reversibilitas kimia hilang oleh senyawa a dengan adanya Li TFSI dalam asetonitril (Gambar 6a ). Reversibilitas juga hilang saat menggunakan EC:DMC dan Li PF 6 . Kinerja terbaik DMF dikombinasikan dengan garam TEA BF 4 atau TBA ClO 4 mencerminkan kondisi anolit yang digunakan oleh Sanford et al. dalam studi ROM negolit tegangan tinggi terkini. [ 13 ] Gambar 6B menunjukkan 100 siklus berturut-turut dalam DMF dengan TEA BF 4 . Jelas, tidak ada perubahan dalam stabilitas molekul, menunjukkan bahwa DMF adalah pelarut yang unggul untuk evaluasi isoindolinon. Hal ini mungkin disebabkan oleh adanya amida dalam redoksmer dan pelarut. Eter dan glima tidak diuji tetapi juga dapat menawarkan solvasi redoksmer yang berguna.
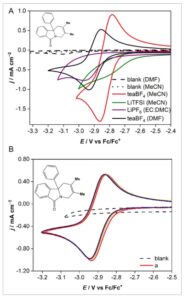
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
A) Pelapisan redoksmer a dalam berbagai pelarut dan kombinasi garam pendukung (diberikan dalam legenda). Asetonitril mengandung 0,1 mol dm −3 TEA BF 4 , asetonitril mengandung 0,1 mol dm −3 Li TFSI, campuran 50:50 (v:v) EC dan DMC mengandung 1,0 mol dm −3 Li PF 6 , DMF mengandung 0,5 mol dm −3 TEA BF 4 , dan dalam semua kasus kecuali untuk blanko, 1-5 mmol dm −3 redoksmer a . B) Pelapisan 100 siklus berturut-turut untuk 5 mmol dm −3 redoksmer a pada 100 mV s −1 dalam DMF yang didukung dengan 0,5 mol dm −3 TEA BF 4 . Parameter voltametri diberikan di Bagian Eksperimen.
2.4 Siklus Baterai Aliran Nonaqueous
Upaya dilakukan untuk menggunakan redoksmer a sebagai negolit baterai aliran, yang digabungkan dengan ferosena sebagai posolit dalam pelarut asetonitril dengan elektrolit TEA BF 4 . Namun, pengisian dan pengosongan tidak memungkinkan karena ketidakstabilan dan reaktivitas radikal karbanion dalam asetonitril (Gambar S3, Informasi Pendukung). Sebaliknya, pelarut dialihkan ke DMF, berdasarkan pada stabilitas siklus yang nyata yang ditunjukkan pada Gambar 6B dan keberhasilan Sanford et al. dengan senyawa anolit yang sangat negatif serupa. [ 13 ] Posolit dan negolit ditemukan tidak mempengaruhi proses redoks masing-masing saat dicampur (lihat Gambar 7 a ); oleh karena itu, pemisah Celgard digunakan untuk meminimalkan kerugian volta yang dikaitkan dengan membran ionik dalam sistem non-air dan keadaan ionik yang berbeda dari posolit dan negolit yang bermuatan.
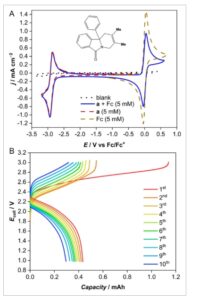
Gambar 7
Buka di penampil gambar
Kekuatan Gambar
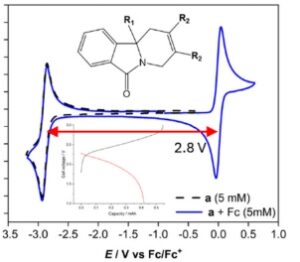
A) Hamparan CV untuk DMF kosong dan TEA BF 4 yang mendukung garam, 5 mmol dm −3 redoksmer a , 5 mmol dm −3 ferosena, dan baik ferosena maupun redoksmer a dalam larutan yang sama. B) Sepuluh siklus pengisian/pengosongan dua elektroda dari negolit redoksmer a (5 mm ) dan posolit Fc (6 mm ) dalam DMF dengan TEA BF 4 pada rapat arus 2,4 mA cm −2 . Parameter sel aliran diberikan dalam Bagian Eksperimen dan SI.
Secara teoritis, sistem yang terdiri dari hanya 5 mm elektrolit , dalam reservoir 10 mL, mencapai tegangan teoritis 2,8 V dapat menghasilkan baterai dengan 18,8 Wh L −1 . Gambar 7B menunjukkan data siklus galvanostatik yang dicapai pada kerapatan arus 2,4 mA cm −2 . Pada siklus pertama, redoksmer mengisi daya seperti yang diharapkan, sedikit kurang dari kapasitas teoritis (1,34 mAh) sebelum mencapai batas tegangan 3 V. Namun, profil pelepasannya buruk, dengan sedikit atau tidak ada pemulihan kapasitas. Setelah itu efisiensi coulombik membaik tetapi pemudaran kapasitas cukup substansial. Meskipun larutan DMF tampak stabil pada skala voltametri, terbukti bahwa karbanion yang bermuatan tidak stabil, atau bereaksi dengan kation ferosenium yang terbentuk dalam posolit. Sementara ketidakstabilan pasangan Fc selama siklus potensial dilaporkan, mengingat skala waktu penelitian, redoksmer a dianggap sebagai penyebab utama. [ 25 ] Terjadi persilangan yang jelas antara ferrosena dan isoindolinon sebelum dan selama reaksi berlangsung, seperti yang ditunjukkan pada Gambar S4, Informasi Pendukung. Meskipun demikian, perubahan pelarut menghasilkan peningkatan yang nyata pada kinerja siklus dibandingkan dengan asetonitril (Gambar S3, Informasi Pendukung). Optimalisasi dan karakterisasi lebih lanjut dari perancah redoksmer ini dengan gugus fungsi alternatif di lokasi utama dapat menghasilkan kandidat redoksmer yang stabil dan sangat larut untuk baterai aliran potensial tinggi.
3 Kesimpulan
Isoindolinon yang difungsionalisasikan merupakan kelas baru molekul kandidat untuk aplikasi penyimpanan energi yang dibedakan dengan potensi redoksnya yang sangat negatif sebesar ≈−2,8 V dibandingkan ferosena. Fungsionalisasi struktur inti menunjukkan bahwa substituen yang besar merugikan pembalikan reduksi elektrokimia. Memvariasikan fungsionalitas pada posisi yang lebih sentral dari benzena ke gugus fenil yang lebih banyak menyumbangkan elektron tidak terlalu memengaruhi potensi redoks atau pembalikan awal redoksmer. Namun, terdapat perbedaan perilaku yang jelas ketika bahan-bahan tersebut didaur ulang secara voltametri sebanyak 100 kali berturut-turut. Dalam kasus fenil sederhana, mekanisme EC’ muncul, yang dikaitkan dengan reaksi dengan asetonitril tereduksi, sedangkan dengan gugus benzendioksol, lapisan pasif terbentuk pada elektroda yang menekan perilaku redoks. Dalam DMF, senyawa a bersifat reversibel dan tidak berubah selama 100 siklus voltametri dan diuji secara galvanostatik dalam pengaturan baterai aliran. Meskipun siklus potensial tercapai, penurunan kapasitas cukup besar selama sepuluh siklus pada kerapatan arus tetap 2,4 mA cm −2 . Kerapatan arus yang lebih rendah niscaya akan meningkatkan efisiensi energi sistem, tetapi daya sistem akan sangat rendah.
Sementara studi pendahuluan dilakukan untuk memastikan pelarut dan garam optimal untuk daur ulang, hal ini dapat ditingkatkan lebih lanjut untuk menetapkan kondisi terbaik guna menstabilkan karbanion. Pekerjaan lebih lanjut diperlukan untuk lebih memahami sifat anion radikal yang terbentuk secara reversibel pada potensial negatif tersebut dan untuk merasionalisasi dampak gugus fungsional pada tiga lokasi yang mudah diakses. Kombinasi isoindolinon, pelarut, dan elektrolit yang berhasil difungsikan belum ditemukan tetapi akan menjadi usaha yang sangat berharga, mengingat potensi redoks isoindolinon yang sangat negatif namun reversibel.
4 Bagian Eksperimen
Bahan Kimia dan Reagen
Asetonitril (MeCN) (Acros Organics 99,9%, ekstra kering, melalui saringan molekuler, Acroseal) dan DMF ( N , N -DMF 99,8%, ekstra kering, melalui saringan molekuler Acroseal, ThermoScientific) dibeli dan digunakan sebagaimana diterima dalam kotak sarung tangan yang mengandung nitrogen untuk meminimalkan kadar air dalam pelarut elektrolit. Campuran 50:50 (v:v) etilen karbonat dan dimetilkarbonat yang mengandung 1 mol dm −3 Li PF 6 (Aldrich) disimpan dalam kotak sarung tangan. Tetrabutilamonium perklorat (TBA ClO 4 ), litium bis(trifluorometanasulfonil)imida (LiTFSI), dan tetraetilamonium tetrafluoroborat (TEA BF 4 ) dibeli dari Alpha Aesar, (99%+) dan ferosena dari Aldrich (98%). Semua digunakan sebagaimana diterima.
Sintesis Molekul Organik Aktif Redoks
Siklus aza tersier 6,5,6-Fused disintesis melalui sikloadisi [4 + 2] sesuai dengan prosedur yang diuraikan oleh Owen dan McLaughlin (2022). [ 18 ] Isoindolinon disintesis melalui pembentukan dan penangkapan ion N -acyliminium yang dikatalisis kalsium sesuai dengan prosedur yang diuraikan dalam Basson dan McLaughlin (2020). [ 26 ] Metode tersebut dirinci dalam SI bersama dengan karakterisasi proton dan karbon NMR (Bruker 400 Hz). ROM disimpan dalam lemari es antara 2 dan 8 °C.
Percobaan Elektrokimia
Semua percobaan dilakukan dalam kotak sarung tangan berisi nitrogen.
Percobaan voltametri dilakukan menggunakan potensiostat IviumStat (Alvatek) atau AutoLab PGSTAT204 (Metrohm) dan perangkat lunaknya masing-masing. Percobaan voltametri dilakukan dalam sel voltametri tiga elektroda standar 20 mL menggunakan elektroda kerja GC berdiameter 3 mm (BASInc), kawat Pt digunakan sebagai elektroda tandingan (BASInc), dan kawat Ag sebagai elektroda pseudoreferensi (kemurnian 99%, Goodfellows). Untuk merujuk potensi dengan benar dalam elektrolit nonair, larutan ferosena konsentrasi ≈5 mmol dm −3 dibuat dengan menambahkan ferosena ke larutan elektrolit di akhir setiap percobaan, untuk berfungsi sebagai referensi internal. Potensi telah digeser sedemikian rupa sehingga potensi reduksi pasangan redoks ferosena/ferosenium berada pada 0 V.
Sel aliran celah-nol konvensional (Gambar S5, Informasi Pendukung) dengan medan aliran aliran-melalui digunakan untuk eksperimen sel aliran. Sepotong kertas karbon setebal 1 mm (Technical Fibre Products Ltd. 20301A, pengikat PVA) berfungsi sebagai bahan elektroda sedangkan sepotong pemisah mikropori (Celgard2500; lapisan tunggal mikropori 25 μm, porositas 55%) berfungsi sebagai membran. Studi pengisian-pengosongan dilakukan dengan sel menggunakan konfigurasi sel penuh asimetris yang terdiri dari negolit redoksmer a pada 5 mm dan posolit ferosena pada 6 mm , keduanya 10 mL dalam DMF atau MeCN dengan 0,5 m TEA BF 4 . Elektrolit dipompa pada laju aliran 10 mL min −1 menggunakan pompa peristaltik seri Masterflex L/S (Cole-Parmer). Arus yang diberikan diubah menjadi kerapatan arus yang sesuai dengan penggunaan luas geometri elektroda/membran sebesar 2,08 cm 2 .





Tinggalkan Balasan