Abstrak
Remodeling miokardium merupakan faktor patofisiologis penting yang mendasari gagal jantung, penyebab utama kematian secara global. Dalam studi ini, kami menggunakan pencitraan spektroskopi Raman confocal untuk mendapatkan wawasan yang belum pernah ada sebelumnya mengenai jaringan miokardium selama remodeling. Kami menginduksi remodeling miokardium pada tikus melalui pemberian isoproterenol (ISO) subkutan (5 mg/kg) selama tujuh hari, yang divalidasi secara cermat melalui ekokardiografi dan pewarnaan histopatologi. Analisis selanjutnya menggunakan mikroskop elektron transmisi mengungkapkan kerusakan mitokondria yang signifikan. Namun, pencitraan spektroskopi Raman confocal memberikan visualisasi paling rinci dari arsitektur kompleks dalam jaringan miokardium yang diremodeling. Khususnya, teknik ini memungkinkan diferensiasi yang tepat antara daerah hipertrofik dan fibrotik dalam miokardium. Temuan ini tidak hanya memperdalam pemahaman kita tentang mekanisme yang mendorong remodeling miokardium tetapi juga menyoroti potensi transformatif pencitraan spektroskopi Raman confocal sebagai alat beresolusi tinggi tanpa label untuk menilai patologi jantung. Selain itu, identifikasi dengan bantuan kecerdasan buatan (AI) dan diferensiasi cepat lokasi fibrotik pada jaringan remodeling miokardium semakin meningkatkan potensi teknologi ini untuk aplikasi klinis yang ditargetkan, menandai kemajuan signifikan dalam pengelolaan gagal jantung.
1. PENDAHULUAN
Gagal jantung, tantangan kesehatan masyarakat yang meningkat pesat, saat ini menyerang lebih dari 37,7 juta orang di seluruh dunia. 1 Yang mengkhawatirkan, 45–60% pasien gagal jantung meninggal dalam waktu 5 tahun setelah diagnosis. 2 Remodeling miokard, yang ditandai dengan perubahan patologis adaptif pada kardiomiosit, matriks ekstraseluler, dan serat kolagen, dimulai dengan gangguan fungsi jantung, hipertrofi miokard, dan pelebaran ruang jantung. Remodeling ini berfungsi sebagai faktor penting dalam perkembangan dan progresi gagal jantung, yang memberikan dampak substansial pada kesehatan manusia. 3 Fitur utama respons miokard adaptif ini meliputi fibrosis dan hipertrofi miokard. Penilaian yang tepat waktu dan tepat terhadap perubahan ini, ditambah dengan pemahaman komprehensif tentang mekanisme yang mendasarinya, sangat penting untuk diagnosis dini, perencanaan intervensi, pembalikan remodeling, pencegahan gagal jantung, dan akhirnya, meningkatkan hasil pasien.
Modalitas diagnostik yang ada memainkan peran penting dalam evaluasi struktur dan fungsi jantung. Metode seperti ekokardiografi, pencitraan resonansi magnetik (MRI), pemindaian kedokteran nuklir, dan pemeriksaan histopatologi memberikan wawasan berharga tentang berbagai aspek kesehatan jantung. Namun, penting untuk menyadari bahwa meskipun modalitas ini menawarkan keuntungan yang signifikan, modalitas ini memiliki keterbatasan yang melekat, khususnya dalam kemampuannya untuk mendeteksi perubahan metabolik dalam biokimia jaringan dan memberikan pemantauan waktu nyata terhadap permulaan dan perkembangan remodeling miokardium. Keterbatasan ini menggarisbawahi perlunya metodologi yang dapat mengatasi tantangan ini dan memberikan pemahaman yang lebih komprehensif tentang remodeling miokardium dan mekanismenya. Ekokardiografi, teknik pencitraan noninvasif yang banyak digunakan, terutama berfokus pada penilaian struktur dan fungsi jantung. 4 Ekokardiografi memberikan informasi tentang parameter seperti fraksi ejeksi (EF), ketebalan dinding, dan dimensi ruang. Meskipun ekokardiografi sangat baik untuk menilai kelainan struktural, ekokardiografi mungkin tidak menangkap perubahan metabolik halus yang terjadi pada jaringan miokardium selama tahap remodeling awal. MRI adalah alat diagnostik hebat lainnya yang menawarkan gambar struktur jantung beresolusi tinggi. 5 , 6 Ini dapat memberikan informasi terperinci tentang karakteristik jaringan miokard, termasuk edema, fibrosis, dan atrofi miosit. 7 Pencitraan resonansi magnetik kardiovaskular dianggap sebagai standar emas untuk mendeteksi fibrosis miokard. 8 , 9 Namun, MRI mungkin dibatasi oleh faktor-faktor seperti ketersediaan, biaya, dan persyaratan untuk keahlian khusus. Selain itu, pemantauan perubahan metabolik secara real-time menggunakan teknik MRI konvensional dapat menimbulkan tantangan. Pemindaian kedokteran nuklir, seperti tomografi emisi positron dan tomografi terkomputasi emisi foton tunggal, memungkinkan penilaian perfusi dan metabolisme miokard. 10 Teknik-teknik ini berharga untuk mendeteksi iskemia dan infark tetapi mungkin tidak memberikan tingkat detail yang diperlukan untuk memantau perubahan metabolik dini yang terkait dengan remodeling. Pemeriksaan histopatologi tetap menjadi standar emas untuk menilai perubahan patologi jaringan, termasuk fibrosis. 11 Namun, ini invasif, memerlukan pengambilan sampel jaringan (biopsi), dan tidak cocok untuk pemantauan waktu nyata. Meskipun metode diagnostik tradisional ini menawarkan wawasan yang sangat berharga mengenai kesehatan jantung, keterbatasannya menyoroti pentingnya mengembangkan metodologi yang dapat menjembatani kesenjangan dalam kepekaan terhadap perubahan metabolik dan menyediakan kemampuan pemantauan waktu nyata. Pencitraan spektroskopi Raman konfokal muncul sebagai pendekatan yang menjanjikan untuk mengatasi tantangan ini.
Pencitraan spektroskopi Raman konfokal merupakan teknik mutakhir dengan potensi luar biasa untuk berbagai aplikasi, karena kemampuannya yang unik untuk memberikan wawasan tentang komposisi molekuler biokimia dan metabolisme dalam jaringan, semuanya tanpa label dan noninvasif. Teknologi ini telah menarik perhatian dan pujian yang cukup besar atas fitur-fiturnya yang khas, termasuk tidak merusak, resolusi spasial yang tinggi, dan sensitivitas yang luar biasa. Kapasitasnya untuk memvisualisasikan arsitektur jaringan dan distribusi spasial konstituen biokimia dengan mendeteksi fitur getaran yang khusus untuk ikatan kimia menjadikannya alat yang ampuh untuk berbagai bidang penelitian biomedis dan aplikasi klinis. Spektroskopi Raman, dasar pencitraan spektroskopi Raman konfokal, telah memainkan peran penting dalam memajukan pemahaman kita tentang sistem biologis. Spektroskopi ini telah membuktikan dirinya sebagai alat yang serbaguna dan sangat berharga di seluruh spektrum aplikasi. Salah satu kontribusinya yang penting adalah dalam pemantauan obat, yang dapat memberikan penilaian konsentrasi obat secara real-time dan mengoptimalkan strategi pemberian dosis. 12 Kemampuan untuk memantau perubahan dalam komposisi biokimia jaringan setelah perawatan obat tanpa perlu penanda endogen atau pewarna eksogen membedakan spektroskopi Raman, 13 membuatnya sangat menguntungkan dalam penelitian farmakologis. Dalam bidang diagnosis dan deteksi penyakit, spektroskopi Raman telah menunjukkan potensinya dalam mengidentifikasi patogen dan mendiagnosis berbagai penyakit. Misalnya, telah digunakan untuk identifikasi patogen yang cepat, 14 membantu dalam perawatan penyakit menular yang tepat waktu. Dalam penelitian kanker, spektroskopi Raman telah menunjukkan janji dalam mendeteksi jaringan kanker berdasarkan tanda-tanda biokimia yang berbeda. 15 , 16 Pendekatan noninvasif ini memiliki potensi untuk merevolusi diagnosis kanker dan pemantauan pengobatan. Penyakit neurodegeneratif juga telah menjadi fokus penelitian spektroskopi Raman. 17 Dengan menganalisis spektrum getaran peptida amiloid-β-(37-42), para peneliti telah memperoleh wawasan berharga tentang perubahan biokimia yang terkait dengan kondisi seperti penyakit Alzheimer dan Parkinson. 18 Hal ini berpotensi menghasilkan diagnosis dini dan perawatan yang lebih efektif untuk gangguan neurologis yang parah ini. Selain diagnosis penyakit, spektroskopi Raman telah digunakan dalam pengobatan regeneratif dan rekayasa jaringan. Para peneliti telah menggunakannya untuk memantau pertumbuhan dan diferensiasi sel rangka serta regenerasi tulang. 19 , 20Teknologi ini berpotensi memajukan bidang pengobatan regeneratif dengan memberikan umpan balik waktu nyata tentang perkembangan jaringan. Dalam bidang nefrologi, spektroskopi Raman telah digunakan untuk mengidentifikasi penanda gagal ginjal kronis. 21 Dengan menganalisis spektrum getaran jaringan ginjal, para peneliti telah memperoleh wawasan tentang perubahan biokimia yang terkait dengan penyakit ginjal. 22 , 23 Hal ini dapat menghasilkan metode yang lebih baik untuk diagnosis dini dan pemantauan pengobatan pada pasien dengan gangguan ginjal.
Meskipun fleksibilitas dan efektivitas spektroskopi Raman terbukti dalam berbagai aplikasi ini, potensinya dalam menilai remodeling miokardium merupakan wilayah yang relatif belum dieksplorasi. Remodeling miokardium merupakan proses kompleks yang melibatkan perubahan struktural dan biokimia pada jaringan jantung. Kemampuan pencitraan spektroskopi Raman confocal untuk memberikan penilaian biokimia dan metabolisme jaringan secara real-time dan tanpa label memposisikannya sebagai alat yang menjanjikan untuk mengungkap seluk-beluk remodeling miokardium. Dengan memvisualisasikan komposisi molekuler dan perubahan metabolik dalam jaringan miokardium, teknologi ini berpotensi untuk meningkatkan pemahaman kita tentang mekanisme yang mendasari fenomena kardiovaskular yang kritis ini. Dalam penelitian perintis kami, kami telah memanfaatkan kekuatan pencitraan spektroskopi Raman confocal, sebuah teknik revolusioner yang berangkat dari metode pewarnaan histologis tradisional. Dengan pendekatan mutakhir ini, kami telah memulai perjalanan yang mengasyikkan ke dalam dunia rumit jaringan remodeling miokardium dalam model tikus. Tujuan utama kami ada dua: untuk mengkarakterisasi secara komprehensif fitur struktural jaringan ini dan untuk mengukur tingkat kerusakan yang mereka alami selama proses remodeling. Dengan melakukan itu, kami bertujuan untuk mengungkap rahasia tersembunyi dari remodeling miokard, menawarkan perspektif baru tentang fenomena kardiovaskular yang kritis ini. Ciri khas pendekatan kami terletak pada kemampuannya untuk memberikan resolusi spasial yang sangat baik, mengungkap distribusi spasial yang rumit dari konstituen biokimia dalam jaringan remodeling miokard. Tidak seperti metode pewarnaan konvensional, pencitraan spektroskopi Raman confocal mencapai prestasi ini tanpa memerlukan pewarnaan atau penanda eksogen. Metodologi noninvasif dan bebas label ini telah mengantar era baru dalam mengeksplorasi biokimia dan metabolisme jaringan dengan detail yang belum pernah terjadi sebelumnya. Untuk mengungkap kompleksitas remodeling miokard, kami menggunakan analisis kluster, sebuah metode yang memungkinkan kami untuk membedah jaringan remodeling menjadi beberapa wilayah berbeda, masing-masing dengan tanda biokimia uniknya sendiri. Informasi yang diperoleh dari analisis ini tidak hanya membedakan berbagai daerah dalam jaringan remodeling tetapi juga menjelaskan mekanisme dasar yang mendorong remodeling miokard. Temuan penelitian kami menandai tonggak penting dalam bidang kardiologi. Temuan ini menawarkan perspektif baru tentang identifikasi dan karakterisasi remodeling miokard, yang menjelaskan proses rumit yang mengatur fenomena ini. Lebih jauh, identifikasi in vivo dengan bantuan AI dari spektrum Raman individu dari daerah fibrotik dalam jaringan remodeling miokard diharapkan dapat mengobati dan bahkan membalikkan perkembangan fibrosis miokard yang tak henti-hentinya, yang membuka jalan bagi strategi terapeutik dalam gagal jantung.
2 BAHAN DAN METODE
2.1 Percobaan pada hewan
Studi ini disetujui oleh Komite Etik Sekolah Farmasi, Universitas Kedokteran Harbin (no. IRB3033723), yang mematuhi pedomannya. Empat belas tikus SD jantan (masing-masing 200 g) dibeli dari Liaoning Changsheng Biotechnology Co., Ltd. (no. lisensi SCXK (Liao) 2020-0001). Tikus-tikus tersebut dibagi secara acak menjadi dua kelompok yang masing-masing terdiri dari tujuh tikus, dijaga dalam suhu dan kondisi cahaya yang konstan, diaklimatisasi dengan lingkungan selama 1 minggu, dan dibiarkan makan dan minum dengan bebas. Kelompok eksperimen menerima suntikan ISO subkutan (5 mg/kg/hari, Sigma) selama tujuh hari untuk menginduksi remodeling miokard, sedangkan kelompok kontrol menerima volume salin yang sama. Dosis dan durasi suntikan ISO didasarkan pada penelitian sebelumnya. 24 Gambar 1 menunjukkan alur kerja penelitian ini.
 GAMBAR 1
GAMBAR 1
Buka di penampil gambar
Presentasi PowerPoint
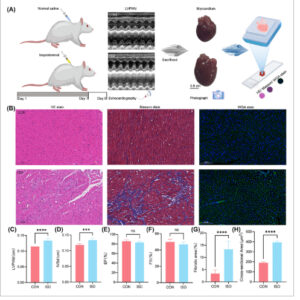
(A) Pewarnaan histopatologi menggunakan hematoxylin dan eosin (HE), trikrom Masson, dan aglutinin kecambah gandum (WGA) untuk menilai remodeling miokardium. (B) Pencitraan spektroskopi Raman konfokal untuk menganalisis komposisi jaringan miokardium. (C) Mikroskopi elektron transmisi untuk memvisualisasikan kerusakan mitokondria. (D) Evaluasi kerusakan jaringan miokardium. (E) Visualisasi komposisi kimia jaringan miokardium. (F) Identifikasi daerah-daerah berbeda dalam miokardium yang telah diremodeling. (G) Representasi skematis dari mekanisme rumit yang mendasari remodeling miokardium. (H) Aplikasi AI dalam jaringan remodeling miokardium. Gambar ini menyajikan desain eksperimen komprehensif untuk membangun model tikus remodeling miokardium melalui injeksi isoprenalin subkutan. Pencitraan spektroskopi Raman konfokal yang dikombinasikan dengan pewarnaan histopatologi dan mikroskopi elektron transmisi memungkinkan analisis komprehensif tentang remodeling miokardium, yang memungkinkan penilaian kerusakan jaringan yang akurat, visualisasi komposisi kimia, identifikasi daerah yang berbeda dalam miokardium yang diremodeling, dan penyelidikan mekanisme yang mendasarinya. Selain itu, kombinasi AI dan spektroskopi Raman akan membantu mengidentifikasi lokasi fibrosis miokardium secara akurat dan cepat secara in vivo.
2.2 Pengukuran ekokardiografi
Tikus SD disuntik dengan ISO atau garam fisiologis normal selama tujuh hari dan kemudian menjalani ekokardiografi. Ekokardiografi dilakukan dengan anestesi umum menggunakan natrium pentobarbital. 25 Hewan dibius dan ditahan dalam posisi terlentang untuk ekokardiografi transtoraks. Metrik seperti ketebalan diastolik dinding posterior ventrikel kiri (LVPWd), ketebalan septum interventrikular saat diastol (IVSd), EF, dan pemendekan fraksional (FS) direkam menggunakan perangkat ultrasonografi Philips EPIQ5 oleh sonografer berpengalaman tanpa pengetahuan tentang pengelompokan tikus.
2.3 Pewarnaan histologis dan mikroskop elektron transmisi
Setelah ekokardiografi, tikus dikorbankan, dan jantung segera dikeluarkan, dicuci dengan garam yang didinginkan terlebih dahulu, lalu dikeringkan dari permukaan air menggunakan kertas penyerap. Jantung yang terkumpul diproses secara berbeda: satu bagian difiksasi dalam 4% paraformaldehida, ditanamkan dalam parafin, dan dipotong menjadi irisan 4 µm untuk pewarnaan HE, Masson, dan WGA guna menilai perubahan patologis, pembentukan serat kolagen, dan ukuran kardiomiosit dalam jaringan miokard tikus. Bagian lain dipotong menjadi volume 1 mm3 , difiksasi dalam 2,5% glutaraldehida, dan ditanamkan resin untuk membuat irisan yang sangat tipis. Irisan tersebut diwarnai dengan uranil asetat dan timbal sitrat, dan struktur mitokondria diamati dalam mikroskop elektron transmisi. Bagian ketiga ditanamkan dalam Tissue-Tek OCT Compound (Sakura), disimpan dalam lemari es pada suhu −80°C, dan dipotong menjadi irisan beku 10 µm sebelum digunakan untuk pencitraan spektroskopi Raman confocal. Luas fibrosis miokardium dan luas penampang kardiomiosit dianalisis menggunakan perangkat lunak Image J. Prosedur histopatologi dan mikroskop elektron transmisi seperti yang dijelaskan sebelumnya. 26 , 27
2.4 Pewarnaan terowongan
Pengujian dilakukan menggunakan kit deteksi apoptosis TUNEL (Wuhan Servicebio Biotechnology Co., Ltd.). Irisan parafin dideparafinisasi, diperlakukan dengan proteinase K, dan diinkubasi selama 20 menit pada suhu kamar. Irisan ditutup dengan larutan kerja pemecah membran untuk mempermeabilisasi membran, ditempatkan dalam larutan hidrogen peroksida 3%, dan diinkubasi selama 20 menit pada suhu kamar tanpa cahaya. Inkubasi larutan reaksi Tunel, inkubasi larutan reaksi Streptavidin-HRP, pengembangan warna DAB, inti yang diwarnai hematoksilin selama sekitar 1 menit, didehidrasi dan disegel, pemeriksaan mikroskopis, dan fotografi.
2.5 Pencitraan spektroskopi Raman konfokal
Potongan beku jaringan miokardium menjalani pencitraan resolusi tinggi menggunakan mikrospektrometer Raman konfokal WITec Alpha300. Peralatan ini, yang dilengkapi dengan sumber laser 532 nm dan lensa objektif 100x, memungkinkan pencitraan yang presisi. Setiap sampel jaringan dipindai pada 3–5 daerah (area 50 × 50 µm, 100 × 100 titik) dengan daya laser 18 mW dan waktu integrasi 0,5 detik. Sebelum pencitraan spektroskopi Raman konfokal, potongan beku jaringan miokardium direndam dalam PBS selama 10 menit dan dicuci dua kali dengan air ultramurni untuk menghilangkan sisa OCT dan efek darah pada jaringan miokardium. Data spektral Raman diproses menggunakan WITec Project FIVE, yang meliputi penghilangan sinar kosmik, pengurangan latar belakang, dan normalisasi intensitas spektral Raman dari 2800 hingga 3000 cm −1 , serta ekstraksi spektrum tunggal dan rata-rata Raman. Selain itu, konstruksi gambar berdasarkan intensitas dan posisi puncak dilakukan, diikuti oleh ekstraksi dan analisis komponen menggunakan analisis kluster untuk identifikasi dan diferensiasi berbagai daerah jaringan miokardium normal dan jaringan remodeling miokardium. Analisis kluster melibatkan pembagian pengamatan ke dalam kelompok-kelompok berbeda dengan beberapa fitur umum; pengamatan dalam kelompok yang berbeda harus berbeda, dan pengamatan dalam kelompok yang sama harus semirip mungkin. 28
2.6 kecerdasan buatan
Prapemrosesan Data: Citra Raman dari daerah fibrosis dan hipertrofik dari empat sampel remodeling miokardium dipilih untuk ekstraksi spektrum tunggal Raman, dengan 20 spektrum acak diekstraksi dari setiap daerah dan dipotong menjadi dua bagian (600–1800 −1 dan 2800–3100 −1 ). Empat set data daerah fibrosis parsial (masing-masing terdiri dari 10.000 spektrum Raman) dari sampel remodeling miokardium di atas kemudian dipilih untuk validasi citra.
Visualisasi Data: Paket bahasa R dplyr digunakan untuk menggabungkan semua data spektrum tunggal. Kemudian, paket R Rtsne digunakan untuk memperkecil skala data spektral, dan kumpulan data berdimensi tinggi dipetakan ke ruang berdimensi rendah (dalam penelitian ini, merupakan ruang tiga dimensi) dengan menghitung kesamaan antara titik data dalam ruang berdimensi tinggi untuk memvisualisasikan data.
Model pembelajaran mesin XGBoost: pertama, kumpulan data dibagi menjadi set pelatihan dan set pengujian sesuai dengan rasio 7:3 dengan menggunakan fungsi xgboost dari paket xgboost bahasa R, menetapkan parameter eta = 0,5, nrounds = 25, num_class = 8, objective = “multi: softmax”, objective = “multi: softmax”, max_depth = 6, nthread = 2. Setelah 25 iterasi, XGBoost menyelesaikan pelatihan dan kemudian diterapkan ke kumpulan data Raman yang sebagian terabsorbsi.
2.7 Analisis Statistik
GraphPad Prism 9.0 dan perangkat lunak Origin memudahkan pembuatan grafik. Untuk mengidentifikasi informasi molekuler setiap komponen, spektrum Raman rata-rata dari berbagai daerah jaringan miokardium normal dan jaringan remodeling miokardium diekstraksi. Intensitas puncak dan posisi puncak dari puncak karakteristik spektrum Raman rata-rata yang dinormalisasi dianalisis secara statistik. Representasi data dalam bentuk rata-rata ± simpangan baku (SD). Signifikansi statistik dinilai menggunakan ANOVA satu arah untuk perbandingan beberapa kelompok dan uji- t sampel independen untuk perbandingan dua kelompok, dengan p < .05 dianggap signifikan.
3 HASIL DAN PEMBAHASAN
3.1 Ekokardiografi dan pewarnaan histopatologi untuk menilai remodeling miokard
Untuk mengonfirmasi induksi remodeling miokardium pada tikus dengan ISO (5 mg/kg), kami menggunakan kombinasi ekokardiografi dan pewarnaan histopatologi, seperti yang diuraikan dalam Gambar 2A . Data ekokardiografi (Gambar 2C,D ) mengungkapkan peningkatan signifikan dalam LVPWd ( p < .0001) dan IVSd ( p = .0001) dalam kelompok ISO dibandingkan dengan kelompok kontrol, yang menunjukkan hipertrofi miokardium. Namun, tidak ada perbedaan signifikan dalam EF dan FS (Gambar 2E,F ), yang menunjukkan bahwa fungsi jantung tetap bersifat kompensasi. Meskipun demikian, hanya mengandalkan ekokardiografi untuk diagnosis tidaklah memadai.
 GAMBAR 2
GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
Ekokardiografi dan Pewarnaan Histopatologi. (A) Diagram alir pewarnaan ekokardiografi dan histopatologi setelah pemodelan tikus. (B) Gambaran representatif pewarnaan HE, Masson, dan WGA. (C–F) Analisis kuantitatif LVPWd, IVSd, EF (%), dan FS (%) ( n = 7). (G, H) Analisis kuantitatif area fibrotik miokard dan area penampang kardiomiosit ( n = 7). Signifikansi statistik ditunjukkan sebagai *** p < .001, **** p < .0001 dibandingkan dengan kelompok CON. Data disajikan sebagai mean ± SD.
Pemeriksaan histopatologi (Gambar 2B ) selanjutnya memperkuat pembentukan remodeling miokard pada tikus. Pewarnaan HE mengungkapkan gangguan serat miokard dan pembengkakan kardiomiosit dengan sel inflamasi yang menyusup dalam kelompok ISO. Pewarnaan Masson menunjukkan proliferasi serat kolagen dan peningkatan substansial pada area fibrotik (Gambar 2G , p < .0001), sementara pewarnaan WGA mengungkapkan kardiomiosit yang membesar dan peningkatan luas penampang kardiomiosit (Gambar 2H , p < .0001). Pengamatan histologis ini secara kolektif mengonfirmasi adanya kerusakan miokard, fibrosis, dan hipertrofi dalam kelompok ISO. Namun, meskipun teknik-teknik ini berharga, teknik-teknik ini tidak memberikan wawasan tentang perubahan komponen biokimia jaringan, yang memerlukan integrasi pencitraan spektroskopi Raman confocal untuk pendekatan diagnostik yang lebih komprehensif.
3.2 Pencitraan spektroskopi Raman konfokal untuk menilai kerusakan jaringan miokardium
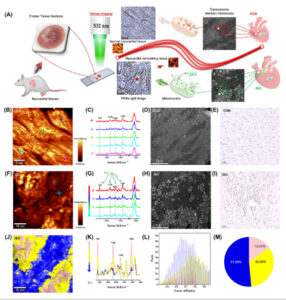
Pencitraan spektroskopi Raman konfokal, dikombinasikan dengan mikroskop elektron transmisi, digunakan untuk menilai kerusakan jaringan miokardium (Gambar 3A ). Citra Raman dari jaringan miokardium normal (Gambar 3B ) menunjukkan kontur yang jelas dan morfologi teratur. Spektrum Raman yang diperoleh dari berbagai daerah jaringan miokardium normal (Gambar 3C ) menunjukkan puncak yang jelas pada 748, 1128, 1306, dan 1584 cm −1 . Penelitian sebelumnya telah mengidentifikasi puncak pada 748 dan 1128 cm −1 sebagai karakteristik sitokrom c tereduksi (cyt c) dan sitokrom b5 tereduksi. Puncak pada 1306 cm −1 berhubungan dengan cyt c tereduksi, sedangkan puncak pada 1584 cm −1 berhubungan dengan cyt c tereduksi, sitokrom b5 tereduksi, dan mioglobin teroksigenasi. 29 , 30 Sitokrom b5 tereduksi berperan dalam siklus redoks membran mitokondria luar, sementara cyt c muncul sebagai penanda klinis yang berharga untuk menilai kerusakan mitokondria dan seluler. 31 , 32 Informasi ini menggarisbawahi peran penting sitokrom ini dalam fungsi mitokondria dan potensi kegunaannya dalam mendiagnosis kondisi miokard. Gambar 3F menunjukkan gambar Raman dari jaringan remodeling miokard, yang memperlihatkan variasi signifikan dalam nilai piksel dalam jaringan. Spektrum Raman yang diperoleh dari berbagai daerah (Gambar 3G ) menunjukkan perbedaan substansial dalam intensitas puncak karakteristik cyt c tereduksi, konsisten dengan variasi nilai piksel yang diamati dalam gambar Raman. Membandingkan gambar cahaya putih dari jaringan remodeling miokard (Gambar 3A ), menjadi jelas bahwa area dengan nilai piksel rendah dalam gambar Raman sesuai dengan lesi fibrotik, yang menunjukkan kerusakan miokard yang parah di daerah fibrotik.
 GAMBAR 3
GAMBAR 3
Buka di penampil gambar
Presentasi PowerPoint
Penilaian tingkat keparahan cedera miokardium menggunakan pencitraan spektroskopi Raman confocal. (A) Diagram alir yang mengilustrasikan proses pencitraan spektroskopi Raman confocal yang dikombinasikan dengan mikroskop elektron transmisi untuk menilai tingkat keparahan cedera miokardium. (B) Citra Raman dari jaringan miokardium normal. (C) Spektrum Raman representatif yang diperoleh dari berbagai lokasi di panel (B). (D) Citra mikroskop elektron transmisi dari jaringan miokardium normal. (E) Citra pewarnaan TUNEL dari jaringan miokardium normal. (F) Citra Raman dari jaringan remodeling miokardium. (G) Spektrum Raman representatif yang diperoleh dari berbagai lokasi di panel (F). (H) Citra mikroskop elektron transmisi dari jaringan remodeling miokardium. (I) Citra pewarnaan TUNEL dari jaringan remodeling miokardium. (J, K) Citra analisis klaster dan komponen spektrum Raman yang sesuai pada 600 hingga 1800 cm −1 di panel (F). (L) Piksel yang sesuai dengan afiliasi pengelompokan yang berbeda di panel (J). (M) Jumlah piksel yang mewakili setiap afiliasi klaster di panel (L).
Bukti substansial menghubungkan disfungsi mitokondria dengan penyakit kardiovaskular, 33 dengan gangguan mitokondria yang berkontribusi terhadap respons inflamasi dan kematian sel, yang pada akhirnya mengarah pada kondisi kardiovaskular. 34 Selain itu, cyt c berfungsi sebagai biomarker in vivo kerusakan mitokondria dan organ, memicu apoptosis saat dilepaskan dari mitokondria ke dalam sitoplasma. 35 Penilaian cyt c di ruang ekstraseluler berfungsi sebagai penanda kerusakan mitokondria yang parah dan kematian sel. 32 Oleh karena itu, kami berhipotesis bahwa kerusakan mitokondria dan apoptosis hadir dalam jaringan remodeling miokard. Mikroskop elektron transmisi (Gambar 3D,H ) dan pewarnaan TUNEL (Gambar 3E,I ) selanjutnya mengonfirmasi kerusakan mitokondria dan apoptosis pada jaringan miokard kelompok ISO. Temuan ini sejalan dengan penurunan intensitas puncak cyt c yang berkurang dalam spektrum Raman dan penurunan nilai piksel pada gambar Raman. Dengan demikian, cukup masuk akal untuk menyimpulkan bahwa tingkat keparahan kerusakan miokardium dapat dinilai melalui nilai piksel dalam pencitraan Raman dan perubahan intensitas puncak dari puncak karakteristik cyt c yang tereduksi dalam spektrum Raman.
Untuk menilai secara visual luas kerusakan pada jaringan remodeling miokard, kami menyempurnakan kumpulan data pada Gambar 3F ke rentang 600 hingga 1800 cm −1 dan melakukan analisis klaster (Gambar 3J,K ). Hasilnya mengungkapkan bahwa dalam spektrum Raman, intensitas puncak karakteristik cyt c yang tereduksi secara bertahap menurun dari daerah merah muda nonfibrotik miokard (daerah hipertrofik), melalui daerah kuning tepi fibrotik, ke daerah biru fibrotik miokard. Penurunan ini menunjukkan bahwa tingkat keparahan kerusakan miokard meningkat secara progresif dari daerah hipertrofik ke daerah tepi fibrotik dan akhirnya ke daerah fibrotik (Gambar 3K ). Area berbagai daerah cedera miokard diukur secara kuantitatif dengan menghitung piksel yang sesuai dengan afiliasi klaster yang berbeda pada Gambar 3J dan jumlah piksel (Gambar 3L,M ). Hasil ini menunjukkan bahwa pencitraan spektroskopi Raman confocal tidak hanya dapat mengidentifikasi tingkat kerusakan pada jaringan remodeling miokard tetapi juga menilai secara akurat area berbagai daerah kerusakan. Kemampuan ini sangat penting untuk penentuan lokasi fibrotik secara klinis dan ablasi minimal invasif. Ini berarti bahwa pencitraan spektroskopi Raman confocal terbukti menjadi alat yang ampuh untuk menilai secara akurat tingkat cedera miokard dan melokalisasi area fibrotik dalam jaringan remodeling miokard, semuanya tanpa mengganggu struktur jaringan seperti yang terlihat dalam metode patologi klasik. Inovasi ini merupakan kemajuan signifikan dalam deteksi dini remodeling miokard. Penelitian di masa mendatang akan bertujuan untuk menyelidiki perubahan komposisi biokimia selama perkembangan remodeling miokard dan mengidentifikasi daerah yang berbeda dalam jaringan yang diremodeling.
3.3 Menjelajahi efek fibrosis dan hipertrofi miokardium menggunakan pencitraan spektroskopi Raman confocal
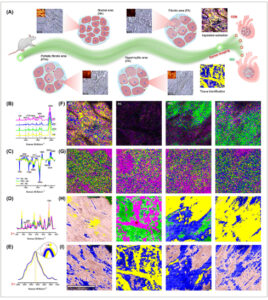
Untuk memperoleh pemahaman yang lebih mendalam tentang efek fibrosis dan hipertrofi miokardium pada jaringan miokardium selama proses remodeling, kami menggunakan pencitraan spektroskopi Raman confocal. Gambar 4A mengilustrasikan diagram alir pencitraan spektroskopi Raman confocal pada jaringan miokardium normal dan berbagai daerah jaringan remodeling miokardium, termasuk daerah fibrotik, daerah fibrotik sebagian, dan daerah hipertrofik. Pendekatan ini memungkinkan visualisasi spasial komposisi kimia jaringan miokardium dan identifikasi bebas label dari daerah-daerah berbeda dalam jaringan remodeling miokardium. Gambar 4B membandingkan spektrum Raman rata-rata jaringan miokardium normal dengan daerah fibrotik, fibrotik sebagian, dan hipertrofik jaringan remodeling miokardium. Daerah fibrotik menunjukkan lebih sedikit puncak yang teratasi dan rasio sinyal terhadap derau yang lebih rendah, yang menunjukkan bahwa jaringan miokardium di daerah ini rusak parah. Puncak pada 748, 1128, 1306, dan 1584 cm -1 sesuai dengan komponen yang dijelaskan sebelumnya, sedangkan puncak 1003 cm -1 dikaitkan dengan fenilalanina, 36 puncak 1446 cm -1 dengan kolagen dan fosfolipid, 37 dan puncak 1656 cm -1 dengan kolagen amida I dan mioglobin teroksigenasi. 29 , 30 , 38 Puncak pada 2929 cm -1 dikaitkan dengan peregangan protein CH 3 , dan penelitian sebelumnya telah menunjukkan bahwa pergeseran puncak dalam peregangan CH 3 terkait dengan jaringan fibrotik. 29
 GAMBAR 4
GAMBAR 4
Buka di penampil gambar
Presentasi PowerPoint
Visualisasi komposisi jaringan dan penilaian jaringan remodeling miokardium. (A) Diagram alir yang menguraikan proses pencitraan spektroskopi Raman konfokal yang dilakukan pada jaringan miokardium normal dan berbagai area dalam jaringan remodeling miokardium, termasuk area fibrotik, fibrotik sebagian, dan hipertrofik. (B) Spektrum Raman rata-rata yang diperoleh dari area jaringan miokardium normal, fibrotik, fibrotik sebagian, dan hipertrofik. (C) Perbedaan spektrum antara spektrum rata-rata area fibrotik, fibrotik sebagian, dan hipertrofik dan spektrum rata-rata jaringan miokardium normal. (D) Komponen spektrum Raman yang sesuai dengan rentang 600–1800 cm −1 yang digunakan untuk analisis klaster dalam panel (H). (E) Komponen spektrum Raman yang sesuai dengan rentang 2800–3100 cm −1 yang digunakan untuk analisis klaster dalam panel (I). (F) Gabungan gambar Raman yang menggambarkan distribusi komposisi kimia pada 748, 1128, 1307, dan 1585 cm −1 . (G) Gabungan gambar Raman yang mengilustrasikan distribusi komposisi kimia pada 858, 939, 1030, dan 1247 cm −1 . (H) Gambar analisis klaster pada 600–1800 cm −1 . (I) Gambar analisis klaster pada 2800–3200 cm −1 .
Untuk analisis komposisi kimia jaringan yang terperinci, kami mengurangkan spektrum rata-rata jaringan miokardium normal dari spektrum rata-rata area fibrotik, fibrotik parsial, dan hipertrofik dari jaringan remodeling miokardium (Gambar 4C ). Spektrum perbedaan mengungkapkan bahwa intensitas puncak karakteristik pada 748, 1128, 1306, dan 1584 cm -1 berkurang secara signifikan di daerah fibrotik dibandingkan dengan jaringan miokardium normal. Sebaliknya, intensitas puncak karakteristik pada 858, 939, 1030, dan 1247 cm -1 meningkat secara signifikan, disertai dengan pergeseran posisi puncak dari puncak karakteristik pada 2929 cm -1 . Di antara mereka, puncak pada 858 dan 939 cm -1 dikaitkan dengan kolagen prolin 39 ; puncak pada 1030 cm -1 terkait dengan fenilalanina dan amida III 36 , 40 ; dan puncak pada 1247 cm -1 terkait dengan kolagen amida III dan heme. 29 , 38 , 39 Hasil-hasil ini menunjukkan bahwa, selain adanya cedera parah di daerah fibrotik, proliferasi kolagen dan perubahan stres jaringan yang dihasilkan juga terbukti. Gambar 4F dan Gambar S1 menunjukkan penggabungan gambar intensitas puncak Raman dan gambar distribusi puncak karakteristik pada 748, 1128, 1306, dan 1584 cm -1 dalam jaringan miokard normal dan daerah fibrotik, sebagian fibrotik, dan hipertrofik jaringan remodeling miokard. Gambar 4G dan Gambar S2 mengilustrasikan penggabungan gambar intensitas puncak Raman dan gambar distribusi puncak karakteristik pada 858, 939, 1030, dan 1247 cm −1 pada jaringan miokardium normal dan pada area fibrotik, fibrotik parsial, dan hipertrofik pada jaringan remodeling miokardium. Gambar-gambar ini menunjukkan bahwa pencitraan spektroskopi Raman konfokal dapat memvisualisasikan distribusi spasial komponen kimia dalam jaringan miokardium tanpa pelabelan, yang membantu mengidentifikasi jaringan remodeling miokardium dengan lebih baik dan memahami mekanisme remodeling miokardium.
Karena intensitas puncak karakteristik jaringan miokardium yang diremodelasi berubah secara signifikan dari 600 hingga 1800 cm −1 , analisis klaster dilakukan pada dataset ini (Gambar 4D,H ) untuk membedakan antara jaringan miokardium normal dan jaringan miokardium yang diremodelasi. Analisis klaster, yang menghasilkan lima komponen spektral Raman (Gambar 4D ), secara efektif mengidentifikasi dan membedakan berbagai daerah dalam jaringan miokardium normal dan jaringan remodeling miokardium (Gambar 4H ). Ini berbeda dari gambar intensitas puncak Raman yang sesuai dari dataset yang sama (Gambar S3A ) karena analisis klaster dapat mengidentifikasi lokasi fibrotik lengkap (area ungu pada Gambar 4H ) di antara daerah fibrotik. Untuk lebih memvalidasi hipotesis kami, kami melakukan analisis klaster pada dataset dari 2800 hingga 3100 cm −1 (Gambar 4E,I ). Hasilnya menunjukkan identifikasi yang efektif dan bebas label dari lokasi fibrotik penuh di wilayah fibrosis miokard (Gambar 4I ) dengan hanya menghasilkan tiga komponen aktif (Gambar 4E ), yang selaras dengan gambar posisi puncak Raman yang sesuai dengan set data 2800–3100 cm −1 (Gambar S3B ). Studi ini menunjukkan untuk pertama kalinya bahwa pencitraan spektroskopi Raman confocal dikombinasikan dengan analisis klaster dapat mengidentifikasi dan membedakan berbagai area dalam jaringan remodeling miokard dengan cara yang bebas label. Pendekatan ini penting untuk memandu diagnosis dan pengobatan remodeling miokard. Studi ini menyoroti bahwa pencitraan spektroskopi Raman confocal tidak hanya memberikan informasi terperinci tentang perubahan dan lokasi komponen kimia dalam jaringan remodeling miokard tetapi juga secara efektif membedakan berbagai area dalam jaringan remodeling miokard dari jaringan miokard normal.
3.4 Eksplorasi mekanisme remodeling miokard
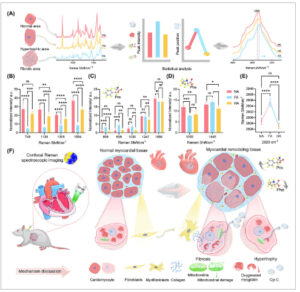
Dalam eksplorasi mekanisme remodeling miokard, perubahan patologis utama, hipertrofi miokard, dan fibrosis secara khusus ditargetkan. Analisis statistik dari intensitas puncak dan posisi puncak dari puncak karakteristik dalam spektrum Raman rata-rata jaringan miokard normal serta area hipertrofi dan fibrotik dari jaringan remodeling miokard. Analisis ini dirinci dalam Gambar 5A . Diamati, seperti yang ditunjukkan pada Gambar 5B , bahwa selama remodeling miokard, puncak karakteristik 748, 1128, 1306, dan 1584 cm −1 secara signifikan lebih rendah di area fibrotik dibandingkan dengan area normal. Penurunan ini lebih jelas daripada di area hipertrofi, yang menunjukkan kerusakan yang lebih parah pada jaringan fibrotik, mungkin karena mioglobin teroksigenasi dan kerusakan mitokondria, dan gangguan siklus redoks di membran mitokondria luar, yang mengakibatkan peningkatan pelepasan sit c tereduksi dan pergeseran ke sit c teroksidasi. Penelitian sebelumnya telah menunjukkan bahwa cyt c tereduksi memiliki intensitas puncak yang lebih kuat daripada cyt c teroksidasi pada 750, 1129, 1314, dan 1583 cm −1 . 41 Oleh karena itu, masuk akal untuk berspekulasi bahwa ketidakseimbangan dalam respons redoks cyt c dikaitkan dengan remodeling jaringan miokard. Namun, Gambar 5C menunjukkan bahwa puncak pada 858 dan 939 cm −1 , yang terkait dengan kolagen prolin, secara signifikan lebih tinggi di area fibrotik daripada di area normal, tanpa perbedaan signifikan yang diamati antara area hipertrofik dan normal. Temuan ini menunjukkan potensi prolin sebagai penanda tanda Raman untuk fibrosis miokard. Prolin, asam amino nonesensial, diedarkan dalam siklus prolin antara mitokondria dan sitoplasma, dan ketersediaan prolin untuk apoptosis/autofagi yang bergantung pada prolin dehidrogenase/prolin oksidase disesuaikan pada tingkat produksi kolagen. 42 Penelitian sebelumnya telah menunjukkan bahwa tingkat tinggi biosintesis prolin pada fibroblas terkait kanker mendukung produksi kolagen matriks ekstraseluler. 43 Lebih jauh lagi, telah disarankan oleh beberapa peneliti bahwa prolin yang disintesis secara biosintesis lebih disukai dimasukkan ke dalam kolagen, dan pembentukan kolagen bergantung pada prolin yang disintesis secara biosintesis. 44 , 45 Peran yang dimainkan oleh prolin dalam sintesis kolagen dan hubungan kompleks dari siklus prolin memberikan hubungan regulasi yang signifikan antara matriks ekstraseluler dan metabolisme. 46 Oleh karena itu, penargetan metabolisme prolin diidentifikasi sebagai strategi yang menjanjikan dalam memerangi fibrosis miokard.
 GAMBAR 5
GAMBAR 5
Buka di penampil gambar
Presentasi PowerPoint
Analisis statistik dan pembahasan mekanistik. (A) Diagram alir yang mengilustrasikan proses analisis statistik spektrum Raman rata-rata yang diperoleh dari jaringan miokardium normal dan area jaringan miokardium yang telah direnovasi, termasuk area fibrotik dan hipertrofik. (B–E) Hasil statistik yang menggambarkan intensitas puncak berbagai pergeseran Raman dan posisi puncak 2929 cm −1 ( n = 5). (F) Eksplorasi mekanisme renovasi miokardium melalui penerapan pencitraan spektroskopi Raman confocal. * p < .05, ** p < .01, *** p < .001, **** p < .0001. Data disajikan sebagai mean ± SD.
Puncak karakteristik pada 1030 cm −1 , terkait dengan amida III dan fenilalanina, tidak menunjukkan perubahan signifikan dalam intensitas di area fibrotik dibandingkan dengan area normal. Hal ini dapat dikaitkan dengan peningkatan kandungan kolagen, yang mengimbangi penurunan fenilalanina selama fibrosis miokardium. Namun, di area hipertrofik dibandingkan dengan area fibrotik, penurunan intensitas puncak ini dicatat ( p = .0093), yang mungkin terkait dengan berkurangnya kandungan fenilalanina. Mengenai puncak pada 1247 cm −1 , terkait dengan kolagen dan heme, dan puncak pada 1656 cm −1 , terkait dengan kolagen dan mioglobin teroksigenasi, tidak ada perubahan signifikan yang diamati di area fibrotik dibandingkan dengan area normal. Hal ini mungkin disebabkan oleh penurunan protein heme dan peningkatan kolagen secara bersamaan, yang menyeimbangkan perubahan dalam intensitas puncak. Sebaliknya, pengurangan intensitas puncak 1247 cm −1 di area hipertrofik ( p = .0012) mengindikasikan penurunan kandungan heme, meskipun penurunan puncak 1656 cm −1 tidak signifikan secara statistik. Analisis ini menunjukkan kegunaan mengamati perubahan intensitas puncak 1247 cm −1 untuk membedakan area hipertrofik dari area fibrotik dalam remodeling miokard. Penting untuk menyoroti bahwa penelitian sebelumnya telah mengidentifikasi pita Raman resonansi yang spesifik untuk heme dalam jaringan miokard pada 1227 cm −1. 29 Namun, penyelidikan kami mengungkapkan bahwa dalam rentang spektrum 1191 hingga 1283 cm −1 , puncak pada 1247 cm −1 menunjukkan intensitas yang relatif lebih tinggi daripada yang diamati pada 1227 cm −1 . Akibatnya, dalam konteks penelitian ini, puncak pada 1247 cm −1 dikaitkan dengan puncak karakteristik hemoglobin. Gambar 5D membandingkan intensitas puncak antara puncak tanda tangan fenilalanina pada 1003 cm −1 dan puncak tanda tangan bersama kolagen dan fosfolipid pada 1446 cm −1 pada jaringan miokardium normal dan yang sedang mengalami remodeling, yang menunjukkan hubungan antara penurunan kandungan fenilalanina dan remodeling miokardium, khususnya pada area hipertrofik versus fibrotik. Penelitian sebelumnya telah menunjukkan korelasi negatif antara konsentrasi fenilalanina dalam miokardium iskemik dan kejadian aritmia ventrikel yang mematikan pada model tikus iskemia miokardium akut. 47Pengamatan ini menyiratkan bahwa kadar fenilalanin yang menurun dalam jaringan miokard selama iskemia miokard akut merupakan indikasi prognosis negatif. Selain itu, remodeling miokard diakui sebagai faktor prognostik untuk hasil yang buruk pada penyakit kardiovaskular. Investigasi kami mengungkapkan bahwa jaringan yang mengalami remodeling miokard menunjukkan kandungan fenilalanin yang menurun, yang menunjukkan kemungkinan adanya hubungan dengan metabolisme fenilalanin yang tidak normal. Puncak karakteristik pada 1446 cm −1 diidentifikasi sebagai penanda spektroskopi Raman untuk hipertrofi miokard. Dibandingkan dengan jaringan miokard normal, intensitas puncak karakteristik ini menurun di area hipertrofi ( p = .0300), sementara tidak ada perubahan signifikan di area fibrotik. Temuan ini menunjukkan kandungan fosfolipid yang menurun dalam zona hipertrofik, yang sebagian diimbangi oleh peningkatan kandungan kolagen dalam daerah fibrotik. Kardiolipin memainkan peran penting dalam kesehatan kardiovaskular. 48 Kardiolipin sebagian besar terletak di membran mitokondria bagian dalam dan sangat penting untuk mempertahankan fungsi mitokondria; interaksinya dengan sit c mitokondria sangat penting dalam memulai apoptosis. 49 , 50 Penelitian sebelumnya telah menunjukkan bahwa, dalam model tikus cedera jantung yang diinduksi katekolamin, baik kadar kardiolipin sintase maupun kardiolipin berkurang secara signifikan dalam kardiomiosit, yang menyebabkan pelepasan mitokondria. 51 Lebih jauh lagi, defisiensi kardiolipin meningkatkan risiko berkembangnya kardiomiopati hipertrofik lipotoksik. 52 Mengingat puncak Raman khas kardiolipin dalam kisaran 1400 hingga 1500 cm −1 , 53 , 54 masuk akal untuk berspekulasi bahwa pengurangan yang diamati dalam kandungan fosfolipid di area hipertrofik mungkin disebabkan oleh penurunan kadar kardiolipin mitokondria. Akibatnya, modulasi farmakologis kardiolipin menyajikan strategi terapi yang menjanjikan untuk mengatasi hipertrofi jantung selama remodeling miokardium. Pada Gambar 5E , pergeseran posisi puncak protein pada 2929 cm −1 dianalisis secara statistik. Pergeseran ke kanan diamati pada area fibrotik dibandingkan dengan jaringan miokardium normal ( p < .0001), sementara tidak ada perubahan signifikan yang dicatat pada area hipertrofik. Fibrosis ditandai dengan aktivasi fibroblas dan miofibroblas, yang secara berlebihan menyimpan kolagen ke dalam matriks ekstraseluler. 55 Miofibroblas miokardium, yang berevolusi dari fibroblas, adalah sel mekanosensitif yang diberkahi dengan kemampuan sekresi dan kontraktil. Sel-sel ini mahir dalam mendeteksi variasi kekakuan jaringan dan merespons dengan tepat. 56 ,57
Akibatnya, fibrosis miokardium diketahui mengakibatkan peningkatan kekakuan miokardium pasif. 58 Hal ini menunjukkan bahwa pergeseran yang diamati pada posisi puncak pada 2929 cm −1 dapat dikaitkan dengan peningkatan kekakuan miokardium pasif, yang menyoroti hubungan rumit antara proses fibrotik dan sifat mekanis miokardium. Akibatnya, pergeseran ke kanan dari posisi puncak 2929 cm −1 berfungsi sebagai indikator untuk mengidentifikasi spektrum jaringan fibrotik miokardium. Gambar 5F mengilustrasikan peta mekanistik remodeling jaringan miokardium menggunakan pencitraan spektroskopi Raman confocal. Ini menyoroti transisi dari jaringan miokardium normal ke hipertrofi miokardium dan fibrosis di bawah pengaruh isoproterenol. Studi ini menunjukkan bahwa perubahan seperti penurunan kandungan mioglobin teroksigenasi, kerusakan mitokondria, pelepasan sitokrom dan ketidakseimbangan redoksnya, dan penurunan kandungan fenilalanin dapat mendasari mekanisme remodeling miokardium. Khususnya, peningkatan kandungan prolin dan pergeseran ke kanan pada puncak 2929 cm −1 dikaitkan dengan fibrosis miokard dan berfungsi sebagai tanda Raman untuk identifikasi fibrosis. Sebaliknya, penurunan intensitas puncak heme dan fosfolipid (1247 dan 1446 cm −1 ) dapat mengidentifikasi hipertrofi selama remodeling. Memahami mekanisme ini sangat penting untuk mengembangkan terapi baru, menunda perkembangan remodeling miokard, meningkatkan prognosis gagal jantung, dan mencegah penyakit jantung.
3.5 Identifikasi area fibrotik pada jaringan remodeling miokardium dengan bantuan AI
Gangguan fungsi jantung yang signifikan disebabkan oleh fibrosis miokard, yang dapat menyebabkan aritmia parah, gagal jantung, dan kematian mendadak. Meskipun ada kemajuan dalam teknik intervensi, alat yang efektif untuk mendeteksi fibrosis miokard in vivo masih terbatas. Tantangan seperti kompleksitas dan durasi pencitraan yang diperlukan, yang membatasi penerapan klinis pencitraan spektroskopi Raman confocal, dihadapi. Untuk mengatasi keterbatasan ini, spektrum Raman tunggal diekstraksi secara terpisah dari daerah hipertrofik dan fibrotik dalam jaringan remodeling miokard untuk diferensiasi. Ditunjukkan oleh pencitraan Raman kami bahwa rentang spektral spesifik (600 hingga 1800 cm −1 untuk intensitas puncak dan 2800 hingga 3100 cm −1 untuk posisi puncak) secara efektif membedakan daerah fibrotik dari nonfibrotik. Oleh karena itu, dalam penelitian ini, dua interval di atas dipilih untuk membedakan antara daerah fibrotik dan hipertrofik jaringan miokard.
Perbedaan yang jelas antara area fibrotik dan hipertrofik di kedua rentang spektral diamati, seperti yang digambarkan pada Gambar 6A . Untuk memvalidasi metode ini, pengklasifikasi pembelajaran mesin (XGBoost) dikembangkan dengan akurasi 89,5833% di kedua rentang spektral (Gambar 6B ). XGBoost adalah algoritma pembelajaran ensemble berdasarkan pohon keputusan dan mengadopsi kerangka kerja peningkatan gradien. 59 Sebagai metode pembelajaran mesin yang andal dan efisien, metode ini telah diterapkan secara luas untuk memecahkan berbagai masalah yang kompleks. 60 Di bidang penyakit kardiovaskular, pengklasifikasi XGBoost telah menunjukkan nilai aplikasi yang sangat baik, seperti memprediksi prognosis pasien di unit perawatan koroner, membedakan apakah pasien dengan dugaan penyakit jantung koroner memiliki stenosis arteri koroner, memprediksi risiko kekambuhan dalam 12 bulan setelah ablasi frekuensi radio pada pasien dengan fibrilasi atrium dan mengidentifikasi penyebab henti jantung yang tidak terkait dengan jantung. 61 – 64 Validasi ganda ini menggarisbawahi potensi teknik yang dibantu AI dalam pengaturan klinis. Lebih jauh lagi, kemanjuran pendekatan ini dikonfirmasi ketika kumpulan data spektrum Raman (masing-masing terdiri dari 10.000 monospektra dari jaringan fibrotik sebagian) diproses melalui pengklasifikasi kami. Baik gambar prediksi intensitas puncak Raman dan gambar prediksi posisi puncak Raman sangat dekat dengan gambar intensitas puncak Raman yang sebenarnya dan gambar posisi puncak Raman, membuktikan keandalan pengklasifikasi (Gambar 6C ). Antisipasi diadakan untuk perkembangan masa depan di mana spektroskopi Raman, terintegrasi dengan sistem berbasis kateter selama prosedur pembedahan, dapat digunakan untuk mengidentifikasi lokasi fibrotik dengan cepat dan presisi. Kemajuan tersebut diharapkan dapat merevolusi pengobatan fibrosis miokard, mengurangi risiko yang terkait dengan aritmia dan gagal jantung dan pada akhirnya mengurangi kematian jantung mendadak.
 GAMBAR 6
GAMBAR 6
Buka di penampil gambar
Presentasi PowerPoint
Kecerdasan buatan mendukung identifikasi daerah fibrotik dan hipertrofik dalam jaringan remodeling miokardium. (A) Representasi proses diskriminasi Raman spektrum tunggal dari daerah fibrotik dan hipertrofik. (B) Diagram skematik yang menunjukkan evaluasi akurasi dan validasi daerah fibrotik dan hipertrofik berdasarkan pembelajaran mesin. (C) Hasil prediksi intensitas puncak Raman dan prediksi posisi puncak Raman yang merepresentasikan sebagian daerah fibrotik dari jaringan remodeling miokardium.
4 KESIMPULAN
Sebagai kesimpulan, pencitraan spektroskopi Raman confocal menonjol sebagai alat yang ampuh dan sangat efektif untuk penilaian komprehensif jaringan miokardium yang telah mengalami remodeling. Alat ini unggul dalam kemampuannya untuk memvisualisasikan komposisi molekuler biokimia yang rumit dan proses metabolisme dinamis dalam jaringan miokardium, semuanya dalam lingkungan aslinya. Selain itu, alat ini menawarkan kemampuan luar biasa untuk secara tepat menentukan daerah yang telah terdampak oleh hipertrofi dan fibrosis miokardium. Lebih jauh lagi, teknik ini menawarkan keuntungan klasifikasi jaringan yang cepat. Kami telah berhasil menemukan penanda molekuler Raman yang dapat mengidentifikasi jaringan remodeling miokardium tanpa perlu pelabelan. Lebih jauh lagi, penelitian kami menyelidiki secara mendalam mekanisme yang mendasari proses remodeling miokardium yang rumit. Temuan-temuan ini sangat menjanjikan bagi bidang kardiologi. Temuan-temuan ini berpotensi untuk merevolusi diagnosis dini dan pemantauan remodeling miokardium secara real-time. Lebih jauh lagi, temuan-temuan ini membuka jalan bagi pengembangan intervensi farmasi yang ditargetkan dan evaluasi yang tepat terhadap kemanjuran terapeutik. Barangkali yang paling menonjol, pencitraan spektroskopi Raman confocal menawarkan prospek yang menggiurkan untuk memungkinkan identifikasi intraoperatif yang tepat dari area fibrotik dan hipertrofik. Kemajuan ini berpotensi menghasilkan manfaat klinis yang substansial, yang pada akhirnya menguntungkan seluruh komunitas medis. Singkatnya, penelitian kami memposisikan pencitraan spektroskopi Raman confocal sebagai teknologi transformatif dalam bidang penilaian remodeling miokard. Ia menawarkan wawasan yang tak tertandingi ke dalam komposisi jaringan dan mekanisme penyakit, yang mengawali era baru pengobatan presisi dan perawatan pasien yang lebih baik di bidang kardiologi.




Tinggalkan Balasan