Abstrak Grafis
Pra-jenuh dengan ion Fe tampaknya menekan pembubaran ion Fe lebih lanjut dari NiFeO x dan mencapai daya tahan tinggi untuk evolusi oksigen dalam kondisi yang sangat basa.
Abstrak
Elektrolisis air yang didukung oleh sumber energi terbarukan adalah teknik yang matang dan praktis untuk menghasilkan hidrogen hijau. Biaya produksinya sangat dipengaruhi oleh efisiensi dan daya tahan, dengan perhatian khusus adalah daya tahan anoda untuk reaksi evolusi oksigen (OER) di lingkungan yang sangat oksidatif dan asam/basa pada suhu tinggi. Daya tahan selama operasi intermiten dengan sumber terbarukan, dengan memperhitungkan siklus on/off, juga menjadi pertimbangan. Studi ini menyelidiki daya tahan NiFeO x , salah satu elektrokatalis paling aktif dalam kondisi basa, dalam berbagai kondisi termasuk kondisi yang relevan secara industri: 7 M KOH pada 80 °C dan 600 mA cm −2 . Hasilnya menunjukkan bahwa operasi on/off dengan variasi potensial yang luas menyebabkan degradasi yang parah dibandingkan dengan operasi OER yang konstan. Namun, stabilitas sedikit membaik dengan penambahan ion Fe 3+ jenuh ke dalam elektrolit, mencegah pelindian Fe. Dengan membedah mekanisme degradasi langkah demi langkah, studi ini menjelaskan keterbatasan dan membantu dalam menciptakan strategi untuk sistem elektrolisis yang sangat tahan lama.
1 Pendahuluan
Elektrolisis air yang didukung oleh sumber energi terbarukan dapat menghasilkan hidrogen hijau, pembawa energi global yang menjanjikan. Untuk mengurangi biaya produksi hidrogen, ada permintaan tinggi untuk meningkatkan efisiensi energi dan daya tahannya pada kepadatan arus operasi yang tinggi menggunakan bahan-bahan yang melimpah di Bumi. Elektroliser air terutama terdiri dari anoda dan katoda, yang masing-masing menghasilkan oksigen dan hidrogen, serta elektrolit dan pemisah. Komponen-komponen ini dirakit dengan lapisan pengangkut berpori, pelat bipolar, dan pengumpul arus dalam elektroliser komersial. Saat ini, elektrolisis air membran pertukaran proton (PEMWE) dan elektrolisis air alkali (AWE) adalah teknologi komersial yang dominan. PEMWE sering membutuhkan elektrokatalis logam mulia karena membran polimer asam, sementara AWE dapat memanfaatkan katalis logam transisi yang melimpah di Bumi. Terlepas dari jenis teknologi elektrolisis air, kelebihan potensial untuk reaksi evolusi oksigen (OER) di anoda—reaksi transfer empat elektron—lamban.
Untuk mengurangi overpotensial OER, berbagai elektrokatalis telah dikembangkan. Ini termasuk katalis berbasis logam mulia, [ 1 – 3 ] oksida logam transisi, oksihidroksida, [ 4 – 6 ] dan perovskit. [ 7 – 9 ] Untuk AWE, bahan berbasis NiFe dikenal sebagai katalis OER yang sangat aktif dan melimpah. Secara luas diakui bahwa menggabungkan Fe ke dalam matriks Ni (oksi)hidroksida secara signifikan meningkatkan aktivitas OER, [ 10 , 11 ] tetapi mekanisme reaksi dan fungsi Fe terdoping sering memicu perdebatan. Misalnya, Bell dan timnya mengusulkan keberadaan situs Fe aktif dalam γ -Ni 1− x Fe x OOH berdasarkan analisis spektroskopi penyerapan sinar-X (XAS) operando dan perhitungan teori fungsional kerapatan. [ 12 ] Fe 4+ bervalensi tinggi ditemukan dalam jumlah besar katalis melalui spektroskopi operando Mössbauer, bahkan tanpa potensi yang diterapkan. [ 13 , 14 ] Spesies Fe 4+ aktif yang bertanggung jawab atas OER diperkirakan memainkan peran katalitik pada permukaan katalis, meskipun hal ini jarang diamati menggunakan teknik yang tersedia. Menggunakan mikroskopi elektrokimia pemindaian interogasi permukaan, Ahn dan Bard berpendapat bahwa kinetika OER spesies Ni 4+ secara signifikan lebih lambat daripada spesies Fe yang terdispersi dalam matriks oksida Ni. [ 15 ] Sebuah studi teoritis oleh Martirez dan Carter juga mendukung keterlibatan spesies Fe 4+ . [ 12 ] Peningkatan efisiensi katalitik sering kali dicapai melalui doping elemen ketiga, [ 16 – 19 ] deposisi pada substrat Ni yang sangat berpori, [ 20 ] atau pembentukan heterostruktur. [ 21 , 22 ]
Sebaliknya, penggabungan Fe ditemukan untuk meningkatkan konduktivitas massal matriks NiOOH, [ 10 , 23 ] dan diusulkan untuk meningkatkan kinetika OER Ni 3+/4+ melalui transfer muatan parsial antara Fe dan Ni, [ 10 , 23 ] mekanisme yang mirip dengan antara substrat NiOOH dan Au. [ 24 ] Selain efisiensi elektrokatalis berbasis NiFe, daya tahannya merupakan perhatian lain untuk aplikasi praktis. Misalnya, perangkat elektrolisis air saat ini diharapkan memiliki rentang jeda 80.000 jam dalam kondisi industri. [ 25 ] Namun, karena anoda terkena kondisi oksidatif yang tinggi, bahan anoda dapat larut dalam elektrolit, menyusun kembali menjadi fase terpisah, atau berubah menjadi fase tidak aktif karena oksidasi berlebih. Salah satu contohnya adalah pemisahan fase FeOOH dari NiFe (oxy)hydroxide, yang diamati dengan sinkrotron XAS dan mikroskop fluoresensi sinar-X selama polarisasi anodik dalam 1 M KOH pada suhu ruangan, yang mengakibatkan hilangnya aktivitas. [ 26 ] Fenomena ini disebabkan oleh pelarutan dan pengendapan ulang spesies Fe.
Sementara operasi anoda kontinyu menyebabkan hilangnya aktivitas, pemulihan fase campuran yang sangat aktif diamati ketika potensial katoda diterapkan pada katalis. Pelindian Fe yang istimewa dikaitkan dengan degradasi selama polarisasi anoda kontinyu dalam larutan alkali ringan (≤1 M KOH pada suhu ruangan), yang dapat dipulihkan dengan adanya Fe dalam elektrolit dan polarisasi katoda. [ 27 , 28 ] Lapisan nanomembran, seperti lapisan atas CeO x yang elektroinaktif , dapat berfungsi sebagai tindakan untuk melindungi Fe dari pelarutan, mencegah spesies Fe larut ke dalam larutan massal, oleh karena itu meningkatkan stabilitas NiFeO x dalam 1 M KOH pada 20 mA cm −2 . [ 29 ] Selama pengembangan elektrokatalis OER, uji ketahanan sering kali terbatas pada kondisi yang agak ringan, seperti operasi di bawah 100 mA cm −2 dalam ≤1 M KOH pada suhu ruangan. Namun, untuk aplikasi di AWE, operasi pada kepadatan arus tinggi (>500 mA cm −2 ) dalam larutan yang sangat basa (30 wt% KOH) pada suhu tinggi (80 °C) diperlukan, yang dapat memperburuk degradasi.
Ni dan Fe dilaporkan larut dari interlayers dalam NiFe layered double hydroxide (LDH) pada rapat arus tinggi 500 mA cm −2 pada 80 °C karena pengasaman lokal yang disebabkan oleh difusi OH− yang lambat di dalam interlayers. [ 30 ] Dilaporkan juga bahwa NiFe-LDH dapat berubah menjadi Ni(OH) 2 kristal dan FeOOH amorf hanya dengan merendam dalam 7,5 M KOH pada 80 °C. [ 31 ] Pelindian Fe telah diidentifikasi sebagai penyebab degradasi NiFeO x dalam larutan yang sangat basa (>5 M KOH). [ 32 , 33 ] Dalam larutan yang sangat basa ini, berbagai anion ferrat, seperti FeO 4 2− , FeO 2 − , FeO 2 2− berpotensi ada. [ 34 ] Percobaan kontrol sistematis menggunakan berbagai suhu, kerapatan arus operasi, dan konsentrasi alkali telah mengungkapkan bahwa kondisi alkali yang tinggi merupakan penyebab utama degradasi NiFeO x . [ 35 ]
Selain itu, diantisipasi bahwa peralihan yang sering antara operasi on/off akan terjadi ketika sumber energi terbarukan yang terputus-putus diperhitungkan sebagai masukan energi. Khususnya, dalam sel tumpukan AWE, pergeseran besar dalam potensial elektroda terjadi antara operasi on dan off karena arus balik antara anoda dan katoda. Ini terjadi melalui saluran manifold dan diafragma yang jenuh dengan elektrolit yang sangat konduktif. [ 36 , 37 ] Pergeseran potensial ini dapat memicu oksidasi dan reduksi bahan elektroda, yang mengarah pada perubahan struktural dan sebagainya. Untuk menentukan tingkat degradasi anoda dan katoda secara individual, prosedur eksperimental yang menggunakan sistem tiga elektroda telah disarankan untuk mensimulasikan operasi on/off tersebut. Metode seperti voltametri siklik (CV) atau siklus gelombang persegi antara potensial anoda dan katoda umumnya digunakan. Misalnya, pelarutan anoda dan katoda iridium dari katalis iridium oksida hidrat diidentifikasi selama siklus CV dalam 0,1 MH 2 SO 4 menggunakan sel aliran pemindaian bersama dengan spektrometer massa plasma yang dikopel secara induktif. [ 38 , 39 ] Selama siklus, ditemukan bahwa laju pelarutan Ir ditingkatkan lebih dari 200 kali dibandingkan dengan laju selama operasi galvanostatik. Degradasi parah diamati karena siklus gelombang persegi pada NiFe-LDH pada potensial katoda di bawah redoks Ni 2+/3+ dibandingkan dengan operasi galvanostatik dalam 1 M KOH pada suhu kamar. Degradasi ini dikaitkan dengan perubahan morfologi dan hilangnya struktur kristal dan jarak antar lapisan. [ 40 ] Juga telah ditegaskan bahwa gelembung gas yang terbentuk di pori makro selama siklus gelombang persegi mengakibatkan terlepasnya elektrokatalis NiCoO x . [ 41 ]
Dengan mempertimbangkan jenis degradasi yang disebutkan di atas, penelitian ini mengevaluasi stabilitas NiFeO x dengan siklus potensial ekstensif dalam kondisi yang relevan secara industri. Kami menggunakan lingkungan oksidatif yang keras pada 600 mA cm −2 dalam 7 M KOH pada 80 °C untuk operasi tersebut. Kami mengamati degradasi parah akibat siklus redoks yang disertai dengan variasi potensial yang ekstensif. Kami selanjutnya menyelidiki mekanisme degradasi selama siklus redoks dengan melakukan perbandingan dengan berbagai kondisi operasi dan dengan adanya aditif dalam elektrolit.
2 Hasil dan Pembahasan
2.1 Perbandingan Daya Tahan NiFeO x Pada Berbagai Kondisi
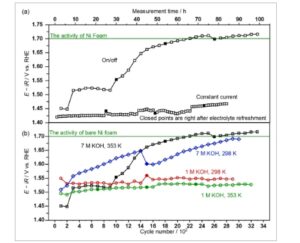
Dalam studi ini, elektrokatalis NiFeO x diendapkan pada substrat busa Ni menggunakan metode hidrotermal. [ 42 ] Potensi OER kondisi tunak NiFeO x dalam 7 M KOH pada 353 K dibandingkan selama uji stabilitas antara operasi arus konsisten pada 600 mA cm −2 dan protokol hidup/mati ( Gambar 1 a ). Versi modifikasi dari prosedur yang dilaporkan oleh A. Haleem et al digunakan untuk menilai daya tahan dengan sapuan potensial ekstensif, seperti yang ditunjukkan dalam Skema 1 . [ 43 ] Potensi kondisi tunak yang diperlukan untuk 600 mA cm −2 didokumentasikan setiap 100 siklus. Selama arus konstan, degradasi signifikan tidak diamati dalam periode 24 jam awal, tetapi degradasi bertahap sebesar 47 mV relatif terhadap aktivitas awal diperhatikan setelah 80 jam elektrolisis. Sebaliknya, selama uji siklus redoks, NiFeO x terdegradasi lebih dari 50 mV dalam 200 siklus awal (kira-kira dalam waktu 5 jam), setelah itu potensial tetap stabil pada 1,52 V versus elektroda hidrogen reversibel (RHE) menggunakan elektrolit yang sama hingga tanda 24 jam. Karena penguapan elektrolit, penggantian diperlukan. Setelah elektrolit diganti, NiFeO x terus terdegradasi. Dampak elektrolit akan dibahas di bagian berikutnya.
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
a) Perbandingan antara uji arus konstan pada 600 mA cm −2 dan uji on/off antara 600 mA cm −2 dan 0,3 V versus RHE. Semua pengukuran dilakukan dalam 7 M KOH pada 353 K. b) Perbandingan protokol on/off di antara berbagai kondisi menggunakan 1 M dan 7 M KOH pada suhu kamar dan 353 K. Titik-titik yang terisi tepat setelah elektrolit diisi ulang. Potensial kondisi tunak diperoleh dengan 15 menit CP setelah 100 siklus dalam protokol on/off. Semua pengukuran menggunakan kawat Pt dan elektroda Hg/HgO (1 M NaOH) sebagai CE dan RE, masing-masing.
Skema 1
Buka di penampil gambar
Kekuatan Gambar
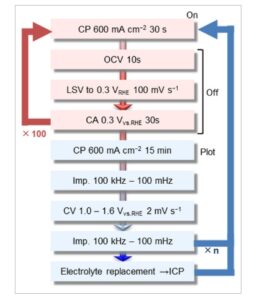
Uji ketahanan hidup/mati dibuat berdasarkan protokol yang dilaporkan oleh kelompok Mitsushima, [ 43 ] yang dimaksudkan untuk mereproduksi kondisi daya hidup dan daya mati yang diulang dalam periode singkat. Pada awal siklus unit, CP dilakukan pada 600 mA cm −2 selama 30 detik untuk mereproduksi kondisi hidup , diikuti oleh pengukuran tegangan rangkaian terbuka selama 10 detik dan voltamogram sapuan linier pada 100 mV s −1 hingga 0,3 V versus RHE untuk mereproduksi penurunan tegangan mendadak saat catu daya diputuskan. Kondisi mati direproduksi oleh CA pada 0,3 V versus RHE selama 30 detik. Potensi OER setelah siklus dievaluasi oleh CP selama 15 menit untuk mendapatkan potensi kondisi tunak dan CV setiap 100 siklus. Elektrolit diganti dengan yang baru setiap 24 atau 48 jam. CP: kronopotensiometri; OCV: tegangan rangkaian terbuka; LSV: voltametri sapuan linier; CA: kronoamperometri; Imp.: spektroskopi impedansi.
Potensi OER akhirnya mencapai 1,7 V versus RHE setelah 3200 siklus uji sapuan potensial. Khususnya, potensi yang dicapai sama dengan potensi yang diperlukan untuk 600 mA cm −2 pada elektroda busa Ni polos, yang menunjukkan katalis NiFeO x tidak ada pada elektroda. Untuk memperjelas sifat elektrokatalis, kemiringan Tafel dibandingkan sebelum dan sesudah uji siklus redoks ekstensif (Gambar S1a, Informasi Pendukung). Sebelum uji daya tahan, kemiringan Tafel adalah 40 mV dec −1 , sejalan dengan laporan sebelumnya [ 44 , 45 ] dan menunjukkan keberadaan NiFeO x . Namun, setelah uji siklus, kemiringan Tafel berubah menjadi 80 mV dec −1 , setara dengan nilai busa Ni polos, yang menunjukkan sifat bawaan elektrokatalis NiFeO x telah hilang sepenuhnya. Degradasi yang terjadi setelah siklus redoks melampaui degradasi setelah uji arus konstan sebesar 200 mV, yang menunjukkan bahwa degradasi parah tersebut dipicu oleh protokol hidup/mati, bukan sekadar oleh rapat arus tinggi dalam kondisi basa ekstrem.
Uji ketahanan on/off dilakukan pada 298 dan 353 K dalam 1 dan 7 M KOH untuk menentukan parameter operasi utama (Gambar 1b ). Ditemukan bahwa potensial OER secara konsisten meningkat dalam 7 M KOH bahkan pada 298 K. Setelah 3200 siklus, potensial mencapai 1,7 V versus RHE, yang juga merupakan nilai substrat Ni polos. Potensi OER bergeser secara katoda ke 1,6 V versus RHE segera setelah elektrolit disegarkan, mungkin karena reaktivasi elektrokatalis dalam elektrolit baru atau paparan udara pada suhu ruangan. Kami menunjukkan data analisis kemiringan Tafel yang diperoleh dari pemindaian negatif dalam CV pada 2 mV s −1 setelah 1400 dan 1500 siklus (Gambar S2, Informasi Pendukung). Kemiringan Tafel antara 1400 dan 1500 siklus tidak banyak berubah, dan keduanya berada di atas 40 mV dec −1 ; namun, kemiringan Tafel setelah 1500 siklus menunjukkan potensi yang lebih baik daripada setelah 1400 siklus. Sebaliknya, dalam 1 M KOH, terlepas dari suhu pengoperasian, potensi OER tidak menunjukkan perubahan signifikan, tetap pada 1,54 V versus RHE melalui 3000 siklus bahkan setelah elektrolit diperbarui. Hal ini menunjukkan bahwa kondisi yang sangat basa berkontribusi pada degradasi NiFeO x selama siklus potensial ekstensif. Karakterisasi lebih lanjut dari elektroda dan elektrolit yang digunakan akan dilakukan kemudian untuk menarik perbandingan dengan sampel pasca uji siklus potensial ekstensif dengan ion Fe 3+ jenuh .
2.2 Investigasi Durabilitas dengan Ion Fe3 + Jenuh dalam Elektrolit
Dari hasil pada bagian sebelumnya, dihipotesiskan bahwa Fe hilang dalam elektrolit yang sangat basa selama siklus potensial yang luas, menghasilkan aktivitas yang mirip dengan substrat Ni polos. Untuk lebih memperjelas mekanisme degradasi, uji ketahanan on/off dilakukan dalam KOH 7 M dengan Fe(NO 3 ) 3 jenuh , dan kemudian dibandingkan dengan uji yang dilakukan tanpa Fe(NO 3 ) 3 ( Gambar 2 ). Kami menghindari penggunaan garam Fe dengan anion lain, seperti klorida, fosfat, sulfat, dan anion organik, yang dapat menyebabkan interaksi yang tidak diinginkan dengan elektrokatalis. Meskipun garam klorida tersedia dengan mudah, anion klorida dapat menyebabkan korosi nikel atau pembentukan gas klorin. [ 46 , 47 ] Demikian pula, anion organik seperti asetat dihindari untuk mencegah oksidasi yang tidak diinginkan menjadi CO 2 . Anion sulfat dan fosfat, yang masing-masing divalen dan trivalen, dapat berinteraksi dengan anoda bermuatan positif, yang dapat memengaruhi struktur lapisan ganda, [ 46 ] yang berpotensi menambah kompleksitas pada penyelidikan efek kation besi jenuh. Sebaliknya, anion nitrat diharapkan memiliki dampak minimal pada antarmuka reaksi. Fe(NO 3 ) 3 juga digunakan untuk sintesis elektrokatalis dalam metode hidrotermal. Ditemukan bahwa potensial tetap sekitar 1,53 V versus RHE dalam larutan jenuh dengan Fe(NO 3 ) 3 , ini bertahan bahkan setelah mengganti elektrolit (simbol terisi; Gambar 2d ). Namun, degradasi awal hingga 1,53 V versus RHE masih terjadi dengan adanya ion Fe 3+ tambahan , yang menunjukkan bahwa mekanisme degradasi yang berbeda ada pada awalnya dan sesudahnya. Kemiringan Tafel dibandingkan sebelum dan setelah uji stabilitas on/off dengan adanya ion Fe 3+ jenuh (Gambar S1b, Informasi Pendukung). Kemiringan Tafel tetap hampir 40 mV dec −1 bahkan setelah 3200 siklus, yang menunjukkan pelestarian fungsi katalitik NiFeO x .

Gambar 2
Buka di penampil gambar
Kekuatan Gambar
a) Rangkaian ekivalen yang digunakan untuk pemasangan. b,c) Plot Nyquist dan hasil pemasangan dalam (b) 7 M KOH dan (c) 7 M KOH dengan Fe(NO3)3 jenuh sebelum dan setelah uji ketahanan on/off (3200 siklus). d) Perbandingan antara kapasitansi yang dipasang ( C dl ) dan potensial OER kondisi tunak selama uji ketahanan on/off. Potensi OER kondisi tunak hingga 3200 siklus ditunjukkan pada Gambar S3a, Informasi Pendukung. Kami mencatat bahwa setengah lingkaran yang diukur menyusut dalam arah imajiner. Meskipun pengenalan elemen fase konstan meningkatkan pemasangan, kapasitansi nyata setelah pemasangan ditemukan mirip dengan yang diperoleh dari rangkaian Randles yang ditunjukkan pada (a). Oleh karena itu, kami hanya menggunakan rangkaian Randles untuk meminimalkan parameter pemasangan.
Pergeseran paralel ke potensial negatif menunjukkan hilangnya jumlah situs aktif. Spektrum impedansi pada 600 mA cm −2 juga dianalisis menggunakan sirkuit Randles (Gambar 2a ) dan plot Nyquist dengan hasil yang dipasang (Gambar 2b,c , dan Tabel S1 dan S2, Informasi Pendukung). Kapasitansi lapisan ganda ( C dl ), yang mencerminkan luas permukaan yang aktif secara elektrokimia, juga ditunjukkan sebagai grafik batang pada Gambar 2d . Diamati bahwa C dl dengan cepat menurun hingga sekitar 10% dari nilai awal dalam 300 siklus (10 jam), terlepas dari keberadaan ion Fe 3+ jenuh . Penurunan C dl ini sejalan dengan degradasi awal potensial OER, yang menunjukkan bahwa degradasi awal berasal dari hilangnya luas permukaan yang aktif secara elektrokimia. Data perubahan kapasitansi terhadap waktu untuk arus konstan ditunjukkan pada Gambar S4, Informasi Pendukung. Telah diamati bahwa C dl perlahan menurun hingga 80% dari nilai awal selama pengukuran 24 jam. Data untuk C dl pada arus konstan, yang belum mengalami degradasi awal karena pengurangan cepat permukaan reaksi, seperti siklus on/off, menunjukkan bahwa degradasi awal disebabkan oleh penurunan luas permukaan yang cepat.
Siklus hidup/mati yang diamati melibatkan reaksi redoks antara Ni(OH) 2 dan NiOOH, yang puncak redoksnya muncul sekitar 1,4 V versus RHE. Perubahan volume di antara keduanya mungkin telah menyebabkan pelepasan elektrokatalis. Memang, partikel yang terlepas diamati dalam elektrolit ketika penggantian elektrolit dilakukan untuk pertama kalinya, terlepas dari keberadaan ion Fe 3+ jenuh . Dari kumpulan elektrolit kedua, tidak ada partikel yang terlepas yang diamati. Khususnya, C dl tidak berubah lebih lanjut setelah degradasi awal, namun tingkat degradasi berbeda antara larutan dengan dan tanpa ion Fe 3+ jenuh . Perbandingan ini menegaskan bahwa degradasi kedua, di atas 1,53 V versus RHE dalam larutan tanpa ion Fe 3+ jenuh , berasal dari hilangnya situs Fe yang sangat aktif daripada hilangnya luas permukaan elektrokimia. Tabel S3, Informasi Pendukung menyoroti bahwa pendekatan kami bekerja dalam uji daya tahan hidup/mati yang keras dibandingkan dengan strategi yang dilakukan untuk operasi arus konstan.
Untuk memperjelas reaksi samping karena keberadaan ion Fe 3+ , efisiensi Faradaic dari oksigen dan hidrogen dievaluasi. Hasilnya ditunjukkan pada Gambar S5, Informasi Pendukung. Kuantitas gas yang dihasilkan selama elektrolisis diukur menggunakan sel tipe-H (Gambar S5a, Informasi Pendukung) dan kromatografi gas dengan gas pembawa Ar melalui ruang. Uji arus konstan pada 600 mA cm −2 dalam 7 M KOH dengan Fe(NO 3 ) 3 jenuh dilakukan (Gambar S5b, Informasi Pendukung). Efisiensi Faradaic diperkirakan ≈ >99%, yang menunjukkan reaksi samping yang dapat diabaikan karena keberadaan ion Fe 3+ . Dengan demikian, kami mengonfirmasi bahwa fungsi ion Fe 3+ jenuh adalah untuk menstabilkan elektrokatalis NiFeO x . Untuk menyelidiki potensi OER pada kerapatan arus rendah dan puncak redoks, CV dilakukan selama siklus uji ketahanan hidup/mati dalam 7 M KOH dan 7 M KOH dengan Fe(NO 3 ) 3 jenuh . Dalam 7 M KOH (Gambar S3b, Informasi Pendukung), potensi OER, yang dapat dievaluasi dari pemindaian negatif di atas 1,4 V versus RHE tanpa puncak redoks, meningkat secara signifikan setelah 200 siklus. Potensi OER tersebut dipertahankan hingga 800 siklus, sebelum penggantian elektrolit, setelah itu terus meningkat hingga selesainya uji ketahanan. Tren ini sejalan dengan pergeseran potensi OER pada 600 mA cm −2 yang ditunjukkan pada Gambar 1a . Terlepas dari presaturasi dengan ion Fe3 + (Gambar S3b,c, Informasi Pendukung), area puncak redoks antara Ni2 + dan Ni3 + , yang oksidasi dan reduksinya dimulai dari ≈1,4 V versus RHE, berkurang secara signifikan setelah 200 siklus, mungkin karena terlepasnya elektrokatalis, termasuk matriks Ni. Dalam KOH 7 M tanpa ion Fe3 + jenuh (Gambar S3b, Informasi Pendukung), baik puncak oksidasi maupun reduksi bergeser positif dan negatif, masing-masing, sementara area puncaknya menurun secara ireversibel. Pergeseran negatif dari puncak reduksi berpotensi menandakan hilangnya Fe dalam matriks Ni (oksi) hidroksida. Puncak redoks sering dilaporkan bergeser positif ketika Fe ditambahkan ke matriks Ni. [ 10 ] Selain itu, untuk menyelidiki puncak redoks dari potensi yang lebih luas, CV dilakukan dari 1,6 V hingga 0,3 V versus RHE setelah aktivasi 15 menit pada 600 mA cm −2 dalam 7 M KOH, dengan atau tanpa pembersihan Ar (Gambar S6, Informasi Pendukung). Puncak reduksi pada 0,3 V versus RHE dicatat terlepas dari pembersihan Ar. Reaksi reduksi seperti itu dapat menyebabkan degradasi yang signifikan untuk NiFeO xdalam 7 M KOH selama pengujian ketahanan on/off. Namun, dalam 7 M KOH dengan ion Fe 3+ jenuh (Gambar S3c, Informasi Pendukung), posisi puncak redoks Ni tetap relatif konstan, yang menunjukkan bahwa Fe yang tersisa terus memengaruhi redoks Ni. Namun, puncak menjadi ambigu, mungkin karena adanya FeOOH, yang tidak menunjukkan puncak redoks sebelum dimulainya OER.
Tujuan utama dari studi ini berpusat pada penggunaan metode hidrotermal untuk mensintesis elektrokatalis NiFeO x pada substrat busa Ni. Beberapa metode sintesis digunakan untuk memeriksa ketahanan melalui siklus on/off. Penggabungan NiFeO x melalui pelapisan celup dilakukan dengan menggunakan larutan prekursor yang mengandung FeCl3 . [ 48 ] FeO x diendapkan secara elektrokimia secara katoda pada busa Ni yang baru diterima dan substrat busa Ni yang diaktifkan secara elektrokimia (ECA). [ 44 , 49 ] Terlepas dari persiapan anoda, pola dekomposisi serupa terdeteksi (Gambar S7, Informasi Pendukung).
Degradasi hingga 1,5 V versus RHE, yang disebabkan oleh pengurangan luas permukaan yang aktif secara elektrokimia, terjadi dalam waktu 10 jam. Potensialnya kemudian meningkat, mendekati busa Ni polos, yang disebabkan oleh hilangnya situs Fe aktif. Sebagai perbandingan, uji ketahanan untuk siklus on/off dilakukan dengan menggunakan NiFeO x yang disintesis melalui metode hidrotermal dalam 7 M KOH yang jenuh dengan Ni(NO 3 ) 2 pada 353 K (Gambar S8, Informasi Pendukung). Dalam hal ini, degradasi hingga 1,5 V versus RHE juga terjadi dalam waktu 10 jam, terlepas dari aditif, sehingga menguatkan degradasi mekanis.
Temuan ini menunjukkan sifat bawaan NiFeO x , yang mengakibatkan degradasi yang diamati selama proses on/off. Karakterisasi terperinci dilakukan kemudian, baik sebelum maupun setelah uji ketahanan on/off, menggunakan NiFeO x pada substrat busa Ni, yang diformulasikan melalui metode hidrotermal.
2.3 Karakterisasi Elektroda dan Elektrolit setelah Uji Daya Tahan Hidup/Mati
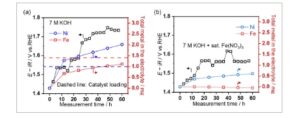
Untuk mengukur jumlah logam yang hilang dalam elektrolit, kami melakukan pengukuran spektra emisi optik plasma yang digabungkan secara induktif (ICP-OES) pada elektrolit bekas, yang diperbarui setiap 12 jam selama uji ketahanan hidup/mati. Endapan katalis yang terlepas diasamkan dan dimasukkan sebagai bagian dari jumlah yang hilang dalam elektrolit. Total muatan NiFeO x yang dibuat pada substrat busa Ni ditemukan sebesar 1,0 mg Ni dan 1,4 mg Fe. Estimasi dilakukan melalui ICP-OES setelah melarutkan busa Ni polos dan NiFeO x yang dibuat pada busa Ni dalam larutan HCl 35 wt%. Kami membandingkan jumlah total logam yang hilang dalam elektrolit dengan muatan awal dan perubahan potensial OER ( Gambar 3 ). Jika ion Fe 3+ jenuh tidak ada, lebih dari 1 mg Ni dan Fe hilang ke dalam elektrolit dalam waktu 12 jam. Dengan setiap penggantian elektrolit, hilangnya Ni dan Fe secara bertahap meningkat sejalan dengan potensial reaksi NiFeO x . Akhirnya, 80% Fe hilang dalam elektrolit setelah 60 jam uji ketahanan on/off. Setelah 60 jam pengujian ini, kami menemukan jumlah total Ni yang hilang dalam elektrolit melebihi kehilangan yang terlihat pada sampel yang dibuat. Surplus Ni kemungkinan berasal dari pembubaran substrat busa Ni yang terekspos. Ketika kami menggunakan 7 M KOH dengan Fe(NO 3 ) 3 jenuh sebagai elektrolit, kandungan Fe dalam larutan hampir tidak berubah (Gambar 3b ). Sebaliknya, jumlah Ni yang hilang ke dalam elektrolit terus meningkat. Namun, total kehilangan Ni dalam elektrolit secara signifikan lebih sedikit daripada yang ada dalam 7 M KOH murni (Gambar 3a ). Prajenuhan ion Fe 3+ dalam elektrolit mencegah pembubaran ion logam lebih lanjut, menjaga spesies Fe tetap berada di elektroda. Kami juga mengukur ICP-OES pada elektrolit bekas yang diganti setiap 12 jam selama uji ketahanan arus konstan pada suhu 353 K dalam 7 M KOH pada Gambar S9, Informasi Pendukung. Hal ini menunjukkan bahwa hilangnya Ni dan Fe terjadi pada operasi arus konstan, tetapi jumlah yang hilang relatif rendah. Hasil ini menunjukkan hilangnya Ni dan Fe menyebabkan degradasi.
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Jumlah Fe dan Ni yang hilang dalam elektrolit diperkirakan dari ICP-OES pada elektrolit bekas yang diganti setiap 12 jam selama uji ketahanan on/off pada suhu 353 K dalam 7 M KOH a) tanpa atau b) dengan Fe(NO 3 ) 3 jenuh . Waktu perjalanan potensial OER pada 600 mA cm −2 juga disajikan. Volume elektrolit selama pengukuran adalah 80 mL.
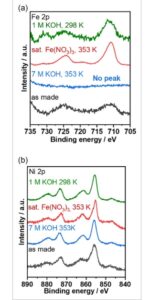
Untuk mengeksplorasi perubahan spesies permukaan, spektroskopi fotoelektron sinar-X ex situ di daerah Fe 2p dan Ni 2p dilakukan ( Gambar 4 a,b , berturut-turut). Sampel yang diperiksa dibagi menjadi dua kategori: sampel yang dibuat apa adanya dan sampel yang mengalami uji siklus potensial ekstensif selama 60 jam dalam 7 M KOH pada 353 K dengan atau tanpa kehadiran Fe(NO 3 ) 3 jenuh , dan dalam 1 M KOH pada 298 K. Sampel apa adanya menunjukkan puncak menonjol dari Fe 3+ . Namun, setelah uji siklus potensial tanpa Fe(NO3)3 jenuh , puncak – puncak ini menghilang seluruhnya dalam sampel yang diuji dalam KOH 7 M pada suhu 353 K, tetapi tetap ada dalam sampel yang diuji dalam KOH 1 M pada suhu 298 K. Mengingat bahwa degradasi parah tidak diamati dalam KOH 1 M meskipun suhunya (Gambar 1b ), ini mengonfirmasi bahwa pelarutan spesies Fe selama uji ketahanan sangat dipengaruhi oleh konsentrasi ion hidroksida. Mungkin, spesies Fe cenderung membentuk kompleks logam yang larut dengan ion hidroksida dalam larutan yang sangat basa, seperti yang dibuktikan dengan kuat selama uji siklus potensial yang ekstensif. Siklus potensial awal menyebabkan pelepasan elektrokatalis, yang menyebabkan kelebihan potensial yang lebih tinggi yang diperlukan untuk mencapai kerapatan arus yang ditetapkan. Di bawah kelebihan potensial yang begitu tinggi, Fe mungkin telah teroksidasi berlebihan menjadi Fe6 + , membentuk ion FeO42− yang larut dalam larutan yang sangat basa. [ 32 – 34 , 50 ] Sebaliknya, siklus redoks yang konsisten antara Ni(OH) 2 dan NiOOH dapat mendorong pemisahan FeOOH dari matriks Ni. FeOOH, setelah terpapar, dapat larut dalam larutan yang sangat basa. Menariknya, di hadapan ion Fe 3+ jenuh , puncak yang diamati dari spesies Fe 3+ tetap ada bahkan setelah diuji dalam KOH 7 M pada 353 K. Ini sesuai dengan karakteristik kemiringan Tafel dari NiFeO x , yang dipertahankan setelah uji ketahanan (Gambar S1b, Informasi Pendukung). Dengan demikian, keberadaan Fe pada elektroda mengisyaratkan bahwa pelarutan spesies Fe dapat terhenti di hadapan ion Fe 3+ jenuh . Di wilayah Ni 2p (Gambar 4b ), energi pengikatan puncak tetap tidak berubah baik sebelum dan sesudah pengujian dalam berbagai kondisi. Penentuan puncak pada spektrum Ni 2p dan Fe 2p menantang karena banyaknya satelit. Oleh karena itu, mengikuti laporan sebelumnya, [ 28 ] pemasangan dilakukan pada daerah Ni 2p 3/2 dan Fe 2p 3/2 dan dibahas pada Gambar S10, Informasi Pendukung.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Analisis XPS ex situ untuk a) daerah Fe 2p dan b) daerah Ni 2p untuk NiFeO x sebagaimana dibuat (hitam), setelah pengujian siklus potensial ekstensif (3200 siklus) dalam 7 M KOH pada suhu 353 K (biru), dalam 7 M KOH dengan Fe(NO 3 ) 3 jenuh pada suhu 353 K (merah), dan dalam 1 M KOH pada suhu ruangan (hijau).
Untuk menyelidiki struktur lokal di sekitar Fe dalam jumlah besar, kami melakukan spektroskopi penyerapan sinar-X ex situ pada Fe K-edge. Spektroskopi ini dilakukan pada NiFeO x pada busa Ni setelah aktivasi selama 15 menit pada 600 mA cm −2 dan 353 K dalam 7 M KOH (diaktifkan) dan setelah operasi arus konstan selama 10 jam pada 600 mA cm −2 dan 353 K dalam 7 M KOH dengan atau tanpa Fe(NO3)3 jenuh ( dicatat sebagai ‘habis dengan atau tanpa Fe3 + jenuh ‘, berturut-turut). Kami memilih untuk tidak melakukan pengukuran Ni K-edge karena adanya Ni metalik dalam substrat. Perbandingan spektrum struktur dekat tepi sinar-X (XANES) ada di Gambar S11a,b, Informasi Pendukung. Sementara garis putih dalam sampel NiFeO x tampak sedikit lebih positif daripada yang ada di referensi α -FeOOH, kami mendalilkan bahwa Fe tetap sebagai Fe3 + dalam jumlah besar. Hal ini karena penurunan intensitas garis putih tidak diamati seperti dalam kasus La 1−x Sr x FeO 4 . [ 51 – 54 ] Perbedaan penting diamati dalam analisis struktur halus penyerapan sinar-X yang diperluas (EXAFS). Spektrum EXAFS yang ditransformasikan fourier (FT-EXAFS) (Gambar S11c, Informasi Pendukung) mengungkapkan pemendekan ikatan M O dan M M setelah reaksi dengan Fe(NO 3 ) 3 jenuh . Pemendekan tersebut menunjukkan kemungkinan pembentukan struktur berbagi tepi antara oktahedra [FeO 6 ] dan [NiO 6 ] dalam NiOOH, yang memiliki panjang ikatan M O yang lebih pendek. [ 51 ] Reaksi dengan adanya Fe 3+ jenuh dapat menghasilkan interaksi yang lebih kuat antara Ni dan Fe melalui rekonstruksi, sehingga meningkatkan stabilitas. Hasil pemasangan pada spektrum FT-EXAFS dibahas lebih lanjut dalam Gambar S12 dan Tabel S4, Informasi Pendukung.
Gambar mikroskop elektron pemindaian dari substrat busa Ni polos, NiFeO x pada busa Ni sebagaimana dibuat, dan NiFeO x pada busa Ni setelah uji siklus potensial selama 60 jam dalam 7 M KOH dengan dan tanpa Fe(NO 3 ) 3 jenuh , ditunjukkan pada Gambar S13, Informasi Pendukung. Setelah sintesis hidrotermal NiFeO x pada substrat busa Ni, lapisan elektrokatalis terlihat dalam sampel sebagaimana dibuat (Gambar S13b, Informasi Pendukung). Setelah uji siklus potensial dalam 7 M KOH tanpa ion Fe 3+ jenuh (Gambar S13c, Informasi Pendukung), struktur permukaan menyerupai substrat polos tanpa lapisan elektrokatalis. Ini menunjukkan bahwa elektrokatalis yang diendapkan menghilang selama uji ketahanan. Setelah pemeriksaan lebih dekat pada permukaan elektroda, ditemukan lebih kasar daripada substrat polos. Ini menunjukkan bahwa substrat Ni sebagian terlarut selama uji ketahanan. Namun, setelah uji ketahanan dengan adanya ion Fe 3+ jenuh , lapisan katalis tampak bertahan (Gambar S13d, Informasi Pendukung).
Pada dasarnya, studi ini menjelaskan dua tahap mekanisme degradasi selama uji siklus potensial, yang berasal dari berbagai pengukuran kontrol dan pascakarakterisasi. Degradasi awal berasal dari pelepasan lapisan elektrokatalis yang tak terelakkan akibat siklus redoks antara Ni(OH) 2 dan NiOOH, yang terjadi di dekat potensi awal OER. Degradasi putaran kedua dikaitkan dengan pelarutan spesies Fe aktif ke dalam elektrolit. Memahami mekanisme degradasi ini membantu dalam menyusun strategi untuk meningkatkan daya tahan elektroda, seperti prasaturasi ion Fe 3+ dalam elektrolit. Sementara pendekatan ini membantu mencegah degradasi kedua yang terkait dengan hilangnya spesies Fe aktif, keberadaan ion Fe 3+ dapat memiliki efek buruk pada katode, seperti elektrodeposisi katoda pada elektrokatalis reaksi evolusi hidrogen. [ 55 ] Untuk sistem elektrolisis air yang tahan lama dengan adanya ion Fe 3+ jenuh , katoda yang tahan terhadap ion pengotor diantisipasi akan dikembangkan melalui pengendapan lapisan membran perm-selektif seperti CrO x , CeO x , dan TiO x . [ 29 , 56 , 57 ] Lapisan-lapisan ini diketahui memungkinkan difusi molekul-molekul kecil, termasuk air, ion hidroksida, dan hidrogen, sambil mencegah molekul yang lebih besar dan spesies yang bermuatan tinggi. Karena kerapatan arus operasi dalam laporan sebelumnya dibatasi hingga 10 mA cm −2 , penggunaan lapisan-lapisan ini dalam rentang kerapatan arus tinggi (>100 mA cm −2 ) masih harus dieksplorasi, yang berada di luar cakupan studi khusus ini.
3 Kesimpulan
Studi ini menguji degradasi NiFeO x berdasarkan protokol ketahanan on/off dengan siklus sapuan potensial ekstensif dalam 7 M KOH pada 80 °C. Ditemukan bahwa ada degradasi signifikan selama siklus redoks dengan sapuan potensial ekstensif, terutama dalam kondisi yang sangat basa. Ini sangat kontras dengan operasi stabil yang diamati dalam mode arus konstan. NiFeO x menunjukkan dua tahap degradasi dalam protokol siklus redoks. Tahap awal degradasi berasal dari hilangnya situs aktif elektrokimia karena pelepasan katalis setelah perubahan volume selama siklus redoks antara Ni(OH) 2 dan NiOOH. Tahap degradasi berikutnya dikaitkan dengan pelarutan Fe bertahap dari elektroda setelah siklus redoks beroperasi. Itu sepenuhnya dimitigasi ketika pengujian dalam larutan jenuh Fe karena spesies Fe sebagai situs aktif pada elektroda tidak larut lebih lanjut ke dalam larutan dan mempertahankan kerapatan arus tinggi bahkan dengan siklus redoks yang ekstensif. Temuan ini menjelaskan proses degradasi NiFeO x , katalis patokan, dalam kondisi industri dan menyarankan cara untuk memperbaikinya. Mereka juga menyediakan panduan untuk mengeksplorasi material baru untuk elektrolisis yang tahan lama.
4 Eksperimental
Bahan dan Bahan Kimia
Busa Ni dengan ketebalan 1,6 mm, ukuran pori 0,5 mm, 48−52 sel per inci, dan 7500 m 2 m −3 , serta kawat Pt, diperoleh dari Nilaco Corporation. Elektroda referensi (RE) Ag/AgCl, Hg/HgO (1 M NaOH) jenuh KCl diperoleh dari BAS Inc. Kecuali dinyatakan lain, semua bahan kimia dengan kemurnian berikut bersumber dari FUJIFILM-Wako: etanol-IP (86%), KOH (99,99% mutu semikonduktor dari Sigma-Aldrich untuk elektrolit KOH 1 M, 85 wt% dari FUJIFILM-Wako untuk elektrolit KOH 7 M), natrium bikarbonat (99,7% dari Sigma-Aldrich), Ni(NO 3 ) 2 ·6H 2 O (99,9%), Fe(NO 3 ) 3 ·9H 2 O (99,9%), CO(NH 2 ) 2 (Urea, reagen ACS, 99,0%–100,5% dari Sigma-Aldrich), dan Asam klorida (35–37 wt%). Larutan standar Fe (Fe 1000) dan larutan standar Ni (Ni 100) juga digunakan. Zirfon Pearl UTP 500+ dibeli dari Agfa. Gas Ar (99,9999%) dan O 2 (99,99995%) digunakan, dan air ultramurni (18,2 MΩ cm) diperoleh dari PURELAB flex3 (ELGA) untuk menyiapkan semua larutan berair.
Persiapan Elektroda
Busa NiFeO x /Ni : Busa NiFeO x /Ni disintesis melalui perlakuan hidrotermal menggunakan metode yang diuraikan dalam literatur sebelumnya. [ 43 ] Awalnya, 1,96 mmol Ni(NO 3 ) 2 , 1,88 mmol Fe(NO 3 ) 3 , dan 9,50 mmol CO(NH 2 ) 2 digabungkan dalam 152 mL air ultramurni (18,2 MΩ cm), dengan pengadukan kuat pada suhu kamar selama 10 menit. Larutan ini kemudian dipindahkan ke autoklaf baja tahan karat berlapis Teflon 190 mL tempat substrat busa Ni direndam. Autoklaf tertutup dimasukkan ke dalam oven dan diberi perlakuan panas pada suhu 393 K selama 12 jam.
Busa FeO x /ECA–Ni, Busa FeO x /Ni : Busa FeO x /ECA–Ni dan busa FeO x /Ni disintesis menggunakan perlakuan elektrodeposisi, mengikuti metode yang dijelaskan dalam literatur. [ 49 ] Substrat Ni mengalami aktivasi elektrokimia menurut protokol yang dilaporkan sebelumnya. [ 44 ] Sebelum aktivasi, substrat Ni dicuci secara menyeluruh dengan etanol dan air ultramurni lalu segera digunakan. Prosedur aktivasi elektrokimia melibatkan pemrosesan dalam 1,5 mol kg −1 K-karbonat pada pH 10,5 dan 340 K dengan gelembung O2. Konfigurasi tiga elektroda dengan kawat Pt dan Ag/AgCl (jenuh dengan KCl) masing-masing berfungsi sebagai penghitung dan RE. Setelah merendam substrat Ni dalam elektrolit, potensial rangkaian terbuka selama 20 menit digunakan, diikuti oleh kronopotensiometri (CP) pada +50 mA cm −2 selama 25 menit. Siklus ini diulang tiga kali. Ini kemudian diikuti oleh kronoamperometri (CA) pada 1,0 V versus RHE selama 10 menit, kemudian CP pada +50 mA cm −2 selama 25 menit, diulang dua kali. Pasca aktivasi elektrokimia, substrat dilepaskan dan berulang kali dibilas dengan air ultramurni. Busa Ni yang diaktifkan selanjutnya disebut sebagai busa ECA–Ni. Bak pengendapan FeO x berisi 5 mM Fe(NO 3 ) 3 ·9H 2 O. Deposisi elektrokimia dilakukan dengan busa Ni murni yang telah dibersihkan atau busa ECA–Ni dengan merendam substrat dalam bak pengendapan yang telah disiapkan dan segera menerapkan kerapatan arus konstan sebesar −10 mA cm −2 selama 1 jam pada suhu ruangan.
Busa NiFeO x /Ni yang Dilapisi Celup : Busa NiFeO x /Ni disintesis menggunakan perlakuan pelapisan celup yang dijelaskan dalam literatur. [ 48 ] Pertama, busa Ni disonikasi dalam larutan HCl 1 M selama 10 menit untuk menghilangkan lapisan oksida permukaan. Ini diikuti dengan pembilasan berurutan dengan air murni dan etanol. Setelah dibersihkan, busa Ni direndam dalam larutan berair FeCl 3 50 mM selama 10 detik. Kemudian, busa dikeluarkan dan dianil pada pelat panas pada suhu 300 °C selama 30 menit. Proses ini diulang empat kali.
Pengukuran Elektrokimia
Sistem tiga elektroda digunakan untuk pengukuran elektrokimia. Dalam semua pengukuran setengah sel, kawat Pt berfungsi sebagai elektroda lawan (CE). Elektroda Ag/AgCl, yang dijenuhkan dengan KCl, digunakan sebagai RE saat mensintesis ECA–Ni. Namun, RE Hg/HgO (1 M NaOH) digunakan dalam kondisi pH basa. Gas yang ditentukan (O2 untuk OER dan Ar untuk pengukuran efisiensi faradaik) dipasok ke sel sebelum dan selama semua pengukuran. Sistem potensiostat 16 saluran, kelas penelitian (VMP3; BioLogic Science Instruments) atau sistem potensiostat 1 saluran (SP-150; BioLogic Science Instruments) digunakan untuk pengukuran elektrokimia. Semua hubungan arus-potensial yang ditetapkan dalam artikel ini dikoreksi iR menggunakan pengukuran nilai impedansi, yang berada pada ≥100 kHz, amplitudo 10 mV. Sel yang terbuat dari polimetilpentena (BAS Inc.) digunakan untuk larutan basa. Untuk mempertahankan suhu konstan pada 298 K untuk RE, soket RE Hg/HgO, yang diisi dengan 1 M NaOH oleh BAS Inc., digunakan sebagai jaket tambahan. Suhu elektrolit diukur dengan sensor suhu berlapis fluororesin (SF-E-050-ASP, HR1500E, ANRITSU METER CO., LTD.). Bak manik aluminium (NHP-B077, NISSIN) memanaskan sel untuk mencapai suhu elektrolit yang diinginkan.
Karakterisasi
Gambar mikroskop elektron pemindaian dan spektroskopi sinar-X dispersif energi diambil menggunakan JEOL JSM IT-800 yang dilengkapi dengan ULTIM MAX. XAS dilakukan pada garis sinar BL14B2 di SPring-8 di Hyogo, Jepang. Kami menggunakan mode transmisi untuk sampel referensi, sementara sampel elektroda diperiksa dalam mode fluoresensi dengan detektor solid-state sinar-X. Energi dikalibrasi menggunakan sebagian dari langkah tepi K dari pelat logam, dengan E0 Fe ditetapkan pada 7112 eV. Data yang diperoleh dianalisis menggunakan perangkat lunak Athena.
Spektroskopi fotoelektron sinar-X (XPS) dilakukan dengan JEOL JPS-9030 menggunakan anoda Al pada 300 W, 12 kV, dan 25 mA. Semua data dikalibrasi dengan C1s pada 284,6 eV, yang berfungsi sebagai standar internal. Untuk pengukuran ICP-OES, kami menggunakan Thermo iCAP PRO series ICP-OES. Untuk menyiapkan larutan untuk ICP, kami mengambil 1 mL endapan yang mengandung elektrolit bekas. Ini pertama-tama diencerkan 100 kali dengan H2O dan kemudian diasamkan dengan 0,2 mL larutan HCl (35 wt%) untuk melarutkan endapan.





Tinggalkan Balasan