Abstrak Grafis
Studi ini mengisi kesenjangan kinerja elektrolisis CO yang disebabkan oleh penskalaan elektroliser menggunakan perangkat penguatan elektroda, pengoptimalan laju aliran, dan manajemen panas. Pendekatan ini menghasilkan tumpukan elektroliser 580 W dengan efisiensi Faradaic produk multikarbon sekitar 80%.

Abstrak
Implementasi elektrolisis karbon monoksida (CO) skala industri menyediakan rute berkelanjutan menuju bahan bakar dan bahan kimia terbarukan. Namun, peningkatan skala proses menghadapi tantangan dalam mempertahankan efisiensi Faradaic (FE) dan kerapatan arus yang tinggi. Di sini, kami mengatasi masalah ini dengan memperkuat lapisan difusi gas (GDL), mengoptimalkan laju aliran CO, dan meningkatkan manajemen panas. Ini memungkinkan kami untuk mengisi kesenjangan kinerja antara tumpukan elektroliser yang berbeda dari 5 cm 2 hingga 3×50 cm 2 . Di seluruh rentang skala ini, kami melaporkan FE ~80% untuk produk multikarbon (C 2+ ) pada 500 mA cm −2 , dan daya puncak mencapai 580 W, 80 kali lipat dari elektroliser 5 cm 2 . Pekerjaan ini memberikan panduan praktis untuk mengembangkan elektrolisis CO dari sains bangku hingga teknologi produksi kimia industri.
Perkenalan
Reaksi reduksi CO 2 dan CO elektrokimia (CO (2) RR) menawarkan jalur yang menjanjikan menuju sintesis kimia emisi nol-bersih. 1 – 3 Kemajuan signifikan telah dibuat dalam CORR skala laboratorium, mencapai FE produk C 2+ yang tinggi lebih dari 80% pada kerapatan arus yang relevan secara industri. 4 – 7 Kemajuan ini pada skala laboratorium biasanya dilakukan dengan desain katalis berkinerja tinggi, 8 – 10 optimasi lingkungan mikro, 11 , 12 dan terkadang rekayasa elektroliser. 13 – 15 Namun, pengurangan efisiensi Faradaic (FE), kerapatan arus, dan efisiensi energi (EE) dari skala kecil ke skala besar sering diamati saat menskalakan sel ke area elektroda yang lebih besar dan daya yang lebih tinggi. 16 , 17 Misalnya, Nelson et al. menemukan bahwa penskalaan elektroliser CO 2 dari sel skala lab 5 cm 2 ke sel skala pilot 800 cm 2 mengakibatkan penurunan ~20 % dalam selektivitas etilen (C 2 H 4 ) dan peningkatan evolusi hidrogen (H 2 ) karena kompresi elektroda yang tidak seragam dan ketersediaan CO 2 lokal yang dipengaruhi aliran . 13 Tantangan-tantangan ini meninggalkan rintangan yang signifikan untuk menerapkan CO (2) RR dalam industri kimia, yang menyoroti perlunya optimalisasi lebih lanjut dari desain sel, fabrikasi elektroda, dan kondisi operasional untuk menjembatani kesenjangan antara aplikasi skala lab dan skala industri.
Ketidaksepakatan dalam metrik kinerja CO (2) RR biasanya berasal dari perubahan kondisi pengoperasian selama penskalaan elektroliser. 18 , 19 Misalnya, mengoperasikan CO (2) RR pada skala yang lebih besar meningkatkan penurunan tekanan fase uap, 13 , 14 dan dengan demikian, elektrolit dapat menyusup ke GDL dengan lebih mudah, yang menyebabkan pembanjiran elektroda lebih cepat. Selain tekanan internal, distribusi CO (2) , yang dipengaruhi oleh laju alirannya, juga penting untuk mencapai FE tinggi pada kerapatan arus tinggi. 20 , 21 Hasil penting lain dari penskalaan elektroliser CO (2) adalah efek panas. 22 , 23 Saat arus total meningkat, proses pemanasan Joule (I 2 R) menjadi tidak dapat diabaikan. Bersamaan dengan itu, CO (2) RR berubah menjadi proses eksotermik pada potensial di atas tegangan termalnetral. 24 , 25 Akibatnya, suhu operasi meningkat, berdampak pada persaingan antara CO (2) RR dan reaksi evolusi H 2 kompetitif (HER). 26 , 27
Dalam studi ini, kami fokus pada pengisian kesenjangan kinerja yang disebabkan oleh penskalaan elektroliser. Mengingat bahwa elektrolisis CO ditemukan lebih layak secara ekonomi daripada CO 2 RR dalam banyak penilaian tekno-ekonomi terkini, 28 – 30 kami fokus pada peningkatan skala elektroliser CO. Kami meningkatkan FE produk dalam sel MEA tunggal 50 cm 2 pada kerapatan arus dari 100 hingga 500 mA cm −2 agar sebanding dengan yang ada dalam elektroliser 5 cm 2 menggunakan GDL yang diperkuat, laju aliran CO yang dioptimalkan, dan manajemen panas. Kami melaporkan FE produk C 2+ sebesar ~85 % pada 500 mA cm −2 dan dalam sel tunggal 50 cm 2 . Kami selanjutnya meningkatkan skala sel ke tumpukan 3×50 cm 2 dan memperoleh FE sebesar ~75 % untuk produk C 2+ pada 500 mA cm −2 . Daya yang sesuai adalah 580 W, yang berarti peningkatan 80 kali lipat dibandingkan dengan elektroliser 5 cm2 .
Bagian Eksperimen
Elektroda difusi gas yang diperkuat (GDE) disiapkan dengan menyemprotkan tinta karbon hitam (CB) yang dicampur dengan dispersi politetrafluoroetilena (PTFE) (dispersi 60 wt.%, Aladdin) ke kertas karbon komersial. Secara khusus, tinta PTFE-CB disiapkan dengan mencampur 0,1 g CB (Vulcan XC-72R, SCI Materials Hub) dengan PTFE (25% dari massa CB) dalam 50 mL metanol. Setelah ultrasonikasi selama 2 jam, tinta disemprotkan ke udara ke lapisan difusi gas (GDL) (Sigracet 28 BC, SCI Materials Hub) pada suhu 60 °C. GDL yang diperkuat kemudian disinter dalam tungku muffle pada suhu 300 °C selama 10 menit. Untuk meningkatkan sifat hidrofobisitas, lapisan PTFE disemprotkan ke bagian belakang elektroda yang diolah.
Katoda dibuat dengan menyemprotkan tinta katalis ke GDL yang diperkuat, diikuti dengan melapisi lapisan CB tambahan. Tinta katalis dibuat dengan mendispersikan 400 mg nanopartikel Cu dan 100 μL ionomer Nafion (Sigma Aldrich, 5 wt.% dalam alkohol alifatik rendah dan air) dalam 25 mL metanol. Tinta CB dibuat dengan mendispersikan 100 mg CB dan 100 μL ionomer Nafion dalam 25 mL metanol. Baik tinta Cu maupun tinta CB diultrasonikasi selama 2 jam sebelum disemprotkan udara secara berurutan ke GDL yang diperkuat pada suhu 60 °C untuk membuat katoda.
Anoda disiapkan dengan elektrodeposisi hidroksida NiFe. Elektroda ini digunakan untuk CO (2 )RR dalam publikasi sebelumnya. 31 Busa nikel (0,3 mm, Suzhou Suke Lean Instrument Co., Ltd) direndam dalam larutan yang mengandung 3 mM Ni(NO 3 ) 2 ⋅6H 2 O (Sigma Aldrich) dan 3 mM Fe(NO 3 ) 3 ⋅9H 2 O (Sigma Aldrich). Selama proses elektrodeposisi, kawat platinum digunakan sebagai elektroda lawan, dan Ag/AgCl digunakan sebagai elektroda referensi. Stasiun kerja elektrokimia (DH7002 A, Donghua Analytical Instruments (Taizhou) Co., Ltd.) digunakan untuk menerapkan potensial −1,0 V vs. Ag/AgCl selama 5 menit. Setelah pengendapan, elektroda NiFe dibilas dengan aseton dan air deionisasi.
Percobaan elektroreduksi CO dilakukan dalam elektroliser rakitan elektroda membran celah nol (MEA) dengan saluran aliran berkelok-kelok. Untuk elektrolisis skala kecil, katodenya adalah elektroda Cu−C, membran penukar anion (AEM) adalah Fumasep FAA-3-50 (SCI Materials Hub), dan anodanya adalah elektroda NiFe. Elektrolitnya adalah 1 M KOH. Katode disuplai dengan CO yang dilembabkan pada laju aliran 40 sentimeter kubik standar per menit (sccm), dan sisi anoda memiliki elektrolit yang disirkulasikan pada 20 mL min −1 . Pengukuran elektrokimia dilakukan menggunakan potensiostat DH7002 A (Donghua Analytical Instruments (Taizhou) Co., Ltd.) dengan pengukuran kronoamperometri (V~t) yang dilakukan dalam kisaran 100–500 mA cm −2 . Untuk elektrolisis skala besar, elektroda Cu−C yang sama, Fumasep FAA-3-50 AEM, dan anoda NiFe dengan area yang lebih besar digunakan. Elektrolitnya adalah 1 M KOH. Katoda disuplai dengan CO yang dilembabkan pada berbagai laju aliran, dan laju sirkulasi anolit adalah 100 mL min −1 . Air pendingin yang bersirkulasi digunakan untuk eksperimen dengan manajemen panas. Pengukuran elektrolisis skala besar dilakukan dengan menggunakan potensiostat HE80 (Ivium Technologies BV) dengan pengukuran kronoamperometri (V~t) yang dilakukan dalam kisaran 100–500 mA cm −2 . Resistansi ohmik (R s ) ditentukan melalui pengukuran impedansi AC yang dilakukan dengan menggunakan stasiun kerja elektrokimia DH7001 (Tabel S1).
Produk gas dianalisis dengan kromatografi gas inline (GC2060, Wuhao Information Technology (Shanghai) Co., Ltd.). Detektor konduktivitas termal (TCD) menganalisis produk gas (CO dan H 2 ) yang dihasilkan di outlet katode. Detektor ionisasi nyala (FID) mendeteksi produk gas (C 2 H 4 ) yang dihasilkan di outlet katode. Sampel cairan dianalisis menggunakan kromatografi cairan kinerja tinggi (HPLC, Vanquish Core, ThermoFisher) dengan kolom Aminex HPX-87H (Bio-rad). Produk gas dan cairan dikalibrasi dengan metode standar eksternal. Nilai yang dilaporkan adalah rata-rata dari sedikitnya tiga replikasi dengan deviasi standar sebagai batang kesalahan. Metode standar eksternal digunakan untuk kalibrasi konsentrasi, di mana larutan standar produk dengan konsentrasi yang berbeda dianalisis untuk membentuk kurva kalibrasi (Gambar S1).
FE untuk produk gas dihitung dengan menggunakan persamaan berikut:
![]()
Di mana F merupakan konstanta Faraday, n merupakan jumlah elektron yang ditransfer, V gas merupakan laju aliran gas, c merupakan konsentrasi produksi gas yang terdeteksi, i merupakan arus total, dan V m merupakan volume molar satuan dari produk yang diinginkan. Laju aliran pada outlet katode diukur menggunakan meteran aliran gelembung.
FE untuk produk cair dihitung sebagai berikut:
![]()
Di mana n produk menyatakan jumlah total mol produk dan Q = i × t menyatakan total muatan yang lewat selama pengukuran.
Perhitungan efisiensi karbon single-pass (SPCE) adalah sebagai berikut:
![]()
Di mana j melambangkan kerapatan arus parsial terhadap suatu produk tunggal atau sekelompok produk, dan N melambangkan jumlah elektron yang ditransfer untuk membentuk 1 mol produk target.
Perhitungan EE adalah sebagai berikut:
![]()
Di manamathematical equation mewakili potensi sel termodinamika untuk produk (etilenmathematical equation =1,06 V; etanolmathematical equation =1,04 V; propanolmathematical equation =1,03 V; asetatmathematical equation =0,78V).
Hasil dan Pembahasan
Kami pertama-tama membandingkan kinerja CORR reaktor MEA tunggal dengan area elektroda yang berbeda (yaitu, 5 cm 2 vs. 50 cm 2 ). Elektroliser celah nol 5 cm 2 memiliki medan aliran berkelok-kelok tunggal (Gambar 1a dan S2), sedangkan elektroliser sel tunggal 50 cm 2 dirancang dengan empat jalur berkelok-kelok (Gambar 1b dan S3) untuk mendistribusikan CO di seluruh permukaan elektroda secara merata. 13 – 15 Percobaan dilakukan dengan menggunakan laju aliran konstan yang dinormalisasi area elektroda sebesar 8 mL min −1 cm −2 tanpa modifikasi GDL dan manajemen panas.
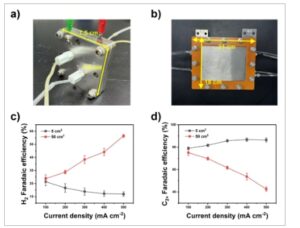
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Elektroliser MEA CO tunggal pada skala yang berbeda. (a dan b) Gambar elektroliser 5 dan 50 cm 2 dengan area aktif 5 cm 2 . (c dan d) Perbandingan produk FE H 2 dan C 2+ yang diperoleh menggunakan elektroliser 5 cm 2 dan 50 cm 2 . Batang galat menunjukkan deviasi standar dari sedikitnya tiga pengukuran independen.
Baik elektroliser 5- dan 50-cm 2 menyajikan H 2 FE yang serupa (20-25%) dan C 2+ produk FE (75-80%) pada 100 mA cm −2 (Gambar 1c dan d ). Seiring dengan peningkatan kerapatan arus, kedua elektroliser CO berperilaku berbeda, meskipun penggunaan AEM dengan area yang lebih besar menurunkan potensi sel penuh dari elektroliser 50 cm 2 dibandingkan dengan yang 5 cm 2 pada kerapatan arus yang diterapkan sama (Gambar S4). Secara khusus, H 2 FE dalam elektroliser 5 cm 2 terus menurun dari 21±3 % pada 100 mA cm −2 menjadi 12±2 % pada 500 mA cm −2 (Gambar 1c ). Pada saat yang sama, produk C 2+ FE dalam reaktor ini memiliki sedikit peningkatan dari 79±1 % menjadi 87±2 %. Sebaliknya, H 2 FE dengan cepat naik dari 24±3 % menjadi 57±1 %, dan untuk produk C 2+ turun dari 75±3 % menjadi 43±2 % ketika kerapatan arus secara bertahap mendekati 500 mA cm −2 (Gambar 1c dan d ). Kerapatan arus parsial produk C 2+ mencapai 435±5 mA cm −2 dalam elektroliser 5 cm 2 ; namun, dalam sel tunggal 50 cm 2 , kerapatan arus dibatasi hingga di bawah 215±15 mA cm −2 (Gambar S5). Penurunan aktivitas yang diamati pada elektroda 50 cm 2 tidak muncul dari perbedaan resistansi membran, resistansi kontak elektroda, dan resistansi larutan, seperti yang ditunjukkan oleh resistansi ohmik yang sebanding dari kedua sel (Tabel S1). Kami juga mengonfirmasi bahwa luas permukaan aktif elektrokimia (ECSA) katalis tetap konsisten untuk elektroda dengan luas geometri yang berbeda, dan dengan demikian menyingkirkan kemungkinan pengurangan kepadatan situs aktif karena pelapisan semprot yang tidak merata pada lapisan katalis (Gambar S6).
Karakterisasi elektroda pasca-reaksi mengungkap adanya banjir GDL dalam kasus reaktor 50 cm 2 yang divalidasi oleh penetrasi elektrolit ke bagian belakang GDL. Hal ini tidak terjadi pada elektroda 5 cm 2 . Sudut kontak statis antara tetesan air dan elektroda berkurang dari 150° pada sampel yang disiapkan menjadi 93° setelah elektrolisis CO (Gambar S7), yang menguatkan hilangnya sifat hidrofobisitas akibat banjir GDL dalam elektroliser 50 cm 2 . Konsekuensi dari banjir GDL adalah lapisan batas yang menebal yang menghambat difusi CO ke dalam lapisan katalis dan mendukung HER. 32 – 35
Kami kemudian berusaha mengatasi masalah banjir dengan memperkuat GDL dengan lapisan PTFE tambahan (Gambar 2a dan S8). Beban massa lapisan PTFE tambahan ini adalah 1 mg cm −2 . Elektroda yang diperkuat secara efektif menekan HER, menunjukkan penurunan 10% dalam H 2 FE di seluruh rentang arus (Gambar 2b ). Sementara itu, FE untuk produk C 2+ meningkat dengan besaran yang sama, dan pada 500 mA cm −2 mencapai 57±1 % pada elektroda yang diperkuat (Gambar 2b ). Sudut kontak tetesan air sebesar 115° diamati pada elektroda yang diperkuat setelah elektrolisis CO (Gambar S9), yang menunjukkan peningkatan ketahanan banjir.
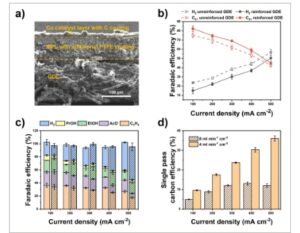
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Perlakuan elektroda yang diperkuat dan pengendalian pasokan CO. (a) Gambar mikroskop elektron pemindaian (SEM) penampang melintang dari GDE yang diperkuat. (b) Perbandingan FE dari produk H 2 dan C 2+ untuk GDE yang diperkuat dan GDE yang tidak diperkuat. (c) Perbandingan FE pada laju alir yang berbeda. (d) Perbandingan SPCE pada laju alir yang berbeda. Batang galat menunjukkan deviasi standar dari sedikitnya tiga pengukuran independen.
Meskipun dengan produk C 2+ FE yang dibawa dengan memperkuat GDL, celah antara area kecil dan besar tetap lebar, karena elektroda 5 cm 2 yang tidak diperkuat masih 1,5 kali lebih selektif untuk produk C 2+ daripada elektroda 50 cm 2 dengan lapisan PTFE tambahan. Kami menemukan bahwa mengurangi laju aliran CO masuk bermanfaat untuk pembentukan produk C 2+ (Gambar 2c ). Pada 8 mL min −1 cm −2 , produk C 2+ FE pada elektroda yang diperkuat adalah 45±3 %, termasuk 18±1 % untuk C 2 H 4 , 7±1 % untuk asetat (AcO − ), 18±3 % untuk etanol (EtOH), dan 3±1 % untuk n-propanol (PrOH). Menurunkan laju aliran CO masuk ke 4 mL min −1 cm −2 meningkatkan produk C 2+ FE pada 500 mA cm −2 menjadi 60±2 %, dengan 27±1 % untuk C 2 H 4 , 17±1 % untuk AcO − , 13±3 % untuk EtOH, dan 2±1 % untuk PrOH. Peningkatan ini muncul dari persilangan CO yang diinduksi oleh laju aliran total tinggi yang terhambat ke anoda (Gambar S10), yang mencegah intrusi anolit ke dalam saluran aliran katoda dan menghindari impedansi difusi CO yang dihasilkan. Peningkatan SPCE lebih dari dua kali lipat terlihat ketika kami mengurangi laju aliran CO yang dinormalisasi luas elektroda dari 8 menjadi 4 mL min −1 cm −2 (12±1% vs 36±1%, keduanya pada 500 mA cm −2 ).
Berikutnya, kami meneliti dampak manajemen panas pada kinerja elektrolisis CO (Gambar 3 ). Manajemen panas diimplementasikan dengan mengalirkan air pendingin melalui saluran masuk dan saluran keluar yang dirancang (Gambar S11). Kami memantau suhu waktu nyata dari perangkat keras elektroliser 50 cm 2 yang berjalan pada 500 mA cm −2 tanpa pendinginan sistem menggunakan kamera termal inframerah. Suhu elektrolit saluran masuk adalah ~16 °C, sementara pada posisi yang dekat dengan saluran keluar elektrolit, suhu melonjak hingga lebih dari 40 °C (Gambar 3a ). Bagian tengah pelat elektroliser berada pada sekitar 30 °C. Gradien suhu yang besar ini membatasi kerapatan arus parsial produk C 2+ hingga di bawah 300 mA cm −2 (Gambar 3c ) karena suhu yang tinggi tidak mendukung langkah penyerapan CO eksotermik 26 , 27 , 36 (Gambar 3c ). Pada potensial sel yang lebih rendah (<2,4 V), dampak pemanasan Joule dan elektrolisis eksotermik relatif kecil. Oleh karena itu, kerapatan arus parsial produk C 2+ dan H 2 sebanding untuk elektroliser dengan dan tanpa manajemen panas. Untuk elektroliser yang beroperasi dengan air pendingin, suhu di dalam perangkat lebih rendah dari 25 °C, dan gradien suhu juga menurun drastis hingga hampir 16 °C (Gambar 3b ). Selain mendorong penyerapan CO, manajemen panas juga berkontribusi untuk menjaga membran tetap terhidrasi, menawarkan jalur transfer ion dan air yang penting untuk CORR. 37 , 38 Akibatnya, peningkatan hampir 1,4× dalam kerapatan arus parsial produk C 2+ terlihat pada ~2,6 V (dari ~300 hingga ~430 mA cm −2 ). Efisiensi Faradaic yang sesuai untuk produk C 2+ pada 500 mA cm −2 dan sel ~2,6 V meningkat dari 60±2 % tanpa air pendingin menjadi lebih dari 80 % dengan air pendingin (Gambar 3d ).
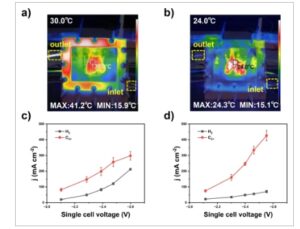
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Dampak manajemen panas. Distribusi suhu dalam elektroliser 50 cm 2 pada 500 mA cm −2 (a) tanpa (b) dengan air pendingin. Kepadatan arus parsial elektroliser 50 cm 2 (c) tanpa (d) dengan air pendingin. Batang galat menunjukkan deviasi standar dari sedikitnya tiga pengukuran independen.
Dengan menggunakan GDL yang diperkuat, laju aliran CO yang dioptimalkan, dan manajemen panas, kami merakit tumpukan elektroliser CO dan menilai kinerjanya. Kami secara progresif meningkatkan jumlah MEA, memperluas area reaksi dari 50 cm 2 menjadi 100 cm 2 lalu menjadi 150 cm 2 . Kami mengevaluasi kinerja CORR tumpukan elektroliser pada kerapatan arus yang sama dan laju aliran CO sebesar 4 mL min −1 cm −2 . Dalam sel MEA tunggal 50 cm 2 dan tumpukan, potensial sel untuk satu unit MEA sebanding pada kerapatan arus yang sama. Misalnya, potensial sel tunggal sekitar 2,2 V pada 100 mA cm −2 dan sekitar 2,5 V pada 500 mA cm −2 (Gambar S12). Pada kerapatan arus di atas 300 mA cm −2 , sel MEA tunggal 50 cm 2 dan tumpukan membutuhkan potensi yang lebih rendah daripada elektroliser 5 cm 2 untuk mencapai kerapatan arus yang sama (Gambar S9). Daya maksimum tumpukan 3×50 cm 2 adalah 580 W pada 500 mA cm −2 (Gambar 4a ), di mana kerapatan arus parsial untuk produk C 2+ adalah ~376 mA cm −2 (Gambar 4b ). Daya elektrolisis CO kira-kira 80 kali lipat dari elektroliser 5 cm 2 . Daya puncak untuk sel tunggal 50 cm 2 dan tumpukan 2×50 cm 2 masing-masing adalah ~60 dan ~250 W (Gambar 4a ). Kerapatan arus parsial produk C 2+ melebihi 400 mA cm −2 pada daya puncak (Gambar 4b ). Dalam hal FE produk, kami menemukan bahwa H 2 FE sedikit meningkat selama penskalaan elektroliser (Gambar 4c ). Pada 500 mA cm −2 , H 2 FE adalah 12±2 %, 14±2 %, 18±3 %, dan 25±2 % untuk perangkat 5, 50, 2×50, dan 3×50 cm 2 , masing-masing. Pada kerapatan arus yang sama, FE produk C 2+ adalah 87±2 % (5 cm 2 ), 85±1 % (50 cm 2 ), 82±1 % (2×50 cm 2 ), dan 75±3 % (3×50 cm 2 ). Lebih jauh lagi, pada rentang arus penuh, efisiensi energi tetap di atas 30% untuk elektroliser dengan luas 5 cm 2 , 50 cm 2 , dan 2×50 cm 2 . Untuk elektroliser 3×50 cm 2 , efisiensi energi hampir berkurang setengahnya dengan meningkatkan kerapatan arus dari 100 menjadi 500 mA cm −2(36±2 % vs. 19±1 %)% (Gambar S13). Dibandingkan dengan skala yang lebih kecil, pengurangan nyata dalam aktivitas CORR dalam tumpukan 3×50 cm 2 masih dapat dilihat. Hal ini mungkin disebabkan oleh distribusi reaktan, kerapatan arus, dan suhu yang tidak merata antara unit MEA ketika lebih banyak MEA dirakit menjadi tumpukan. Mendesain ulang koneksi antara unit MEA dapat berkontribusi untuk memecahkan masalah tersebut. Misalnya, tumpukan sel yang digunakan dalam penelitian ini mengadopsi konfigurasi tandem untuk menghubungkan setiap unit. Ini berarti potensi hanya dapat diterapkan pada dua pelat ujung, dan semua unit berbagi saluran masuk dan keluar katode yang sama. Dengan menghubungkan unit MEA secara paralel, sistem dapat dioperasikan dengan potensi yang diterapkan dan CO diumpankan secara independen, 14 , 39 – 41 yang akan meminimalkan perbedaan kondisi kerja di antara unit dan lebih jauh meningkatkan FE produk C 2+ dalam tumpukan yang lebih besar dan pada daya yang lebih tinggi.
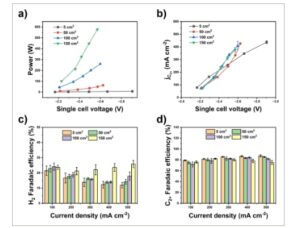
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Kinerja CORR yang dioptimalkan pada skala elektroliser yang berbeda. (a) Perbandingan daya elektrolisis CO (b) Kepadatan arus parsial produk C 2+ pada skala yang berbeda. (c) FE H 2 dan (d) FE produk C 2+ pada skala yang berbeda. Batang galat menunjukkan deviasi standar dari sedikitnya tiga pengukuran independen.
Kesimpulan
Singkatnya, kami mengamati adanya kesenjangan kinerja CORR yang disebabkan oleh penskalaan elektroliser. Kesenjangan ini dikaitkan dengan banjir GDL yang lebih mudah, perpindahan CO karena laju aliran total yang tinggi, dan pemanasan elektroliser yang didorong oleh arus besar dan potensial tinggi. Untuk mengisi kesenjangan ini, kami memperkuat elektroda, mengoptimalkan laju aliran CO masuk, dan memperkenalkan air pendingin untuk manajemen panas. Hasilnya, kami melaporkan FE produk C 2+ sebesar ~80 % pada 500 mA cm −2 pada skala dari elektroliser 5 cm 2 hingga tumpukan 3×50 cm 2 . Tumpukan 3×50 cm 2 menawarkan daya elektrolisis puncak sebesar 580 W, 80 kali lipat dari elektroliser 5 cm 2 , pada 500 mA cm −2 dan FE produk C 2+ sebesar ~75 %. Pekerjaan kami menyediakan panduan eksperimental untuk merancang sistem elektrolisis CO berskala besar dan pengoptimalan kinerja terkait, yang berkontribusi dalam mempercepat penerapan CORR dalam industri kimia.





Tinggalkan Balasan