Abstrak
Sensor polimer molekuler tercetak selektif (MIP) dibangun pada elektroda karbon cetak layar buatan laboratorium (SPCE) untuk penentuan elektrokimia asetaminofen (AP). Tinta karbon konduktif yang berbeda telah diselidiki untuk produksi SPCE. Sensor disiapkan dengan elektropolimerisasi langsung L – fenilalanin pada SPCE polos dengan adanya molekul cetakan (AP). Studi karakterisasi fisikokimia dan morfologi dari langkah-langkah persiapan sensor dilakukan, termasuk mikroskop elektron pemindaian (SEM), spektroskopi inframerah transformasi Fourier (FTIR), konduktivitas, sudut kontak, spektroskopi impedansi elektrokimia (EIS), dan voltametri siklik (CV). Dalam kondisi eksperimen yang dioptimalkan, respons voltametri pulsa diferensial (DPV) berbanding lurus dengan konsentrasi AP antara 0,2 dan 100 μmol L −1 dengan batas deteksi (LOD) 30 nmol L −1 . Sensor MIP menunjukkan kinerja analitis, selektivitas, dan stabilitas yang baik. Selain itu, metode ini berhasil digunakan untuk mengukur AP dalam sampel air yang diperkaya.
1 Pendahuluan
Limbah industri, rumah sakit, dan rumah tangga serta air limbah, dan sistem pengolahannya masing-masing, memberikan kontribusi yang signifikan terhadap kontaminasi tanah dan air dengan melepaskan berbagai jenis kontaminan, termasuk obat-obatan dan metabolitnya [ 1 , 2 ]. Topik ini semakin hadir dalam perdebatan global, dengan penekanan pada apa yang disebut kontaminan yang menjadi perhatian baru (CECs) [ 2 ]. Polutan ini telah terdeteksi di berbagai kompartemen lingkungan, terutama dalam sistem perairan dengan konsentrasi berkisar antara nanogram hingga mikrogram per liter [ 1 , 3 , 4 ]. Perilaku mereka di lingkungan dan dampaknya terhadap ekosistem belum sepenuhnya dijelaskan, yang mewakili risiko potensial bagi kesehatan manusia [ 2 ].
Populasi dunia secara progresif telah mengonsumsi obat-obatan, yang bertanggung jawab untuk meningkatkan kualitas dan harapan hidup. Meskipun demikian, obat-obatan tersebut terdaftar di antara CEC, yang dianggap persisten atau pseudo-persisten di lingkungan karena pelepasannya yang terus-menerus [ 4 , 5 ]. Acetaminophen (AP), misalnya, adalah analgesik antipiretik yang dijual bebas yang mengobati berbagai gejala, dan juga merupakan pengobatan alternatif bagi orang dengan intoleransi aspirin [ 6 ]. Obat yang banyak digunakan ini telah ada dalam pengobatan selama lebih dari 30 tahun dan telah diindikasikan untuk orang dewasa dan anak-anak [ 6 , 7 ].
Beberapa metode analisis telah digunakan untuk penentuan AP, termasuk spektroskopi, elektroforesis, kromatografi, dan elektrokimia [ 8 , 9 ]. Karena elektroaktivitas AP yang tinggi, sensor elektrokimia telah menjadi alat yang sangat baik untuk mengukur AP, menghadirkan pendekatan yang murah, sederhana, cepat, mudah dioperasikan, dan sangat sensitif untuk pemantauan lingkungan dan analisis cairan biologis. Selain itu, mereka dapat memiliki sistem yang ringkas, memungkinkan portabilitas untuk analisis di tempat [ 8 , 9 – 10 ]. Sensor elektrokimia berdasarkan elektroda sablon (SPE) telah menonjol karena kepraktisannya, biaya rendah, dan desain yang sesuai, termasuk WE, CE, dan RE yang dicetak pada permukaan yang sama, dan dalam dukungan ukuran yang diperkecil. Pembuatan ini dapat sepenuhnya diotomatisasi menggunakan mesin sablon atau teknik sablon manual, menawarkan persiapan yang murah dan praktis [ 11 ]. Selain itu, tinta konduktif dengan komposisi berbeda, terutama tinta berbasis karbon, dapat diperoleh, yang juga memungkinkan penggabungan nanomaterial karbon untuk meningkatkan kinerja elektroda karbon cetak layar (SPCE) yang diproduksi [ 12 ].
Berbagai bahan telah digunakan dalam modifikasi permukaan elektroda untuk meningkatkan selektivitasnya. Di antara mereka, polimer bercetakan molekuler (MIP) telah menerima perhatian signifikan karena kapasitasnya untuk pengenalan spesies yang telah ditentukan sebelumnya (molekul target) yang sangat selektif pada konsentrasi rendah [ 10 , 13 , 14 ]. Di antara berbagai strategi untuk sintesis MIP, elektropolimerisasi telah terbukti menjadi metode yang cepat, sederhana, serbaguna dan nyaman, karena film MIP dapat dibentuk langsung pada permukaan elektroda [ 15 , 16 – 17 ]. Analit target digunakan sebagai templat dalam metode pencetakan molekuler ini. Pada saat yang sama, monomer fungsional dielektropolimerisasi pada permukaan elektroda, diikuti oleh ekstraksi templat, menghasilkan rongga dengan ukuran dan struktur analit target. Hal ini memungkinkan terciptanya situs pengenalan molekuler selektif yang secara sterik dan kimiawi komplementer dengan analit yang diinginkan, membuatnya mampu mengikat kembali ke templat dengan selektivitas tinggi selama analisis [ 13 , 18 ].
Elektropolymerisasi memungkinkan sintesis MIP dari larutan berair dan dalam kondisi ringan, terbukti menjadi strategi hijau [ 17 ]. Selain itu, pemilihan monomer fungsional yang tepat menyediakan produksi polimer yang stabil, tidak beracun, biokompatibel, dan biodegradable, seperti polimer berbasis asam amino [ 19 ]. Poli(asam amino) telah digunakan sebagai pengubah elektroda, meningkatkan kinerja analitisnya [ 20 – 22 – 23 ]. Mereka dapat menghasilkan biokomposit yang efisien untuk struktur sensor, terutama karena gugus karboksil dan amino, bersama dengan rantai samping organik, dengan berbagai fungsi [ 19 ]. Di antara berbagai pilihan, kami menyoroti film poli(fenilalanina) yang dihasilkan oleh elektropolymerisasi untuk memodifikasi permukaan elektroda karbon [ 24 – 26 – 27 ]. Namun, sejauh pengetahuan kami, fenilalanina belum dieksplorasi dalam memproduksi MIP dengan elektrosintesis atau sebagai pengubah elektroda untuk kuantifikasi AP. Selain sintesis dan aplikasi baru, produksi film MIP ini tidak memerlukan penggunaan pelarut organik atau inisiator kimia apa pun untuk polimerisasi. Selain itu, tidak menghasilkan limbah, sehingga metode ini ramah lingkungan.
Penelitian ini bertujuan untuk memproduksi SPCE di laboratorium, dengan tinta konduktif berbasis nanomaterial karbon. SPCE yang diproduksi dengan tinta karbon terpilih dimodifikasi dengan poli( L -fenilalanina) yang dicetak secara molekuler dan dielektropolimerisasi untuk analisis voltametri AP. Langkah-langkah produksi sensor dioptimalkan dan dikarakterisasi dengan teknik fisika-kimia dan mikroskopis. Sensor MIP ini dapat diaplikasikan dalam analisis di lokasi, terutama untuk pemantauan lingkungan air dan air limbah.
2 Bagian Eksperimen
2.1 Reagen, Bahan, dan Peralatan
L -Fenilalanin (LPA), 4-hidroksiasetanilida (AP), glukosa, eritromisin, ibuprofen, asam sitrat, asam urat (UA), asam asetilsalisilat (ASA), 17 α -etinilestradiol (EE2), asam askorbat, diklofenak, siprofloksasin, kalium ferisianida, dan kalium ferrosianida dibeli dari Sigma–Aldrich. Semua reagen lainnya bermutu analitis dan digunakan tanpa pemurnian lebih lanjut. Larutan penyangga disiapkan pada konsentrasi 0,20 mol L –1 , menggunakan H 3 PO 4 /NaH 2 PO 4 (pH 3,0), CH 3 COOH/CH 3 COONa (pH 4,0; 5,0), dan NaH 2 PO 4 /Na 2 HPO 4 (pH 6,0; 7,0; 8,0), dan diaplikasikan sebagai elektrolit pendukung. Air murni dalam sistem reverse osmosis digunakan untuk menyiapkan semua larutan.
Tinta konduktif disiapkan menggunakan bahan karbon: grafit serpihan yang ditingkatkan permukaannya (SEFG, luas permukaan ≈175 m 2 g –1 , mutu 3725, Asbury Carbons, AS); bubuk grafit (GP, ukuran partikel maks. 50 μm, Dinâmica, Brasil); dan nanoplatelet grafena (GNP, M-5, luas permukaan 120–150 m 2 g –1 , ketebalan rata-rata ≈6–8 nm, diameter partikel 5 μm, XG Sciences, AS). Resin alkid (pernis kaca, Acrilex) digunakan sebagai pengikat, dan aseton (PA) sebagai pelarut. Tinta perak (Joint Metal LTDA, Brasil) digunakan untuk elektroda referensi semu.
Potensiostat Autolab PGSTAT204, dengan modul penganalisis respons frekuensi (FRA32M), yang dikelola oleh perangkat lunak NOVA 2.0, digunakan untuk pengukuran elektrokimia, termasuk voltametri siklik (CV), voltametri gelombang persegi (SWV), voltametri pulsa diferensial (DPV), dan spektroskopi impedansi elektrokimia (EIS).
SPCE buatan laboratorium dengan tinta karbon yang berbeda dikarakterisasi dengan mikroskop elektron pemindaian (SEM) menggunakan HITACHI TM3030. Sensor MIP dan NIP dikarakterisasi dengan FEG-SEM, menggunakan mikroskop JEOL JSM-6701F, dan spektroskopi inframerah transformasi Fourier reflektansi total yang dilemahkan (ATR-FTIR), menggunakan spektrofotometer Perkin Elmer Frontier. Sistem probe empat titik dan goniometer (Ossila, Inggris) digunakan untuk pengukuran konduktivitas dan sudut kontak.
2.2 Persiapan Tinta Karbon dan SPCE
Untuk memilih formulasi tinta konduktif terbaik, 12 komposisi berbeda disiapkan, memvariasikan bahan karbon dan pengikat (resin alkid), seperti yang ditunjukkan pada Tabel S1, Informasi Pendukung. Dalam produksi tinta, tiga bahan karbon yang berbeda (SEFG, GP, dan GNP) digunakan secara individual atau dikombinasikan dua per dua. Berdasarkan penelitian sebelumnya oleh kelompok penelitian kami [ 12 ], persentase massa bahan konduktif (50 dan 60%) dipilih, menetapkan jumlah bahan pengikat (masing-masing 50 dan 40%). Setiap komponen ditimbang dan dipindahkan ke botol kaca dengan tutup, kemudian menambahkan aseton dan diambil untuk dihomogenisasi dengan pengaduk magnetik (selama 90 menit) dan rendaman ultrasonik (selama 15 menit).
Tinta karbon yang diproduksi digunakan untuk memperoleh SPCE buatan laboratorium dengan teknik sablon (Gambar S1, Informasi Pendukung). Untuk ini, masker perekat berdasarkan SPE komersial (ref. DRP-110, Dropsens), yang terdiri dari susunan tiga elektroda (diameter WE = 4 mm), diproduksi pada lembaran vinil perekat (0,1 mm) menggunakan printer pemotong Graphtec CE5000. Masker elektroda direkatkan di bawah lembaran polivinil klorida (PVC) (0,30 mm). Tinta karbon diendapkan dengan benar pada masker, lalu perekatnya dihilangkan, sehingga diperoleh SPCE. Kemudian, tinta perak (Ag) diendapkan pada posisi elektroda referensi semu. Agar tinta konduktif benar-benar kering, elektroda disimpan dalam kondisi sekitar selama sekitar 24 jam. Akhirnya, masker perekat isolasi direkatkan di bawah konektor untuk membatasi area aplikasi sampel, lalu elektroda dipotong satu per satu dan siap digunakan.
Untuk memilih tinta terbaik, SPCE yang diperoleh dievaluasi dalam larutan AP dengan SWV (frekuensi 10 Hz, amplitudo pulsa 10 mV, dan kenaikan 2 mV).
2.3 Persiapan Sensor MIP dan NIP
Pembentukan film MIP pada SPCE polos dilakukan dengan elektropolimerisasi, menggunakan larutan yang mengandung LPA (1,0 mmol L −1 ) sebagai monomer dan AP (1,0 mmol L −1 ) sebagai molekul cetakan dalam buffer asetat (0,20 mol L −1 ; pH 5,0). Untuk ini, dalam kondisi yang dioptimalkan, 70,0 μL larutan diteteskan ke permukaan SPCE, dan elektrosintesis dilakukan dengan CV, dalam rentang potensial –1,0 hingga +1,5 V, selama 10 siklus berturut-turut, pada laju pemindaian 100,0 mV s –1 . Kemudian, elektroda dicuci dengan air murni, dan AP dari film polimer diekstraksi dengan cara direndam dalam larutan NaOH 0,05 mol L −1 dengan pengadukan (400 rpm) selama 15 menit atau sampai ekstraksi lengkap. Pengukuran DPV dalam larutan penyangga asetat dilakukan untuk mengonfirmasi ekstraksi templat yang lengkap.
Sebagai sensor kontrol, film polimer tak bercetak (NIP) diperoleh pada SPCE kosong berdasarkan prosedur yang sama tetapi tanpa molekul cetakan.
2.4 Pengukuran Elektrokimia
Alikuot 70 μL larutan standar atau sampel yang mengandung elektrolit pendukung diteteskan pada SPCE untuk semua pengukuran elektrokimia. MIP/SPCE dan NIP/SPCE dievaluasi oleh DPV dalam rentang potensial −0,1 hingga +0,7 V, dengan potensial langkah 5 mV, waktu pulsa 50 ms, dan amplitudo pulsa 100 mV, menggunakan larutan AP dalam buffer asetat atau fosfat. Untuk analisis AP, larutan/sampel yang mengandung analit sebelumnya bersentuhan dengan MIP/SPCE selama waktu inkubasi yang dioptimalkan untuk pengikatan ulang AP. Selanjutnya, elektroanalisis AP dilakukan oleh DPV.
Untuk studi karakterisasi elektrokimia, pengukuran VC dan EIS dilakukan dalam larutan [Fe(CN) 6 ] 3–/4– 5 mmol L –1 , dalam 0,30 mol L –1 KCl. Pengukuran EIS dilakukan dalam potensial sirkuit terbuka (OCP), amplitudo 10 mV, rentang frekuensi 10 MHz hingga 100 kHz, dan CV pada laju pemindaian 100,0 mV s –1 .
2.5 Persiapan Sampel
Penerapan MIP/SPCE dievaluasi dalam sampel air alami. Sampel air dikumpulkan di Ribeirão da Velha, di Blumenau, Santa Catarina, Brasil (26°55′06″S 49°05′40″W) dan elektrolit yang disaring dan pendukung ditambahkan. Sampel-sampel ini dianalisis dengan DPV dan, karena AP tidak terdeteksi, sampel tersebut diperkaya dengan standar untuk memperoleh konsentrasi akhir 0,4 dan 4,0 μmol L –1 AP.
3 Hasil dan Pembahasan
3.1 Evaluasi SPCE yang Diproduksi dengan Tinta Karbon Konduktif yang Berbeda
Ke-12 formulasi tinta karbon yang berbeda yang diproduksi (C1 hingga C12) digunakan untuk memperoleh SPCE dan dievaluasi setelah tahap pengeringan. Awalnya, SPCE yang diperoleh dievaluasi secara visual terkait dengan penampilan fisiknya, terutama homogenitas dan kemungkinan retaknya tinta. Gambar fotografis dan SEM diperoleh dari permukaan SPCE yang diproduksi dengan setiap tinta (Gambar S2 dan S3, Informasi Pendukung). Inspeksi visual menunjukkan adanya keretakan yang signifikan pada tinta: C3 (50% GNP), C8 (60% SEFG), C9 (60% GNP), dan C11 (30% GP + 30% GNP), yang memengaruhi penggunaannya. Tinta lainnya menunjukkan penampilan yang lebih homogen dan tidak rapuh, seperti yang diinginkan. Dari gambar SEM (Gambar S3, Informasi Pendukung), dimungkinkan untuk mengamati kekasaran tinta kering dan ukuran partikel bahan karbon yang membentuk tinta. Misalnya, pada tinta C1 dan C7 (terdiri dari GP), kita dapat mengamati adanya ukuran partikel yang lebih besar yang merupakan karakteristik dari bubuk grafit yang digunakan; pada tinta C2 dan C8 (terdiri dari SEFG), partikel kecil dari nanografit ini terdistribusi secara homogen, seperti yang diamati dalam penelitian lain oleh kelompok kami [ 12 ].
Kinerja elektrokimia SPCE ini dievaluasi dalam larutan AP oleh SWV (Gambar 1 ). Seperti yang ditunjukkan, tinta yang terdiri dari dua bahan karbon (kecuali C11) menyajikan pencetakan yang baik dan peningkatan respons elektrokimia untuk AP. Diusulkan bahwa peningkatan kinerja ini mungkin telah dipromosikan oleh organisasi dan kontak yang lebih baik antara partikel karbon yang berbeda, yang memungkinkan jembatan konduksi di antara mereka, tanpa resin isolasi yang menghalangi konduktivitas tinta komposit. Lebih jauh lagi, mungkin ada paparan bahan konduktif yang lebih besar setelah tinta cetak mengering dan, oleh karena itu, area elektroaktif yang lebih besar. Di antara tinta karbon ini, C10 (30% GP + 30% SEFG) menonjol dengan respons arus puncak tertinggi untuk AP.
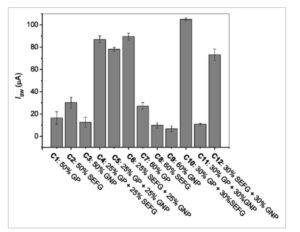
GAMBAR 1
Buka di penampil gambar
Presentasi PowerPoint
Respon elektrokimia diperoleh dalam larutan AP 100 mmol L −1 , dalam buffer fosfat pH 7,0, oleh SWV, menggunakan SPCE yang diproduksi dengan formulasi tinta karbon yang berbeda (C1 hingga C12) ( n = 3).
SPCE yang disiapkan dari tinta yang berbeda juga dikarakterisasi secara elektrokimia melalui CV dan EIS, menggunakan larutan yang mengandung pasangan redoks [Fe(CN) 6 ] 3– / 4– . Dari studi CV (Gambar S4 dan S5, Informasi Pendukung), dapat diamati bahwa SPCE yang diproduksi dengan tinta C2 (50% SEFG) dan C10 (30% GP + 30% SEFG) menunjukkan profil voltametri yang terdefinisi dengan baik untuk pasangan [Fe(CN) 6 ] 3– / 4– , dengan arus puncak tertinggi (anodik dan katoda) dan Δ E p terendah . Terlepas dari itu, dalam analisis voltametri dengan AP (Gambar 1 ), arus puncak tiga kali lebih tinggi diperoleh dengan tinta C10 dibandingkan dengan tinta C2. Hasil ini dapat dikaitkan dengan persentase massa bahan konduktif yang lebih tinggi (60%) dan mungkin ke area elektroaktif yang lebih besar, yang meningkatkan interaksi π – π antara cincin benzena dari molekul AP dan permukaan grafit. Dari diagram Nyquist yang diperoleh oleh EIS (Gambar S6, Informasi Pendukung), dimungkinkan untuk mengamati resistansi transfer muatan yang lebih rendah ( R ct ) untuk tinta C12, C10 dan C2. Secara umum, hasil ini menguatkan perilaku yang diamati oleh CV. Lebih jauh, penting untuk dicatat bahwa tinta yang lebih berpori dan/atau sedikit getas membuat mustahil untuk mendapatkan data EIS secara memadai.
Berdasarkan penelitian ini, tinta C10 dipilih untuk menghasilkan SPCE untuk penelitian selanjutnya.
3.2 Elektropolimerisasi LPA pada SPCE
CV diaplikasikan untuk elektropolimerisasi LPA tanpa dan dengan adanya templat analit (AP) untuk memperoleh film NIP dan MIP, masing-masing (Gambar S7, Informasi Pendukung). Voltammogram yang ditunjukkan pada Gambar S7A, Informasi Pendukung, mengindikasikan bahwa, dengan peningkatan jumlah siklus, terdapat peningkatan berkelanjutan pada arus puncak anoda yang menunjukkan pertumbuhan polimer pada permukaan SPCE. Menurut penelitian sebelumnya [ 28 , 29 ], mekanisme yang mungkin untuk polimerisasi elektrokimia LPA pada permukaan SPCE disajikan dalam Skema S1, Informasi Pendukung. Proses dimulai dengan elektrooksidasi gugus amino menjadi kation radikal yang sesuai, yang kemudian diimobilisasi pada permukaan elektroda melalui ikatan karbon–nitrogen. Pada kondisi eksperimen (pH 5,0), LPA (pKa = 1,83) dideprotonasi (COO − ) [ 24 ]. Kemudian, kation radikal dari gugus amino teroksidasi berinteraksi dengan gugus COO − dari molekul PLA lain dan polimerisasi terjadi. Oleh karena itu, diusulkan bahwa poli ( L -fenilalanina) (PLPA) menyajikan rantai dengan ukuran bervariasi yang terbentuk dari unit LPA berulang yang dihubungkan bersama melalui ikatan amida.
Profil elektropolimerisasi yang sedikit berbeda diamati pada Gambar S7B, Informasi Pendukung, untuk memperoleh film MIP, yang menunjukkan pembentukan PLPA dengan adanya molekul templat. Selama proses pencetakan molekuler, puncak oksidasi dan reduksi diamati pada siklus pertama, menurun dengan cepat dengan siklus, yang dikaitkan dengan sebagian molekul AP yang ada dalam larutan, tidak mengorbankan elektrooksidasi PLA. Setelah polimerisasi, film MIP (MIP/SPCE yang diblokir) dikenakan langkah ekstraksi molekul templat. Voltammogram pada Gambar S8, Informasi Pendukung, diperoleh saat memantau proses ekstraksi dan pengikatan ulang analit berikutnya dalam film MIP, yang menunjukkan pembentukan rongga pengenalan yang memadai.
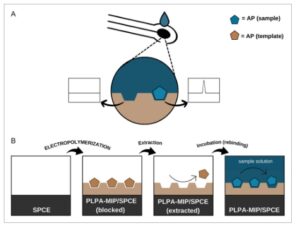
Gambar 2 menyajikan representasi skematis prinsip pengoperasian sensor MIP dan proses persiapannya, termasuk langkah-langkah elektropolimerisasi dan ekstraksi templat dan akhirnya, inkubasi untuk pengenalan AP (pengikatan ulang analit) dan kemudian analisis kuantitatif.
GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
Representasi skematis: (A) prinsip pengoperasian sensor MIP yang diusulkan dalam pengenalan analit target elektroaktif (AP). (B) Persiapan PLPA-MIP/SPCE, termasuk langkah-langkah elektropolimerisasi dan ekstraksi templat, diikuti oleh inkubasi untuk pengenalan AP.
Diusulkan agar matriks PLPA tiga dimensi dengan rongga cetak dihasilkan dari elektropolimerisasi monomer LPA dengan adanya templat AP. Interaksi antarmolekul yang berbeda dapat terjadi antara gugus fungsi struktur polimer dan molekul AP, seperti ikatan hidrogen dan interaksi penumpukan π– π . Setelah ekstraksi, rongga yang terbentuk melalui proses pencetakan ini dilepaskan untuk mengenali molekul AP berdasarkan bentuk dan posisi gugus fungsi mereka.
3.3 Karakterisasi Sensor NIP dan MIP
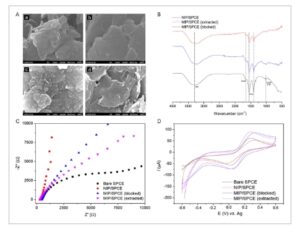
Film NIP dan MIP yang dielektropolimerkan pada SPCE dikarakterisasi dengan FEG-SEM, sudut kontak, ATR-FTIR, EIS, dan CV (Gambar 3 ).
GAMBAR 3
Buka di penampil gambar
Presentasi PowerPoint
(A) Gambar SEM-FEG diperoleh dari permukaan (a) SPCE polos, (b) NIP/SPCE, (c) MIP/SPCE (diblokir templat), dan (d) MIP/SPCE (diekstraksi). (B) Spektrum ATR-FTIR diperoleh dari film NIP (biru), MIP setelah elektropolimerisasi (MIP yang diblokir templat) (hitam), dan MIP setelah ekstraksi templat (merah). (C) Diagram Nyquist dan (D) voltamogram siklik diperoleh menggunakan sensor yang berbeda dalam larutan 5 mmol L –1 [Fe(CN) 6 ] 3–/4– , dalam 0,30 mol L –1 KCl.
Gambar 3A menunjukkan gambar FEG-SEM dan pengukuran sudut kontak yang diperoleh dari permukaan berbagai sensor. Dalam NIP/SPCE (b), dimungkinkan untuk mengamati lapisan polimer tipis pada serpihan karbon SPCE polos. Dalam MIP/SPCE yang diblokir templat (c), kami mengamati lapisan yang lebih tebal dan lebih kasar, dengan tampilan yang sangat berbeda dari NIP/SPCE (b), yang menunjukkan bahwa keberadaan templat memengaruhi organisasi tiga dimensi film MIP. Proses ekstraksi tampaknya menghilangkan sebagian film yang terbentuk, membuat tampilan MIP/SPCE yang diekstraksi (d) seperti NIP/SPCE (b) tetapi memperlihatkan tekstur yang berbeda, yang disebabkan oleh rongga MIP yang terbuka. Gambar S9, Informasi Pendukung, menunjukkan gambar sudut kontak, yang dilakukan dari setetes air yang bersentuhan dengan permukaan setiap sensor. Nilai sudut kontak ( n = 6) diperoleh dengan bantuan perangkat lunak Ossila Contact Angle 4.2.1 . SPCE polos (a) menunjukkan karakter hidrofobik yang lebih besar (120° ± 7°). Pada saat yang sama, sudut kontak sensor yang dimodifikasi dengan film polimer berkurang, seperti pada sensor NIP/SPCE (111° ± 6°), yang menunjukkan bahwa PLPA memiliki karakter yang kurang hidrofobik. Pada sensor MIP/SPCE (yang diekstraksi), sudut kontak sedikit berkurang (95° ± 4°) karena rongga yang tercetak pada film, yang menyediakan area kontak yang lebih besar dalam kaitannya dengan NIP/SPCE. Dalam kasus MIP/SPCE (terblokir templat), ketika tetesan air diletakkan pada permukaan film, pengurangan signifikan pada nilai sudut kontak (76° ± 5°) diamati, yang dapat dijelaskan oleh kekasaran dan area kontak film yang tinggi (seperti yang terlihat pada gambar SEM-FEG), dan juga oleh interaksi air dengan molekul AP.
Gambar 3B menunjukkan spektrum FTIR dari film: NIP, MIP setelah elektropolimerisasi (MIP yang diblokir templat), dan MIP setelah ekstraksi templat. Spektrum dari ketiga film menunjukkan perilaku yang serupa, yang diharapkan karena film diproduksi dengan elektropolimerisasi monomer yang sama (LPA). Mereka menyajikan pita papan serapan yang berpusat di sekitar 3300 cm −1 yang sesuai dengan peregangan gugus hidroksil, yang menunjukkan adanya ikatan air dan hidrogen yang diserap, yang mungkin tumpang tindih dengan pita N–H [ 30 , 31 ]. Satu pita spesifik dari struktur polimer yang diperoleh (PLPA) dapat dilihat pada 1650 cm −1 , yang dikaitkan dengan ikatan C=O dari amida. Pita pada 1600 dan 1450 cm –1 disarankan untuk ikatan C=C dari cincin aromatik [ 31 , 32 ]. Dalam spektrum film MIP yang diblokir, pita sekitar 1000 cm −1 sedikit berbeda dari spektrum lainnya, yang dapat dikaitkan dengan ikatan C–OH dan C–N simetris yang ada dalam struktur AP, yang menunjukkan keberadaan templat dalam rongga polimer [ 31 ]. Dengan demikian, seseorang dapat mengamati bahwa spektrum film MIP (yang diekstraksi) dan NIP setara dalam hal komposisi, seperti yang diharapkan, yang menunjukkan bahwa setelah proses penghilangan templat, film PLPA yang dicetak dipertahankan, meskipun ada kemungkinan sedikit kehilangan.
CV dan EIS digunakan dalam larutan [Fe(CN) 6 ] 3−/4− untuk mempelajari perilaku elektrokimia sensor. Gambar 3C,D menyajikan voltamogram siklik dan diagram Nyquist yang diperoleh untuk SPCE polos, NIP/SPCE, MIP/SPCE (terblokir), dan MIP/SPCE (terekstraksi). Nilai parameter elektrokimia yang diperoleh dalam studi ini, seperti I ap , I cp , Δ E p , dan R ct , ditunjukkan dalam Tabel S2, Informasi Pendukung. Nilai R ct dihasilkan dari analisis setengah lingkaran diagram Nyquist. Gambar 3C menunjukkan nilai R ct rendah , yang dapat dikaitkan dengan konduktivitas film PLPA yang baik, dengan sedikit peningkatan R ct karena adanya templat atau rongga dalam film MIP. Pada Gambar 3D , perubahan puncak anoda dan katoda dapat diamati dengan setiap modifikasi pada elektroda. Diusulkan bahwa profil voltametri terbaik yang diamati dengan MIP/SPCE disebabkan oleh lapisan polimer tipis yang diperoleh dan keberadaan rongga, yang dapat meningkatkan area elektroaktif sensor.
Untuk melengkapi informasi tentang lapisan PLPA yang terbentuk pada permukaan SPCE, sistem probe empat titik digunakan untuk pengukuran konduktivitas elektroda dengan dan tanpa lapisan polimer, yang masing-masing menunjukkan 865,8 dan 274,2 S m –1 . Oleh karena itu, PLPA/SPCE terbukti memiliki konduktivitas listrik yang lebih tinggi dibandingkan dengan SPCE polos.
3.4 Optimasi Persiapan Sensor MIP
3.4.1 Jumlah Siklus
Jumlah siklus yang digunakan dalam elektropolimerisasi secara langsung memengaruhi ketebalan film polimer yang terbentuk pada elektroda. Hal ini juga dapat berdampak signifikan pada perilaku konduktif dan kinerja elektrokimia sensor. Dalam persiapan film MIP, sejumlah kecil siklus dapat menyebabkan sensitivitas rendah dari sensor yang disiapkan karena sejumlah kecil situs pengenalan yang terbentuk dalam matriks polimer. Di sisi lain, jumlah siklus yang lebih tinggi dapat menghasilkan film yang lebih tebal dengan situs jejak yang kurang dapat diakses. Untuk alasan ini, sebuah studi untuk mengoptimalkan jumlah siklus untuk elektropolimerisasi LPA dengan adanya AP dilakukan oleh CV. Setelah ekstraksi templat, analisis dilakukan oleh DPV dalam larutan AP (0,1 mmol L −1 ). Gambar 4A menunjukkan nilai arus puncak untuk AP versus jumlah siklus, di mana arus meningkat dari siklus ke-5 hingga ke-10 dan kemudian menurun secara signifikan. Oleh karena itu, 10 siklus untuk elektropolimerisasi PLPA/AP ditetapkan untuk produksi sensor MIP.

GAMBAR 4
Buka di penampil gambar
Presentasi PowerPoint
Studi optimasi parameter persiapan sensor MIP dan kondisi aplikasi: (A) jumlah siklus yang diterapkan dalam elektropolimerisasi LPA; (B) pH larutan yang digunakan dalam elektrosintesis MIP; (C) rasio molar antara monomer dan templat; (D) larutan yang digunakan dalam ekstraksi templat; (E) pH larutan analisis; dan (F) waktu inkubasi (pengikatan ulang). Respons diukur dengan DPV menggunakan larutan AP (rata-rata ± SD, n = 3).
3.4.2 pH Larutan Elektropolimerisasi
Untuk memverifikasi pengaruh pH pada proses pembentukan film MIP, studi optimasi dilakukan menggunakan larutan yang mengandung LPA dan AP (keduanya 1,0 mmol L −1 ), yang disiapkan dalam larutan buffer yang berbeda pada nilai pH berikut: 4,0 dan 5,0 (asetat) dan 3,0, 6,0, 7,0 dan 8,0 (fosfat). Gambar 4B menunjukkan nilai arus puncak dan persentase pengikatan ulang yang diperoleh dalam larutan AP, menggunakan sensor MIP yang diproduksi pada nilai pH yang berbeda. Diketahui bahwa nilai pH tidak hanya memengaruhi elektropolimerisasi, tetapi juga interaksi antara monomer dan molekul cetakan. Persentase pengikatan ulang dihitung berdasarkan arus puncak AP yang diperoleh dalam larutan buffer menggunakan sensor MIP sebelum ekstraksi (dianggap 100%) dan dibandingkan dengan respons yang diperoleh menggunakan sensor MIP (diekstraksi) dalam larutan AP setelah waktu inkubasi. Gambar 4B menunjukkan bahwa arus puncak tertinggi diperoleh dengan menggunakan larutan pH 5,0, dan persentase pengikatan ulang AP tertinggi. Oleh karena itu, buffer asetat pH 5,0 dipilih untuk menyusun larutan elektropolimerisasi guna memperoleh film MIP.
3.4.3 Rasio Molar Antara Monomer dan Template
Rasio [monomer]:[templat] merupakan faktor penentu dalam proses elektropolimerisasi film MIP, karena rasio ini bertanggung jawab atas konformasi struktural dan pembentukan rongga, yang memengaruhi pengenalan analit. Oleh karena itu, rasio molar [LPA]:[AP] dioptimalkan dengan mengevaluasi kondisi larutan elektrosintesis berikut: 1:0 (NIP); 0:1 (tidak dimodifikasi); 1:1, 2:1, 3:1, dan 4:1 (MIP). Larutan ini disiapkan sebelum elektrosintesis untuk memastikan setidaknya 30 menit interaksi kesetimbangan antara molekul LPA dan AP. Gambar 4C menunjukkan nilai arus puncak untuk larutan AP, yang diperoleh dengan DPV, menggunakan SPCE yang dimodifikasi dengan kondisi elektropolimerisasi yang berbeda, dan setelah ekstraksi templat. Rasio molar 1:1 dipilih untuk menghasilkan sensor MIP, karena rasio ini menunjukkan nilai arus tertinggi untuk AP, dengan deviasi respons yang rendah, yang menunjukkan kondisi terbaik untuk pengenalan analit.
3.4.4 Solusi dan Waktu yang Diterapkan dalam Ekstraksi Template
Berbagai larutan dievaluasi untuk menghilangkan molekul templat dari film MIP. Efek larutan dalam kaitannya dengan kemungkinan kerusakan pada film dan rongga pengenalan, gangguan pengikatan ulang AP, dan bahkan penghilangan film pada elektroda juga dipantau. Studi ini mengevaluasi larutan berikut: 0,05 mol L −1 NaOH, 0,1 mol L −1 NaOH, 0,05 mol L −1 asam asetat, dan campuran air:etanol (1:1). Setelah elektropolimerisasi, sensor MIP direndam dalam larutan ini dengan pengadukan magnetik (400 rpm) selama 15 menit. Setelah waktu ekstraksi ini, sensor MIP dianalisis dengan DPV, pertama dalam buffer fosfat untuk mengevaluasi penurunan arus puncak AP (ekstraksi%). Setelah inkubasi dalam larutan AP, persentase pengikatan ulang juga diselidiki oleh DPV. Gambar 4D menunjukkan bahwa semua larutan yang diteliti menunjukkan ekstraksi yang memuaskan, di atas 95%, sehingga persentase pengikatan ulang dianggap sebagai faktor penentu untuk pemilihan. Campuran air:etanol menunjukkan ekstraksi 100%, tetapi pengikatan ulang mendekati nol, yang menunjukkan kemungkinan penghilangan film secara menyeluruh pada SPCE. Persentase pengikatan ulang tertinggi dari penyambungan ulang diperoleh dengan larutan NaOH 0,05 mol L −1 , yang menunjukkan proses ekstraksi yang berhasil; larutan ini dipilih untuk penelitian selanjutnya.
3.5 Optimasi Kondisi Analisis
3.5.1 pH Larutan Analisis
Nilai pH merupakan faktor penting dalam aktivitas elektrokimia molekul dan kecepatan reaksi redoks. Dengan demikian, pH larutan elektrolit pendukung memengaruhi perilaku redoks, terutama dalam reaksi yang melibatkan proton (H + ), seperti dalam mekanisme elektrooksidasi AP (Skema S2, Informasi Pendukung). Untuk menetapkan pH terbaik untuk larutan analisis AP, larutan buffer yang berbeda diselidiki: 3,0 (fosfat), 4,0 dan 5,0 (asetat), dan 6,0, 7,0, dan 8,0 (fosfat). Efek pH pada respons AP dapat diamati pada Gambar 4E , berdasarkan nilai arus puncak dan pengikatan ulang. Dari hasil ini, pH 7,0 ditetapkan sebagai yang terbaik untuk larutan analisis AP, karena menunjukkan kinerja terbaik di antara 2 parameter (% pengikatan ulang dan arus puncak).
3.5.2 Waktu Inkubasi
Investigasi pengaruh waktu inkubasi, yaitu periode kontak larutan yang mengandung analit dengan permukaan sensor MIP, dilakukan untuk menemukan waktu kesetimbangan yang diperlukan untuk pengikatan ulang analit dalam rongga cetak. Parameter ini dioptimalkan menggunakan sensor MIP yang bersentuhan dengan larutan AP dalam buffer fosfat pH 7,0, tanpa agitasi, selama empat periode inkubasi yang berbeda, diikuti oleh analisis DPV. Hasil arus puncak dan persentase pengikatan ulang yang diperoleh untuk AP (Gambar 4F ) menunjukkan bahwa waktu inkubasi terbaik adalah 3 menit.
3.6 Kinerja Sensor MIP
3.6.1 Analisis Batas Deteksi Sensor
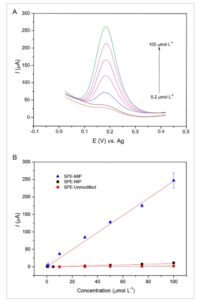
Voltammogram pulsa diferensial yang diperoleh dengan sensor MIP ditunjukkan pada Gambar 5A , menggunakan larutan AP dalam rentang konsentrasi dari 0,2 hingga 100 µmol L −1 , dalam buffer fosfat (0,2 mol L −1 ; pH 7,0), di bawah kondisi eksperimen yang dioptimalkan. SPCE polos dan NIP/SPCE juga menjadi sasaran analisis larutan AP, di bawah kondisi eksperimen yang sama. Sensor yang dievaluasi telah menunjukkan hubungan linear antara arus puncak oksidasi AP dan konsentrasi AP (Gambar 5B ), menurut regresi linear dan koefisien korelasi yang ditunjukkan pada Tabel S3, Informasi Pendukung. Batas teoritis deteksi (LOD = 3 × SD intercept /slope) dan kuantifikasi (LOQ = 10 × SD intercept /slope) diperoleh dari parameter regresi linear kurva kalibrasi untuk AP, menggunakan SPCE polos, NIP/SPCE, dan MIP/SPCE (Tabel S3, Informasi Pendukung). Sensor MIP menyajikan kinerja analitis terbaik dibandingkan dengan sensor NIP dan SPCE murni, dengan sensitivitas analitis yang lebih besar (kemiringan kurva kalibrasi) dan kemampuan untuk mendeteksi dan mengukur AP dalam konsentrasi yang lebih rendah (LOD teoritis = 30 nmol L −1 dan LOQ = 110 nmol L −1 ). Selain itu, nilai LOD dan LOQ yang ditentukan secara eksperimen dari rasio signal-to-noise masing-masing adalah ≈40 nmol L −1 (S
GAMBAR 5
Buka di penampil gambar
Presentasi PowerPoint
(A) Voltammogram pulsa diferensial diperoleh dengan sensor MIP menggunakan larutan AP dalam konsentrasi berbeda, dan (B) kurva kalibrasi diperoleh dengan MIP/SPCE, NIP/SPCE, dan SPCE kosong ( n = 3).
Tabel 1 secara singkat membandingkan kinerja analitis dari berbagai sensor MIP yang sebelumnya dilaporkan dalam literatur dan sensor yang diusulkan dalam karya ini terkait dengan penentuan AP. Seperti yang dapat dilihat, sensor MIP yang diusulkan menyajikan rentang linear dan LOD yang sebanding dan, dalam beberapa kasus, bahkan lebih baik daripada sensor lain yang dilaporkan untuk analisis AP. Selain itu, penting untuk menyoroti bahwa sensor yang diusulkan menggunakan sintesis elektrokimia yang sederhana dan cepat dari film MIP secara langsung pada SCPE, yaitu, sintesis in situ, hanya menggunakan asam amino sebagai monomer (LPA) dan templat analit (AP) dalam media berair. Oleh karena itu, metodologi ini tidak menghasilkan limbah yang tidak diinginkan dan dapat dianggap sebagai strategi yang ramah lingkungan. Di sisi lain, karya lain, terutama yang menggunakan sintesis kimia, memerlukan beberapa langkah dan sering menggunakan inisiator polimerisasi dan pelarut beracun dalam proses memperoleh MIP. Bahkan beberapa sintesis (elektro)kimia yang menggunakan monomer yang banyak digunakan, seperti pirol dan anilin, biasanya memerlukan agen doping. Lebih jauh lagi, lazimnya disertakan lebih banyak bahan pengubah (seperti nanomaterial dan cairan ionik) dalam pencarian kinerja analitis yang lebih baik; namun, lebih banyak kondisi persiapan yang mesti dikontrol.
TABEL 1. Perbandingan sensor MIP yang diusulkan dengan sensor elektrokimia lain yang dilaporkan dalam literatur untuk penentuan asetaminofen (AP).
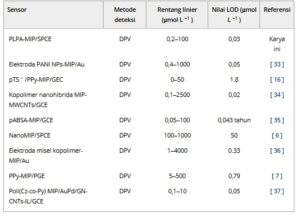
Singkatan: AuPd/GN-CNTs-IL = nanopartikel AuPd 3D–nano komposit grafen–nano tabung karbon terfungsionalisasi cairan ionik; GCE = elektroda karbon seperti kaca; GEC = elektroda komposit grafit-epoksi; MWCNTs = nano tabung karbon berdinding banyak; pABSA = asam p-aminobenzena sulfonat; PANI NPs = nanopartikel polianilin; PGE = elektroda grafit pensil; Poli(Cz-co-Py) = poli(karbazol-co-pirol); PPy = polipirol; pTS − = anion p-toluenasulfonat.
3.6.2 Selektivitas
Selektivitas merupakan faktor krusial bagi kinerja analitis sensor MIP, khususnya dalam menganalisis sampel yang mengandung zat dengan struktur kimia dan perilaku elektrokimia seperti analit target, yang dapat menjadi pengganggu potensial.
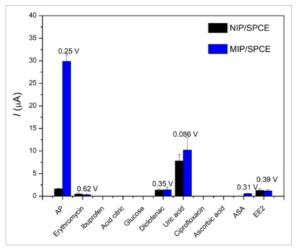
Dengan cara ini, untuk menyelidiki selektivitas sensor MIP yang diusulkan, molekul-molekul farmasi lain dengan struktur serupa diuji, serta zat-zat yang dapat ditemukan dalam urin, limbah, dan air yang terkontaminasi [ 1 – 37 – 5 , 38 ]. Di bawah kondisi eksperimen yang dioptimalkan, sensor MIP dan NIP digunakan dalam analisis masing-masing larutan berikut: AP, eritromisin, ibuprofen, asam sitrat, glukosa, diklofenak, UA, siprofloksasin, asam askorbat, ASA, dan EE2, semuanya pada konsentrasi 100 µmol L −1 . Gambar 6 menunjukkan arus puncak yang diperoleh (dan potensial puncak masing-masing) untuk studi yang dilakukan oleh DPV menggunakan sensor MIP dan NIP. Nilai estimasi faktor pencetakan (IF) untuk AP dihitung dari Persamaan (1) [ 39 ]:
GAMBAR 6
Buka di penampil gambar
Presentasi PowerPoint
Perbandingan selektivitas antara sensor MIP dan NIP. Analisis yang dilakukan oleh DPV dalam larutan individual yang mengandung 100 µmol L −1 untuk setiap molekul yang dianalisis dalam larutan penyangga fosfat pada pH 7,0 dan waktu pengikatan ulang 3 menit ( n = 3).
![]()
Nilai IF sebesar 12,5 untuk AP menegaskan jejak molekul yang baik dari film MIP yang dihasilkan. Untuk zat lain yang menunjukkan respons elektrokimia, nilai IF mendekati 1 menunjukkan bahwa respons yang diperoleh terutama berkaitan dengan interaksi permukaan daripada rongga cetakan apa pun [ 40 ].
Seperti yang ditunjukkan pada Gambar 6 , respons sensor MIP terhadap AP secara signifikan lebih tinggi dibandingkan dengan analit lainnya, termasuk jika dibandingkan dengan sensor NIP. Hasil ini menyoroti selektivitas yang baik dari sensor MIP karena rongga yang dicetak oleh pola AP dalam film.
Larutan UA adalah satu-satunya yang menunjukkan respons signifikan menggunakan sensor MIP dan NIP; namun, respons ini terjadi pada potensi puncak yang berbeda dari analit target. Lebih jauh, karena respons UA cukup mirip menggunakan sensor MIP dan NIP, kami mengaitkan respons ini dengan interaksi UA dengan permukaan film PLPA, dan bukan karena pengenalan rongga cetak.
Untuk menyelidiki kemungkinan interferensi dari UA dengan lebih baik, sebuah penelitian dilakukan dengan sensor MIP menggunakan larutan yang hanya mengandung AP dan UA (masing-masing) dan larutan yang mengandung campuran dari 2 analit (AP + UA). Analisis dilakukan dalam rangkap tiga dengan DPV, dengan mempertahankan kondisi eksperimen yang sama. Hasil yang diperoleh ada pada Gambar S10, Informasi Pendukung, di mana puncak respons AP (masing-masing) dalam kaitannya dengan campuran (AP + UA) hanya memiliki sedikit pergeseran potensial dan sedikit peningkatan arus, yang menunjukkan sedikit interferensi dari UA dalam respons AP, dengan kesalahan relatif sebesar 7,7% ( n = 3). Ini menunjukkan bahwa UA tidak akan membahayakan analisis kuantitatif AP, tetap berada dalam kesalahan yang dapat diterima.
3.6.3 Reprodusibilitas, Kegunaan Ulang, dan Stabilitas
Studi reproduktifitas dilakukan menggunakan lima sensor MIP, yang diproduksi dan dianalisis secara individual, dalam kondisi optimal yang sama. Gambar S11A, Informasi Pendukung, menunjukkan bahwa arus puncak relatif yang diperoleh untuk AP menunjukkan sedikit perbedaan antara sensor MIP yang dianalisis, dengan RSD sebesar 4,6%, yang menunjukkan reproduktifitas yang baik dari sensor yang diusulkan.
Sembilan pengukuran berturut-turut dilakukan dengan menggunakan sensor yang sama untuk mempelajari penggunaan ulang sensor MIP. Setelah setiap pengukuran, sensor dikenakan proses ekstraksi untuk menghilangkan analit yang terikat pada film MIP, kemudian ditempatkan lagi dalam kontak dengan larutan dengan konsentrasi yang sama (100 µmol L −1 ) selama 3 menit dan dianalisis dengan DPV. Gambar S11B, Informasi Pendukung, menunjukkan arus puncak relatif yang diperoleh untuk setiap pengukuran. Empat pengukuran pertama menunjukkan variasi yang sangat sedikit (RSD = 1,6%), dan dari pengukuran kelima dan seterusnya, ada variasi arus yang sedikit lebih besar, tetapi masih dapat diterima. Mempertimbangkan sembilan pengukuran, RDS sebesar 5,2% diperoleh, yang menunjukkan penggunaan ulang sensor MIP yang baik.
Untuk mengevaluasi stabilitas sensor MIP dari waktu ke waktu, 10 sensor disimpan dalam kondisi ruangan (tanpa pendinginan dan kontrol kelembapan) dan dianalisis selama 50 hari, dalam kondisi yang optimal. Pada hari ke-40, respons sensor dipertahankan pada 74% terkait dengan pengukuran yang dilakukan pada hari pertama pemantauan. Pada hari ke-50, sensor menunjukkan penurunan respons yang lebih nyata. Oleh karena itu, penyimpanan jangka panjang pada suhu ruangan tidak disarankan.
3.7 Aplikasi Analisis Sensor MIP
Penerapan sensor MIP yang diusulkan diuji dalam sampel air alami. Karena sampel tidak memiliki konsentrasi AP yang terdeteksi, keduanya sebelumnya diperkuat dengan standar AP.
Metode penambahan standar digunakan untuk mengukur AP dalam sampel yang dianalisis oleh DPV dalam kondisi optimal. Tabel 2 menyajikan hasil untuk konsentrasi yang ditambahkan dan terdeteksi dalam sampel. Konsentrasi yang ditentukan untuk sampel air yang diperkaya dengan 0,4 dan 4,0 µmol L −1 AP menunjukkan kesalahan relatif masing-masing sebesar 4,8% dan 2,5%.
TABEL 2. Aplikasi sensor MIP yang diusulkan dalam menentukan AP dalam sampel air (n = 3).
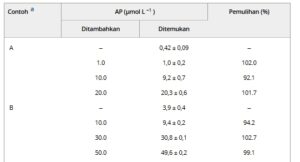
a Sampel air alami yang sebelumnya difortifikasi dengan asetaminofen (AP). Sampel: A = 0,4 µ mol L −1 atau 60,5 µ g L −1 dan B = 4 µ mol L −1 atau 605 µ g L −1
Dalam studi pemulihan, nilai yang ditemukan mendekati konsentrasi yang meningkat dalam sampel air, dengan pemulihan rata-rata masing-masing 92,1%–102,0% dan 94,2%–102,7%. Hasil ini menunjukkan presisi dan akurasi yang baik dari sensor MIP dalam mengukur AP dalam sampel air, yang menunjukkan potensi untuk memantau kontaminasi oleh limbah domestik.
4 Kesimpulan
Dalam karya ini, kami melaporkan produksi laboratorium tinta konduktif berdasarkan nanomaterial karbon dan penggunaannya dalam memperoleh SPCE, termasuk studi optimasi, karakterisasi, dan seleksi. Kemudian, LPA digunakan untuk pertama kalinya dalam elektrosintesis film MIP langsung pada SPCE untuk analisis voltametri AP. Setelah langkah optimasi dan karakterisasi, sensor MIP yang diusulkan menunjukkan kinerja analitis yang baik, dengan LOD dalam orde nmol L –1 , selektivitas yang baik, dan reproduktifitas, penggunaan ulang, dan stabilitas yang memadai. Sensor MIP ini menunjukkan potensi untuk aplikasi dalam pemantauan AP di perairan alami dan air limbah yang terkontaminasi.





Tinggalkan Balasan