Abstrak
Deteksi biomarker dalam cairan interstisial (ISF) sangat menjanjikan untuk diagnosis dan pemantauan penyakit dini. Silikon berpori (pSi) menawarkan platform serbaguna untuk biosensor implan karena biokompatibilitasnya, luas permukaannya tinggi, dan sifatnya yang dapat disetel. Studi ini menyajikan pengembangan dan karakterisasi biosensor pSi bebas label yang menampilkan rongga mikro fotonik (MC) inframerah dekat (NIR) yang ditanamkan secara subkutan pada tikus yang di-eutanasia untuk mendeteksi insulin secara real time sebagai bukti konsep. Biosensor menunjukkan kemampuan deteksi insulin spesifik dengan batas deteksi (LOD) 209 nM, menunjukkan konsistensi, reproduktifitas, dan kinerja penginderaan jangka panjang yang sangat baik. Lebih lanjut, biosensor menunjukkan kemampuan untuk mendeteksi insulin yang ditambahkan ke plasma yang diperoleh dari tikus yang sehat. Lebih lanjut dilaporkan bahwa metode analisis data yang sederhana dan sensitif, metode pergeseran panjang gelombang efektif (ESW) untuk mengukur pergeseran panjang gelombang pusat MC fotonik. Pendekatan yang layak ini dapat diperluas ke biosensor fotonik lain yang pengukurannya dibatasi oleh resolusi spektrometer. Pendekatan yang diusulkan meletakkan dasar bagi pengembangan biosensor implan berbasis pSi untuk pemantauan berkelanjutan secara real-time terhadap biomarker yang relevan secara klinis secara in vivo untuk manajemen penyakit kronis.
1 Pendahuluan
Biosensor implan menandakan kemajuan revolusioner dalam diagnostik dan terapi, menawarkan pelacakan real-time dari biomarker utama termasuk elektrolit, metabolit, hormon, protein, dan oligonukleotida dalam tubuh manusia. [ 1 – 3 ] Perangkat invasif minimal ini dapat dimasukkan dengan mulus ke dalam lapisan subkutan kulit untuk terus melacak biomarker spesifik dalam ISF, memfasilitasi perawatan yang sedang berlangsung dan intervensi segera dalam kondisi kronis. [ 1 ] Sementara biosensor ini menghadirkan potensi besar untuk masa depan sistem perawatan kesehatan, dalam banyak kasus kinerjanya ditemukan hanya dapat diandalkan secara in vitro. [ 2 ] Kemajuan mereka terhambat secara signifikan oleh beberapa tantangan termasuk ketersediaan terbatas bahan yang dapat menyesuaikan diri dengan kondisi fisiologis yang kompleks secara in vivo. [ 4 ] Dalam hal ini, pSi memiliki potensi signifikan sebagai bahan penginderaan yang dapat berkontribusi pada kemajuan biosensor implan, karena karakteristiknya yang khas yang dapat meningkatkan fungsionalitas dan kemanjuran perangkat ini. [ 5 , 6 ] Atribut-atribut ini mencakup biokompatibilitas, sifat bioresorbable, rasio permukaan-volume yang tinggi untuk pemasangan bio-probe, potensi integrasi dengan sistem pengiriman obat untuk aplikasi terapi yang ditargetkan, dan kompatibilitas dengan metode mikrofabrikasi konvensional yang dapat memfasilitasi produksi massal. [ 7 ]
pSi telah banyak digunakan sebagai biosensor untuk mendeteksi biomarker dalam cairan tubuh, terutama untuk aplikasi point-of-care (POC). [ 8 – 11 ] Namun, potensinya sebagai biosensor untuk aplikasi yang dapat dikenakan dan ditanamkan belum banyak dieksplorasi. Kelompok kami sebelumnya telah menunjukkan pengoptimalan sifat optiknya untuk menghasilkan sinyal optik saat ditempatkan di bawah kulit. [ 5 , 6 ] Baru-baru ini, Corsi et al. telah menunjukkan penerapan pSi sebagai sensor kimia yang dapat ditanamkan untuk pemantauan pH in vivo melalui teknik berbasis fotoluminesensi menggunakan polielektrolit yang dikonjugasikan dengan Rhodamine sebagai label fluoresensi. [ 12 ] Dalam desain mereka, struktur pSi yang dapat terurai secara hayati berhasil ditransfer ke platform yang dapat diserap secara biologis dan ditanamkan di bagian belakang tikus untuk memantau pH dalam ISF secara waktu nyata. Biosensor kemudian larut setelah 100 jam operasi terus menerus. Sejauh pengetahuan kami, selain sensor pH ini, tidak ada biosensor berbasis pSi lain yang telah dilaporkan untuk mendeteksi biomarker penting dalam ISF untuk aplikasi yang dapat dikenakan dan ditanamkan.
Daerah NIR dari spektrum elektromagnetik menawarkan beberapa keuntungan utama dalam kesehatan dan kedokteran, khususnya untuk diagnostik penyakit. Kemampuannya untuk menembus lebih dalam ke dalam jaringan, dikombinasikan dengan kehilangan penyerapan yang lebih rendah dari air dan protein dan hamburan yang berkurang dibandingkan dengan cahaya tampak, membuat NIR sangat efektif untuk aplikasi pencitraan dan penginderaan yang non-invasif dan tepat. [ 13 ] Spektrum NIR selaras dengan jendela optik (NIR-I, II, dan III) dari jaringan biologis, di mana penyerapan dan hamburan diminimalkan dibandingkan dengan cahaya tampak. [ 13 , 14 ] Meskipun memiliki kerugian yang lebih rendah, jendela NIR belum digunakan secara luas untuk desain biosensor optik pSi dan hanya kelompok kami yang sebelumnya telah menunjukkan biosensor fotonik berbasis filter rugate pSi dalam NIR-I (≈700 nm) yang ditanamkan di bawah kulit model tikus untuk mendapatkan sinyal reflektansi optik in vivo. [ 6 ]
Dalam studi ini, kami memperkenalkan aptasensor fotonik bebas label yang memanfaatkan rongga mikro silikon berpori (pSiMC) yang dirancang dalam jendela NIR-II, yang dapat ditanamkan secara subkutan di bawah kulit untuk memantau biomarker secara real time dalam ISF ( Gambar 1 ). Kami juga menyajikan metode analisis data yang sederhana, andal, dan sensitif untuk menganalisis reflektansi pSiMC untuk aplikasi penginderaan. Metode ini dapat diterapkan secara umum pada struktur optik pSi lainnya, termasuk interferometer Fabry–Perrot. Kami mengoptimalkan desain MC, memfungsikan permukaan dengan kimia silanisasi, dan berhasil melumpuhkan aptamer sebagai probe penangkap untuk mendeteksi insulin dalam ISF sebagai bukti konsep. Kinerja sensor kemudian dianalisis secara in vitro dan sitotoksisitas biosensor terhadap sel fibroblas dermal (HDF) manusia diakses. Lebih lanjut, kinerja biosensor secara ex vivo diselidiki pada tikus yang di-eutanasia untuk pemantauan insulin secara real-time.
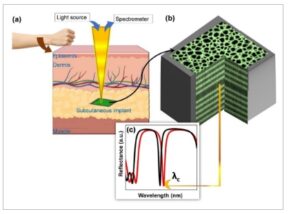
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
a) Ilustrasi lengan manusia dan jaringan kulit untuk penempatan subkutan biosensor implan berbasis pSiMC; b) skema pSiMC implan untuk mendeteksi biomarker dalam ISF; c) spektrum reflektansi khas pSiMC sebelum (hitam) dan setelah deteksi (merah) biomarker.
Sejauh pengetahuan kami, ini merupakan karya pertama tentang desain dan pengoptimalan MC berbasis pSi di jendela NIR-II yang ditujukan untuk meningkatkan sinyal yang dipantulkan melalui kulit hewan sambil meminimalkan hamburan untuk memantau konsentrasi insulin secara real time menggunakan spektroskopi reflektansi interferometrik (IRS). Karya ini membangun platform yang mendalam untuk pemantauan biomarker utama yang sederhana, bebas label, dan real time termasuk protein, antibodi, hormon, dan metabolit dalam ISF menggunakan biosensor implan minimal invasif berbasis pSi.
2 Hasil dan Pembahasan
2.1 Analisis Data
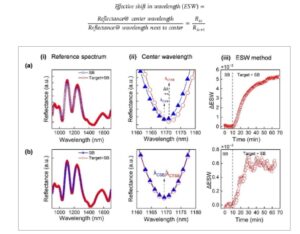
Secara umum, untuk biosensor optik berbasis pSi yang menggunakan interferometer Fabry–Perrot, metode analisis data yang berbeda seperti ketebalan optik efektif (EOT), interferogram yang dirata-ratakan sepanjang panjang gelombang (IAW), dan teknik fase gelombang Morlet (MWP) dapat digunakan. [ 15 – 17 ] Namun, dalam kasus biosensor berbasis MC, pergeseran spektrum diukur sebagai perbedaan panjang gelombang pusat (refleksi minimum) sebelum (λ CSB ) dan setelah pengikatan target (λ CTSB ). [ 18 , 19 ] Spektrum reflektansi pSiMC tipikal disajikan dalam Gambar 2 i(a) yang diukur awalnya pada awal percobaan penginderaan dalam buffer standar (SB) dan setelah 50 menit pengikatan analit target pada permukaan pSiMC yang diimobilisasi dengan bioreseptor. Untuk menentukan pergeseran, tampilan spektrum yang diperbesar di sekitar panjang gelombang pusat disajikan pada Gambar 2ii(a) yang menunjukkan bahwa panjang gelombang pusat setelah pengikatan target (λ CTSB ) bergeser sebesar ∆λ = 1,6 nm (λ CSB = 1169,3 nm dan λ CTSB = 1170,9 nm). Ini merupakan metode yang sangat sederhana, konvensional, dan andal untuk mengevaluasi kinerja biosensor berbasis MC. Namun, pergeseran minimum yang dapat dideteksi dibatasi oleh resolusi spektrometer (perbedaan antara dua panjang gelombang berurutan yang direkam oleh spektrometer). Dalam beberapa kasus, terutama ketika konsentrasi target sangat rendah, pergeseran dapat lebih kecil daripada resolusi panjang gelombang spektrometer, sehingga sulit dideteksi seperti yang ditunjukkan dalam spektrum reflektansi pada Gambar 2i(b) dan tampilan yang diperbesar yang sesuai pada Gambar 2ii(b) sebelum dan setelah pengikatan target. Untuk mengatasi permasalahan ini, kami mengusulkan metode ESW, yang memungkinkan perhitungan ESW sebagai berikut,
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
i) Spektrum reflektansi pSiMC sebelum (pada waktu t = 0 menit) dan setelah pengikatan (pada waktu t = 50 menit) target untuk a) konsentrasi target yang tinggi b) rendah; ii) tampilan spektrum reflektansi yang diperbesar yang memperlihatkan panjang gelombang pusat MC untuk a) konsentrasi target yang tinggi b) rendah; iii) metode ESW yang diusulkan untuk pergeseran efektif relatif dalam panjang gelombang sebelum (pada waktu t = 0 menit) dan setelah pengikatan (pada waktu t = 50 menit) target untuk a) konsentrasi target yang tinggi b) rendah.
Penerapan metode ESW untuk biosensing ditunjukkan pada Gambar 2iii untuk konsentrasi target yang tinggi dan rendah yang sesuai dengan kasus yang dijelaskan dengan spektrum reflektansi pada Gambar 2i . Untuk kedua kasus, pertama spektrum reflektansi diperoleh dalam SB setiap 15 detik selama 10 menit diikuti dengan penyuntikan analit target dalam SB (insulin dalam PBS dalam kasus ini) dalam sel aliran. Data reflektansi kemudian dianalisis menggunakan kode MATLAB yang menghitung rasio reflektansi pada panjang gelombang pusat ke panjang gelombang berikutnya untuk setiap data yang direkam pada interval 15 detik. Pergeseran efektif relatif dalam panjang gelombang kemudian dihitung sebagai,
![]()
di mana ESW SB adalah pergeseran efektif dalam panjang gelombang sebelum menyuntikkan target SB campuran dalam sel aliran dan ESW TSB mengacu pada pergeseran efektif pada saturasi setelah pengenalan target dalam sel aliran. Penerapan metode ESW mengungkapkan pergeseran relatif sebesar 5×10 −3 ( pada Gambar 2iii(a) ) dan 0,5×10 −3 (pada Gambar 2iii(b) ) untuk konsentrasi analit yang lebih tinggi dan lebih rendah, masing-masing. Seperti yang terlihat, metode ESW menunjukkan perubahan yang dapat dikenali pada konsentrasi rendah, tidak seperti metode konvensional di mana pergeseran minimum yang dapat dideteksi bergantung pada resolusi spektrometer. Selain itu, metode ini dengan jelas membedakan antara pergeseran biru dan merah. Dalam kasus pergeseran biru, pergeseran efektif dalam panjang gelombang akan terus menurun atau akan selalu kurang dari nol. Selain itu, respons yang dihasilkan menggunakan metode ini dibandingkan dengan metode MWP dan hanya mendeteksi sinyal sebenarnya yang sesuai dengan pergeseran yang diamati hanya dalam panjang gelombang dan bukan amplitudo yang bertentangan dengan metode IAW yang cenderung mendeteksi sinyal derau palsu karena variasi dalam amplitudo spektrum reflektansi saat mengikat target ke permukaan. [ 17 ] Dalam literatur, metode ini banyak digunakan untuk interferometer lapisan tunggal. Perbandingan metode ESW yang diusulkan untuk konsentrasi target yang rendah dengan metode IAW dan MWP yang diterapkan pada pSiMC disajikan dalam Informasi Pendukung (Gambar S1 , Informasi Pendukung). Dibandingkan dengan metode IAW dan MWP, metode yang diusulkan dengan jelas membedakan perubahan yang terjadi karena adanya konsentrasi target yang rendah pada permukaan biosensor. Sepanjang pekerjaan ini, kami menggunakan metode ESW untuk mendeteksi pergeseran efektif dalam spektrum reflektansi pSiMC untuk mendeteksi pengikatan analit target.
2.2 Perancangan Biosensor Berbasis pSiMC
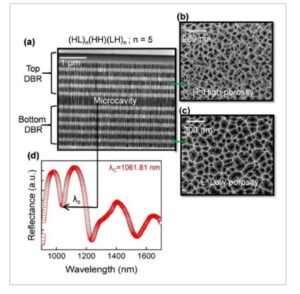
pSiMC dengan (HL) n HH(LH) n dengan n = 3, 5, dan 7 dibuat. SEM penampang melintang untuk struktur pSiMC dengan n = 5 (proses serupa diadopsi untuk n = 3 dan 7 untuk karakterisasi SEM) disajikan dalam Gambar 3a ( penampang melintang diperoleh dengan membelah sampel menggunakan pemotong berlian). Ketebalan total struktur ditemukan sebesar ≈4,5 µm sedangkan lapisan rongga ditemukan sebesar 400 ± 20 nm. Struktur pori permukaan lapisan porositas rendah dan tinggi yang digunakan dalam struktur MC diperoleh secara terpisah dengan membuat film lapisan tunggal dengan kondisi etsa yang sama seperti yang digunakan dalam desain MC. Gambar SEM permukaan lapisan porositas rendah dan tinggi disajikan dalam Gambar 3b,c . Diameter pori lapisan berporositas rendah ditemukan berada di antara 15–20 nm sedangkan untuk lapisan berporositas tinggi berada di kisaran 45–50 nm. Kedua lapisan memiliki struktur mesopori. Setelah pembuatan struktur MC, reflektansi optik diukur dan disajikan pada Gambar 3d . Panjang gelombang pusat (refleksi minimum) ditemukan sebesar 1061,8 nm.
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Karakteristik struktural pSiMC hasil fabrikasi a) penampang melintang pSiMC hasil fabrikasi dengan n = 5 yang dicitrakan menggunakan SEM; tampilan permukaan b) lapisan porositas rendah c) tinggi yang diperoleh menggunakan lapisan tunggal dengan kondisi serupa seperti yang digunakan dalam struktur pSiMC; d) spektrum reflektansi optik pSiMC hasil fabrikasi di udara yang diukur menggunakan spektrometer NIR.
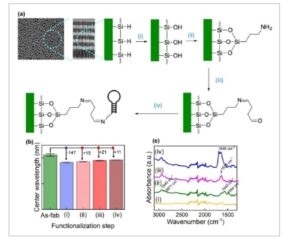
Setelah fabrikasi, rongga mikro silikon berpori distabilkan melalui oksidasi termal. Proses ini dilakukan pada 800 °C selama 1 jam dalam kondisi atmosfer, mengubah pSi menjadi silikon dioksida berpori (pSiO₂). Untuk biosensor optik, 800 °C ditetapkan sebagai suhu optimal untuk mencapai stabilitas dalam larutan SB pada pH netral. [ 8 ] Setelah stabilisasi permukaan, kimia silanisasi digunakan untuk memfungsikan pSiMC untuk menempelkan aptamer pengikat insulin seperti yang ditunjukkan pada Gambar 4 a . Perubahan yang diamati selama proses fungsionalisasi dilacak menggunakan teknik IRS dan FTIR dan digambarkan pada Gambar 4b,c , masing-masing. Dalam spektrum refleksi, pergeseran biru sebesar 146,8 nm diamati dalam spektrum refleksi setelah oksidasi termal pada 800 °C. Pergeseran panjang gelombang dihitung menggunakan metode konvensional dengan mengurangi panjang gelombang pusat sebelum dan sesudah oksidasi termal. Pergeseran biru ini disebabkan oleh konversi pSi menjadi pSiO2 , yang memiliki indeks bias lebih rendah, dan juga penyusutan struktur berpori yang mengurangi ketebalannya setelah perlakuan termal pada 800 °C. Untuk reaksi APTES, spektrum refleksi menunjukkan pergeseran merah sebesar 14,6 nm. Pergeseran merah ini disebabkan oleh perlekatan silana sebagaimana dibuktikan oleh munculnya vibrasi NH2 pada spektrum FTIR (1643 cm −1 ) pada Gambar 4c(ii) . Selain itu, setelah reaksi APTES, dua puncak serapan lainnya pada 2871 dan 2940 cm −1 yang sesuai dengan mode peregangan CH2 asimetris dan simetris dari rantai propil diamati dalam spektrum FTIR. Panjang gelombang pusat selanjutnya bergeser sebesar 21,0 nm setelah inkubasi glutaraldehida (GA) karena konjugasi pengikat silang dengan ikatan amina (Gambar 4b ). Pada spektrum FTIR, puncak absorbansi pada 1636 cm −1 mengonfirmasikan perlekatan GA (Gambar 4c(iii) ). Inkubasi semalaman aptamer berujung amina menghasilkan puncak amida pada 1646 dan 1692 cm −1 pada spektrum FTIR yang sesuai pada Gambar 4c(iv) dan pergeseran merah sebesar 11 nm pada spektrum reflektansi seperti yang digambarkan pada Gambar 4b .
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Fungsionalisasi permukaan pSiMC untuk mendeteksi insulin. a) Ilustrasi yang menggambarkan langkah-langkah fungsionalisasi i) oksidasi pSiMC dalam kondisi atmosferik pada suhu 800 °C, ii) silanisasi menggunakan APTES, iii) inkubasi dalam 10% glutaraldehida (GA) dalam SB, iv) inkubasi dalam aptamer; b) perubahan panjang gelombang pusat setelah setiap langkah fungsionalisasi, garis galat sesuai dengan deviasi standar dalam panjang gelombang pusat untuk n = 3; c) perubahan spektrum FTIR setelah setiap langkah fungsionalisasi.
2.3 Optimasi Kinerja Biosensor
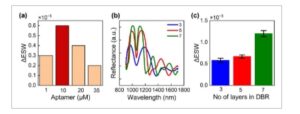
Untuk memperoleh kepadatan optimum bioreseptor pada permukaan, berbagai konsentrasi aptamer diuji seperti yang ditunjukkan pada Gambar 5a . Sampel fungsionalisasi GA diinkubasi dengan berbagai konsentrasi aptamer (1, 10, 20, dan 35 µM) dengan imobilisasi semalam pada suhu 4 °C, dicuci keesokan harinya, dan selanjutnya dimuat dalam sel aliran untuk melakukan eksperimen biosensing guna mendeteksi biomarker insulin sebagai bukti konsep. Sensogram diperoleh untuk masing-masing menggunakan metode yang dijelaskan di atas. Respons tertinggi diperoleh dengan konsentrasi aptamer 10 µM yang menunjukkan bahwa cakupan optimum telah tercapai. Untuk konsentrasi >10 µ, respons biosensor berkurang, mungkin karena efek halangan sterik. [ 20 – 22 ]
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Optimalisasi biosensor berbasis pSiMC (a) respons biosensor untuk konsentrasi insulin tetap (10 µM) terhadap berbagai konsentrasi aptamer (1, 10, 20, dan 35 µM) yang diinkubasi semalaman pada suhu 4 °C; b) spektrum reflektansi tiga pSiMC berbeda dengan 3, 5, dan 7 lapisan Bragg di cermin Bragg atas dan bawah yang membungkus rongga; c) respons biosensor untuk tiga pSiMC berbeda yang disajikan dalam (b), batang kesalahan menggambarkan deviasi standar yang diamati dalam ESW relatif untuk n = 3.
Sensitivitas sensor berbasis MC bergantung pada faktor-Q yang dijelaskan sebagai rasio panjang gelombang pusat terhadap lebar penuh pada setengah maksimum (FWHM). Sensitivitas yang lebih tinggi dicapai dengan nilai FWHM yang kecil. FWHM bergantung pada jumlah lapisan di reflektor Bragg atas dan bawah MC dan kontras indeks bias antara lapisan porositas tinggi dan rendah. Panjang gelombang pusat bergantung pada ketebalan lapisan spacer. Untuk desain MC, kontras indeks bias tinggi [1,35, 2,07] antara lapisan porositas bergantian dipilih untuk reflektivitas maksimum. Ketebalan lapisan spacer (d) dipilih berdasarkan panjang gelombang pusat (λ C ) sehingga,
![]()
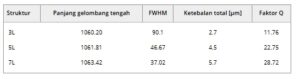
di mana η adalah indeks bias lapisan pengatur jarak. Kontras indeks bias dan panjang gelombang pusat dijaga konstan untuk memahami pengaruh jumlah lapisan (n) di cermin Bragg pada kinerja biosensor berbasis pSiMC. Gambar 5b menyajikan spektrum refleksi yang sesuai dengan tiga MC berbeda dengan jumlah lapisan reflektor Bragg sebagai 3, 5, dan 7. Panjang gelombang pusat masing-masing adalah ≈1060 nm, sehingga ketebalan lapisan pengatur jarak dijaga konstan. FWHM dan faktor Q dari MC ini tercantum dalam Tabel 1. Kinerja biosensor berbasis MC ini dipelajari secara eksperimental dengan insulin 10 µM sebagai target pengikatan. Sebelum peristiwa pengikatan, permukaan difungsionalkan dan aptamer pengikat insulin diimobilisasi menggunakan proses yang dijelaskan di bagian eksperimen. Perubahan relatif dalam pergeseran efektif panjang gelombang dihitung menggunakan metode ESW yang dijelaskan di bagian analisis data dan disajikan di sini pada Gambar 5c . MC dengan jumlah lapisan terbanyak yaitu 7 dan faktor-Q reflektor Bragg maksimum meskipun memiliki ketebalan maksimum ditemukan sebagai yang paling sensitif dari ketiganya seperti yang ditunjukkan pada Gambar 5c . Menariknya, pengamatan ini bertentangan dengan desain Fabry–Perrot di mana peningkatan ketebalan mengurangi sensitivitas biosensor. [ 21 ] Namun, dalam kasus MC, dengan peningkatan ketebalan (atau jumlah lapisan Bragg), sensitivitas meningkat seiring dengan penurunan FWHM dan faktor-Q MC meningkat. Simulasi spektrum reflektansi menggunakan perangkat lunak SCOUT untuk jumlah lapisan Bragg yang melebihi 7 menunjukkan penurunan reflektivitas pada panjang gelombang pusat; oleh karena itu, konfigurasi ini tidak diuji lebih lanjut.
Tabel 1. Karakteristik tiga pSiMC yang berbeda.
2.4 Kinerja In Vitro Biosensor Berbasis pSiMC
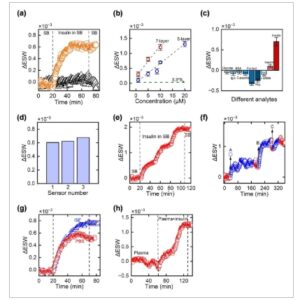
Untuk menilai kinerja biosensor secara in vitro, berbagai percobaan dilakukan untuk menguji sensitivitas, selektivitas, pengulangan, reproduktifitas, dan operasi berulang jangka panjang. Pertama, stabilitas pSi yang teroksidasi pada suhu 800 °C diuji dalam SB (PBS 10 mM pada pH 7,4). Spektrum reflektansi pSiMC yang teroksidasi diukur setiap 15 detik dalam SB selama >1 jam dan pergeseran efektif relatif pada panjang gelombang pusat dihitung dan disajikan dalam Gambar 6a ( segitiga biru). Variasi kecil sebesar ±0,1×1.
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Kinerja in vitro dari biosensor pSiMC a) pergeseran efektif relatif dalam panjang gelombang vs. waktu (sensogram) dalam SB dan insulin dalam SB untuk konsentrasi insulin 10 µ M ; b) kurva kalibrasi untuk MC 5-lapis dan 7-lapis, batang kesalahan menggambarkan deviasi standar yang diamati dalam ESW relatif untuk n = 3; (c) respons biosensor terhadap analit non-spesifik, glukosa (5,5 mM), C-peptida (0,66 µM), BSA (5 µM), kortisol (10 µM), Homosistein (Hcy-10 µM), laktat (2 mM), dan IgG (5 µM) dalam SB dibandingkan dengan insulin (1 dan 10 µM); d) reproduktifitas tiga biosensor berbeda yang disiapkan dalam kondisi serupa; e) respons biosensor untuk injeksi insulin berturut-turut untuk konsentrasi 10 µ M ; f) pemantauan berkelanjutan jangka panjang insulin, A, B, dan C mengacu pada waktu penyuntikan insulin dalam sel aliran dan sebelum setiap penyuntikan, biosensor dicuci dalam SB (A = 10 µM, B = 15 µM, C = 5 µM); g) perbandingan respons biosensor dalam SB dan ISF untuk konsentrasi insulin 10 µ m M; h) ESW relatif biosensor dalam plasma yang dicampur dengan insulin 10 dan 20 µM, selama 60 menit pertama, biosensor diinkubasi dalam plasma murni, diikuti oleh insulin yang dicampur dalam plasma selama 70 menit berikutnya dan kemudian pencucian terakhir dengan plasma murni selama 10 menit.
Berikutnya, kurva respons atau sensogram untuk mendeteksi insulin diperoleh dalam SB seperti yang ditunjukkan pada Gambar 6a (lingkaran oranye). Awalnya, spektrum reflektansi pSiMC diukur dalam SB selama 20 menit, dan kemudian insulin dalam SB (10 µ M ) disuntikkan ke dalam sel aliran. Volume larutan yang disuntikkan dalam sel aliran dijaga konstan (300 µL) untuk setiap percobaan. Dengan adanya insulin, sinyal respons meningkat selama 20 menit pertama dan kemudian jenuh. Peningkatan pergeseran efektif relatif dalam panjang gelombang pusat menunjukkan pergeseran merah dalam spektrum reflektansi karena peningkatan indeks bias matriks pSi setelah pengikatan insulin ke aptamer yang diimobilisasi pada permukaan pSi. Pencucian akhir dengan SB dilakukan setelah 50 menit untuk menghilangkan insulin yang tidak terikat dari pori-pori yang menyebabkan sedikit penurunan dalam pergeseran relatif panjang gelombang pusat.
Biosensor selanjutnya dinilai untuk berbagai konsentrasi insulin dalam SB untuk struktur pSiMC 5-lapis dan 7-lapis seperti yang ditunjukkan pada kurva kalibrasi pada Gambar 6b . Dengan peningkatan konsentrasi insulin dalam SB, pergeseran efektif relatif dalam panjang gelombang juga meningkat secara linear dan dapat disesuaikan dengan garis tren linear. LOD ditemukan sebesar 349 dan 209 nM menggunakan kurva kalibrasi untuk struktur MC 5-lapis dan 7-lapis, masing-masing. Meskipun besarnya pergeseran relatif lebih tinggi untuk MC 7-lapis, tidak ada perbedaan yang berarti dalam LOD teoritis. LOD untuk MC 7-lapis ditemukan lebih rendah daripada nilai yang dilaporkan sebelumnya menggunakan film Fabry–Perrot pSi (327 nM), [ 23 ] tetapi lebih tinggi daripada filter rugate pSi (29 nM). [ 22 ] Kemungkinan alasan untuk nilai LOD yang lebih tinggi bisa jadi karena keterbatasan yang diberlakukan oleh percepatan perpindahan massa karena massa dan difusi analit yang terhambat ke dalam pori-pori seperti yang diuraikan oleh Graham et al. dalam pekerjaan terbaru mereka. [ 11 , 24 ] Dalam kebanyakan kasus untuk interferometer berbasis pSi, terlepas dari ukuran, berat molekul biomolekul, dan jenis probe penangkap, konsentrasi dinamis yang dapat dideteksi dibatasi hingga 1 µM sementara LOD teoritis berada dalam kisaran ratusan nM (lihat Tabel S2 , Informasi Pendukung, untuk perbandingan dengan penelitian lain yang diterbitkan dalam literatur). [ 24 ] LOD dinamis dari biosensor optik dapat ditingkatkan dengan mengatasi keterbatasan aliran massa menggunakan saluran mikrofluida untuk mengurangi panjang difusi dan memungkinkan penetrasi analit yang mudah ke dalam pori-pori. [ 11 , 21 , 25 ] Berdasarkan laporan ini, kami yakin LOD insulin dapat ditingkatkan lebih lanjut setidaknya satu orde besaran. Namun, hal ini berada di luar cakupan penelitian ini. Meskipun demikian, tujuan utama penelitian ini adalah untuk menunjukkan potensi penggunaan pSiMC berbasis NIR dalam biosensor implan untuk pemantauan berkelanjutan biomarker dalam ISF, dengan insulin sebagai bukti konsep. Pendekatan ini dapat diperluas untuk mendeteksi biomarker lain yang relevan secara klinis.
Setelah menganalisis sensitivitas biosensor, selektivitasnya diuji. Selektivitas biosensor diselidiki dengan memperkenalkan berbagai biomolekul non-target lainnya termasuk glukosa (5,5 mM), C-peptida (0,66 µM), BSA (5 µM), kortisol (10 µM), homosistein (Hcy-10 µM), laktat (2 mM), dan IgG (5 µM) dalam SB dan responsnya dipantau dan disajikan dalam Gambar 6c . Biosensor menunjukkan penurunan dalam pergeseran efektif relatif dalam panjang gelombang yang menunjukkan pergeseran biru dari semua biomolekul ini sementara untuk insulin pada konsentrasi 1 µM, peningkatan yang jelas dalam pergeseran efektif relatif dalam panjang gelombang yang menunjukkan pergeseran merah yang relatif lebih tinggi dalam besarnya dibandingkan dengan analit lain diperoleh. Pergeseran merah ini lebih ditingkatkan ketika konsentrasi insulin ditingkatkan dari 1 hingga 10 µM. Pergeseran merah mengonfirmasi pengikatan insulin ke aptamer yang diimobilisasi pada permukaan pSiMC, sementara pergeseran biru menunjukkan penghilangan molekul tak terikat dari pori-pori. Hal ini jelas menunjukkan selektivitas aptamer pengikat insulin yang hanya mengikat insulin dan tidak ada analit lain.
Kemampuan pengulangan biosensor diperiksa dengan membuat tiga biosensor (n = 3) pada saat yang sama dalam kondisi yang sama mengikuti protokol yang sama. Ketiga biosensor kemudian disuntik dengan insulin dalam SB (10 µM dalam SB) dalam sel aliran dan pergeseran relatif dalam panjang gelombang dihitung untuk masing-masing seperti yang ditunjukkan pada Gambar 6d . Biosensor menunjukkan kemampuan pengulangan yang sangat baik dengan deviasi standar 3,75 × 10 −5 dalam pergeseran efektif relatif dalam panjang gelombang.
Reproduktifitas biosensor diuji untuk konsentrasi insulin yang tetap. Garis dasar ditetapkan menggunakan aliran SB selama 20 menit, diikuti dengan penyuntikan insulin 10 µM dalam SB. Setelah 20 menit, sinyal jenuh, yang menunjukkan pengikatan penuh insulin ke aptamer Gambar 6e . Penyuntikan insulin tambahan pada konsentrasi yang sama dilakukan setiap 30 menit, diulang tiga kali. Setiap penyuntikan menghasilkan pergeseran efektif relatif yang konsisten dalam panjang gelombang yang proporsional dengan konsentrasi insulin yang menunjukkan reproduktifitas yang sangat baik.
Kinerja biosensor untuk pemantauan insulin waktu nyata selama periode yang diperpanjang kemudian dinilai, dengan sensogram yang sesuai ditunjukkan pada Gambar 6f untuk berbagai konsentrasi insulin (10, 15, dan 5 µM). Sebelum setiap injeksi insulin, biosensor dibilas dalam SB untuk menghilangkan insulin yang tidak terikat. Untuk setiap injeksi, pergeseran efektif relatif dalam panjang gelombang pertama kali meningkat selama ≈20 menit setelah injeksi dan kemudian stabil. Beberapa fluktuasi dalam respons diamati setelah injeksi pertama, kemungkinan karena adanya gelembung udara yang terperangkap di dalam sel aliran. Perubahan dalam panjang gelombang pusat ini ditemukan sebanding dengan konsentrasi insulin yang disuntikkan. Biosensor dioperasikan terus menerus selama 6 jam, dengan potensi untuk penggunaan lebih lanjut kecuali konsentrasi aptamer menjadi jenuh.
Gambar 6g menunjukkan kinerja analitis biosensor dalam ISF buatan (aISF) dan juga dibandingkan dengan SB. aISF digunakan untuk mereplikasi lingkungan yang mirip dengan ISF kulit dan mengandung 5 mM glukosa, 3,5 mM KCl, 10 mM HEPES, 1,5 mM NaH 2 PO 4 , 7,4 mM sukrosa, 123 mM NaCl, dan 3,5 mM KCl. [ 26 ] Untuk kedua kasus, pada konsentrasi insulin tetap (10 µM) perubahan serupa pada sinyal diamati.
Berikutnya, kami menilai kinerja biosensor dalam plasma yang diperoleh dari tikus yang sehat. Biosensor pertama kali diekspos ke plasma yang diencerkan (rasio 1:8) dari tikus yang sehat selama hampir 1 jam. Tidak ada peningkatan signifikan dalam ESW relatif yang diperoleh selama periode paparan 1 jam seperti yang ditunjukkan pada Gambar 6h . Ini diharapkan karena konsentrasi insulin dalam plasma tikus yang sehat sangat rendah di luar batas deteksi biosensor optik. [ 27 ] Namun, peningkatan ESW relatif diperoleh setelah menambahkan insulin ke plasma (10 µM) yang selanjutnya berlipat ganda ketika konsentrasi insulin ditingkatkan menjadi 20 µM.
2.5 Sitotoksisitas In Vitro
Tidak adanya sitotoksisitas bahan biosensor terhadap sel manusia merupakan persyaratan penting untuk sensor yang dapat dikenakan dalam perawatan kesehatan. Dengan demikian, kami menguji biosensor berbasis pSiMC untuk potensi sitotoksisitas menggunakan sel fibroblas dermal (HDF) manusia. Secara khusus, kami menumbuhkan sel HDF langsung pada sensor dan juga memaparkan sel ke media yang diinkubasi sensor (yaitu, supernatan). Sel-sel diwarnai dengan Hoechst (pewarna tandingan nuklir), kalsein (sel yang hidup), dan propidium iodida (sel yang mati) dan dibandingkan dengan kontrol, yaitu sel yang tidak diobati dan yang diobati dengan DMSO dalam peralatan kultur jaringan biasa ( Gambar 7 a ). Viabilitas sel >92,5% diamati tanpa deviasi yang signifikan secara statistik dari kontrol yang hidup ( Gambar 7b ). Hasilnya menunjukkan bahwa sensor akan cocok untuk implantasi subkutan.

Gambar 7
Buka di penampil gambar
Kekuatan Gambar
Uji sitotoksisitas biosensor berbasis pSiMC menggunakan sel fibroblas dermal manusia (HDF) setelah inkubasi 24 jam. a) Gambar contoh sel HDF yang dikultur pada sensor dan terpapar pada media yang diinkubasi sensor (supernatan) serta kontrol yang hidup dan yang diobati dengan DMSO. Sel-sel diwarnai dengan Hoechst (pewarna tandingan, biru), kalsein (hidup, hijau), dan propidium iodida (mati, merah); b) perbandingan kelangsungan hidup sel terhadap empat kondisi kultur (pada sensor, supernatan, kontrol hidup, diobati dengan DMSO). Kondisi yang melibatkan biosensor berbasis pSiMC tidak menunjukkan deviasi yang signifikan secara statistik (n = 3) dari kontrol hidup (ns; ANOVA dengan uji Tukey post hoc, P>0,05).
2.6 Kinerja Ex Vivo Biosensor Berbasis pSiMC
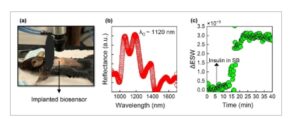
Biosensor berbasis pSiMC ditanamkan secara subkutan pada model tikus yang disuntik mati seperti yang diilustrasikan pada Gambar 8a untuk pengujian eks vivo. Pengukuran latar belakang referensi dilakukan pada kulit tikus tanpa sensor yang ditanamkan untuk memastikan bahwa sinyal reflektansi hanya berasal dari biosensor setelah ditempatkan di bawah kulit. Panjang gelombang pusat ditemukan sebesar 1119,7 nm sebagaimana diukur dari spektrum pantulan pada Gambar 8b yang diperoleh dari pSiMC yang ditanamkan di bawah kulit tikus. Panjang gelombang pusat ini serupa dengan yang diperoleh di SB selama analisis in vitro.
Gambar 8
Buka di penampil gambar
Kekuatan Gambar
Pengujian eks vivo biosensor di bawah kulit tikus a) biosensor berbasis pSiMC yang ditanamkan di bawah kulit tikus; b) spektrum reflektansi yang diperoleh dari biosensor yang ditanamkan di bawah kulit tikus seperti yang diilustrasikan dalam (a); c) pergeseran relatif dalam panjang gelombang pusat yang diamati setelah injeksi subkutan insulin (35 µM) yang dicampur dalam buffer standar (SB).
Untuk bukti konsep, biosensor yang ditanamkan diperiksa untuk pemantauan insulin secara terus-menerus dan secara waktu nyata. Setelah menanamkan biosensor, spektrum reflektansi direkam dan awalnya tidak ada perubahan signifikan pada sinyal seperti yang ditunjukkan pada Gambar 8c . Hal ini diharapkan karena biosensor tidak dapat mendeteksi kadar insulin bawaan yang rendah yang ada dalam kisaran nM yang lebih rendah pada tikus yang sehat. Namun, setelah injeksi subkutan PBS dengan konsentrasi insulin ≈35 µM, peningkatan signifikan pada sinyal diamati. Sinyal menjadi stabil setelah <20 menit mirip dengan sinyal yang diperoleh selama analisis in vitro. Tujuan dari analisis ex vivo adalah untuk meniru implantasi biosensor secara in vivo untuk mendapatkan reflektansi melalui kulit di jendela NIR-II dan menetapkan bukti konsep untuk mendeteksi insulin. Secara keseluruhan, percobaan ex vivo menggambarkan implantasi biosensor pSiMC yang berhasil di bawah kulit, memperoleh sinyal optik melalui kulit dengan rasio sinyal terhadap derau yang rendah, dan memungkinkan deteksi biomarker secara waktu nyata di ISF.
3 Kesimpulan
Singkatnya, kami mengembangkan biosensor implan baru yang memanfaatkan NIR pSiMC dan berhasil menunjukkan potensinya untuk pemantauan insulin secara real-time sebagai bukti konsep melalui implantasi subkutan pada tikus yang di-eutanasia. Kami menyajikan pendekatan baru yang layak untuk menganalisis pergeseran panjang gelombang pusat rongga mikro fotonik, yang tidak dibatasi oleh resolusi spektrometer dan cocok untuk mendeteksi konsentrasi rendah biomarker. Kami selanjutnya mengoptimalkan kinerja biosensor dalam hal konsentrasi aptamer dan jumlah lapisan di cermin Bragg atas dan bawah yang menutupi MC. Kami menemukan bahwa MC 7 lapis dengan faktor Q tinggi menunjukkan nilai respons yang lebih tinggi dibandingkan dengan MC 3 lapis dan 5 lapis. Namun, LOD dinamis dari MC 7 lapis tetap hampir mirip dengan MC 5 lapis yang menunjukkan bahwa LOD dibatasi oleh pembatasan yang diberlakukan karena transportasi massa dan kebisingan dalam sistem optik. Biosensor menunjukkan pengulangan dan reproduktifitas yang sangat baik, dengan kinerja yang konsisten di beberapa sensor yang dibuat dalam kondisi yang identik, yang menggarisbawahi keandalannya untuk aplikasi praktis. Biosensor menunjukkan kemampuan untuk pemantauan insulin terus-menerus selama periode hingga 6 jam, yang menunjukkan potensinya untuk penggunaan klinis yang lebih lama. Pengoperasiannya yang efektif dalam aISF dan dalam plasma yang diperoleh dari tikus yang sehat semakin mendukung kelayakannya untuk aplikasi di dunia nyata. Penanaman biosensor yang berhasil pada tikus yang disuntik mati menegaskan kemampuannya untuk mendeteksi insulin secara real time, yang menggambarkan kelayakan penerapan teknologi ini untuk pemantauan in vivo.
Sebagai kesimpulan, penelitian ini menetapkan landasan dasar untuk pengembangan biosensor implan yang memanfaatkan teknologi pSiMC untuk pemantauan berkelanjutan biomarker kritis secara in vivo. Penelitian di masa mendatang harus difokuskan pada pengoptimalan rentang dinamis dan peningkatan batas deteksi melalui metode seperti integrasi mikrofluida dan peningkatan material. Pendekatan ini menjanjikan perluasan aplikasi dalam pemantauan berbagai biomarker yang relevan secara klinis, sehingga meningkatkan perawatan dan manajemen pasien dalam konteks penyakit kronis.
Bagian Percobaan 4
Bahan
Wafer silikon tipe-p yang didoping boron (berorientasi (100), resistivitas-0,5-1,0 mΩ cm, diameter 6″, dan ketebalan ≈500 µ) dibeli dari Siltronix (Prancis). Aptamer pengikat insulin yang dimodifikasi 5’NH2 ( /5AmMC6/GG TGG TGG GGG GGG TTG GTA GGG TGT CTT C) sebagai bubuk liofilisasi dengan tingkat pemurnian HPLC diperoleh dari Integrated DNA Technology (Australia). Reagen yang tersisa dibeli dari Sigma–Aldrich (Australia) kecuali dinyatakan lain.
Pembuatan dan Karakterisasi pSiMC
pSiMC dibuat menggunakan etsa elektrokimia silikon tipe-p berukuran 6 inci, yang didoping boron, dengan resistivitas 0,5–1,0 mΩ cm, dan orientasi kristal <100>. Rincian lain tentang pembuatannya disertakan dalam Informasi Pendukung.
Fungsionalisasi pSiMC
pSiMC yang dibuat sebagaimana mestinya dioksidasi pada 800 °C dan selanjutnya diolah dengan 5% 3-aminopropyl) triethoxysilane) (APTES) dalam toluena anhidrat di bawah aliran N 2 selama 30 menit. pSiMC kemudian dibilas secara menyeluruh dalam toluena dan etanol 3–5 kali untuk menghilangkan APTES yang tidak bereaksi. Selanjutnya, sampel dipanaskan pada hotplate pada 110 °C selama 10 menit. Sampel kemudian didinginkan hingga suhu ruangan dan diinkubasi dalam glutaraldehida (10% dalam phosphate-buffered saline (PBS) pada pH 7,4) selama 1 jam. pSiMC kemudian dibilas secara menyeluruh dalam PBS dan selanjutnya diinkubasi dalam aptamer pengikat insulin (1, 10, 20, dan 35 µ M ) dalam PBS semalaman pada 4 °C. Sebelum inkubasi, aptamer dipanaskan pada suhu 95 °C selama 5 menit. Keesokan harinya, pSiMC yang diimobilisasi dengan aptamer dicuci dalam PBS untuk menghilangkan aptamer tak terkonjugasi tambahan di permukaan. Untuk mencegah pengikatan non-spesifik, sampel diinkubasi dalam 1 mg mL −1 bis-PEG amina selama 1 jam.
Karakterisasi Aptasensor pSiMC
Morfologi pori dan profil ketebalan pSiMC yang difabrikasi dianalisis menggunakan mikroskop elektron pemindaian (SEM) (FEI Nova NanoSEM) pada tegangan percepatan 5 keV. Perubahan kimia permukaan yang diamati selama proses fungsionalisasi permukaan pSiMC dianalisis menggunakan spektroskop Perkin-Elmer (Spectrum 3, MIR/NIR) dalam mode Fourier-transform infrared (ATR-FTIR) yang dipantulkan total yang dilemahkan. Semua eksperimen biosensing dilakukan dalam sel aliran plexiglass, yang rinciannya disajikan dalam Informasi Pendukung.
Deteksi dalam Plasma Tikus yang Sehat
Plasma tikus sehat untuk mendeteksi insulin diperoleh dari Monash Animal Research Platform (MARP). Plasma diencerkan dengan SB dalam rasio 1:8. Awalnya, nilai dasar diperoleh dengan menginkubasi biosensor dalam plasma selama 1 jam dan kemudian ditambahkan insulin selama 30 menit pada berbagai konsentrasi dan pencucian terakhir dengan plasma murni selama 10 menit.
Kultur Sel dan Pengujian Sitotoksisitas
Sel fibroblas dermal manusia (HDF) (ThermoFisher, #C0045C, neonatal, passages 2‑4) digunakan untuk menguji potensi sitotoksisitas biosensor berbasis pSiMC. Rincian lebih lanjut terkait kultur sel disertakan dalam Informasi Pendukung. Mikroskopi fluoresensi dilakukan masing-masing menggunakan mikroskop confocal Leica Stellaris 5 dan Sistem Pencitraan ThermoFisher EVOS M5000. Data dihasilkan dari tiga percobaan. Gambar dianalisis menggunakan CellProfiler 4.2.7. [ 28 ] Sel diidentifikasi dalam saluran Hoechst (nukleus) dan diklasifikasikan berdasarkan intensitas gating dalam saluran kalsein. Uji signifikansi dilakukan menggunakan ANOVA satu arah dengan uji Tukey post hoc (p>0,05 dianggap tidak signifikan).
Implantasi Biosensor Ex Vivo
Untuk implantasi biosensor secara ex vivo, tikus yang di-eutanasia berusia 12 minggu (strain berlebih) diperoleh dari Monash University Research Platform (MARP). Eksperimen ini dilakukan pada tikus yang dibasmi strain berlebih, dan karenanya, tidak diperlukan persetujuan etika hewan sesuai kebijakan MARP. Sebelum implantasi biosensor, rambut di sisi punggung tikus dicukur menggunakan krim penghilang rambut (Nair) dan dicuci bersih dengan air Milli-Q setelahnya. Kemudian dibuat sayatan kecil menggunakan pisau bedah dan biosensor kemudian ditanamkan.
Analisis Statistik
Spektrum reflektansi dianalisis menggunakan kode MATLAB. Kode tersebut menghasilkan satu berkas Excel yang memuat semua data reflektansi untuk satu rangkaian eksperimen dan menghitung pergeseran efektif panjang gelombang. Untuk metode IAW dan ESW, perangkat lunak yang disediakan oleh penulis digunakan.
Batang kesalahan (pada Gambar 4 – 6 , dan 7 ) sesuai dengan deviasi standar yang diamati dalam data untuk ukuran sampel, n = 3. Untuk evaluasi sitotoksisitas, uji signifikansi dilakukan menggunakan ANOVA satu arah dengan uji Tukey post hoc (Gambar 7 ).
Pernyataan Persetujuan Etika
Hewan yang digunakan dalam percobaan diambil dari Monash Animal Research Platform Rodent Breeding Colony, yang memiliki ID proyek 27334 yang disetujui AEC. Sesuai dengan “Pengambilan untuk memperoleh bahan hewani untuk penggunaan ilmiah” Universitas Monash, persetujuan AEC tidak diperlukan untuk pengambilan atau penggunaan jaringan dari hewan yang mati, jika hewan tersebut telah dibunuh untuk tujuan lain berdasarkan proyek yang disetujui AEC. Dalam proyek ini, hewan yang digunakan dibunuh karena merupakan stok pembiakan berlebih.





Tinggalkan Balasan