Abstrak
Rongga nano polimer yang terintegrasi dengan molekul fungsional untuk mendeteksi vesikel ekstraseluler (EV) disiapkan melalui polimerisasi templat dan pasca-modifikasi multilangkah. Polimer multifungsi yang mengandung gugus amino tersier untuk berinteraksi dengan nanopartikel silika templat (NP) dan gugus metakrilat yang dapat dipolimerisasi disiapkan dan dikomplekskan dengan NP silika 500 nm. Kompleks tersebut diimobilisasi secara monodispersif pada gugus karboksil dan gugus Br yang dimasukkan ke substrat kaca berlapis Au. Selain itu, polimerisasi radikal transfer atom yang diinisiasi permukaan dari 2-metakriloiloksietil fosforilkolin dilakukan untuk membentuk lapisan polimer yang biokompatibel. Setelah NP silika dihilangkan, ikatan disulfida dibelah menggunakan tris(2-karboksietil)fosfin untuk menghilangkan komponen polimer multifungsi, menghasilkan rongga nano yang terpapar gugus tiol. Tingkat fungsionalisasi dikontrol dengan mengubah rasio pencampuran pewarna fluoresen dan non-fluoresen. Nanorongga multifungsional disiapkan dengan memasukkan pewarna fluoresen dan gugus asam nitrilotriasetat, diikuti oleh protein G berlabel His dan antibodi untuk protein CD9, menghasilkan antarmuka nano penginderaan EV. Antarmuka pensinyalan fluoresen ini merespons EV dengan cara yang bergantung pada konsentrasi, dengan batas deteksi yang diperkirakan sebesar 0,1 fM. Respons ini tidak diamati saat antibodi referensi dimasukkan, yang mengonfirmasi fungsionalisasi selektif rongga. Metode yang diusulkan berguna untuk membuat antarmuka nano multifungsi di bidang ilmu hayati.
1 Pendahuluan
Vesikel ekstraseluler (EV) adalah nanovesikel yang tersusun dari lapisan lipid dan berukuran ≈30–150 nm. [ 1 , 2 ] Mereka disekresikan dari sel dan terdapat dalam cairan tubuh seperti darah, saliva, [ 3 ] urin, [ 4 ] dan cairan air mata. [ 5 ] Bagian dalamnya mengandung protein, metabolit, dan asam nukleat (mRNA, mikroRNA (miRNA), dan asam deoksiribonukleat) yang berasal dari sel sekretori yang memainkan peran penting dalam komunikasi antar sel. EV juga disekresikan oleh sel kanker dan dikaitkan dengan metastasis, invasi, dan pertumbuhan. [ 6 ] Dengan demikian, mereka telah menarik perhatian besar dalam penelitian kanker dalam beberapa tahun terakhir.
Berbagai strategi telah dilaporkan untuk mendeteksi dan mengkarakterisasi EV. [ 1 , 7 ] Dalam strategi ini, miRNA dan protein yang tertanam di dalam dan/atau di luar EV (EV) dianalisis menggunakan metode yang sudah mapan seperti reaksi berantai polimerase (PCR) waktu nyata, uji imunosorben terkait enzim, western blotting, dan spektrometri massa yang dikombinasikan dengan kromatografi cair. Metode analisis ini biasanya melibatkan pra-perlakuan yang memakan waktu dan membosankan seperti ultracentrifugasi dan/atau kromatografi pengecualian ukuran. Baru-baru ini, teknologi pemurnian yang efektif telah dilaporkan; namun, diperlukan instrumen khusus dan mahal. [ 8 ] Untuk analisis EV yang cepat dan mudah, metode yang menggunakan EV utuh sangat ideal karena tidak diperlukan pra-perlakuan, seperti pemurnian dan ekstraksi RNA dan protein dari EV.
Sebelumnya, rongga nano polimer terintegrasi molekul fungsional telah disiapkan dan terbukti sangat sensitif dan selektif untuk mendeteksi EV utuh dalam cairan air mata, [ 9 ] di mana antibodi yang menargetkan antigen yang terpapar pada permukaan EV untuk menangkap EV dan pewarna fluoresen untuk pembacaan peristiwa pengikatan EV diintegrasikan ke dalam rongga nano polimer. Rongga nano polimer ini disiapkan menggunakan metode nanoproses kimia (DM) pencetakan dinamis yang terinspirasi oleh pencetakan molekuler [ 10 – 12 ] dan strategi modifikasi pasca-pencetakan [ 13 , 14 ] . Dalam metode ini, nanopartikel silika termodifikasi (NP) digunakan sebagai templat untuk pembuatan rongga nano polimer dengan ukuran yang mirip dengan EV dan untuk transplantasi gugus fungsional, di mana tag histidin (His-tag) untuk imobilisasi permukaan chip sensor melalui kompleksasi Ni 2+ -nitrilotriacetic acid (NTA) dan His-tag serta gugus metakrilat yang dapat dipolimerisasi yang terhubung ke NP silika melalui ikatan disulfida dimodifikasi pada NP silika. Rongga nano polimer disiapkan melalui metode DM menggunakan NP silika termodifikasi sebagai templat, diikuti dengan penghilangan templat melalui reduksi ikatan disulfida dan gangguan interaksi khelat antara Ni 2+ -NTA dan His-tag. Integrasi molekul fungsional dilakukan dengan menggunakan gugus tiol dan Ni 2+ -NTA yang tersisa di dalam rongga nano polimer. Kemudian, pewarna sinyal fluoresen dikonjugasikan ke gugus tiol, dan antibodi dimasukkan melalui protein G berlabel His. Dalam proses ini, desain templat memainkan peran penting dalam menciptakan antarmuka nano fungsional yang disesuaikan dengan tujuan masing-masing. Akan tetapi, modifikasi nanomaterial ini tetap menantang karena ketidakstabilannya dalam media berair, yang menyebabkan agregasi.
Dalam studi ini, modifikasi NP silika yang mudah dan stabil dicapai dengan menggunakan polimer fungsional yang dapat dipolimerisasi (FP), dan NP silika yang diperoleh digunakan sebagai templat untuk persiapan rongga nano polimer yang terintegrasi dengan molekul fungsional melalui metode DM. FP yang dapat dipolimerisasi terdiri dari gugus amino basa yang berinteraksi dengan NP silika dan gugus metakrilat yang dapat dipolimerisasi yang terhubung ke tulang punggung polimer melalui ikatan disulfida. Karena fungsionalitas yang diperlukan digabungkan ke dalam FP senyawa tunggal, modifikasi satu langkah dan fungsionalisasi NP silika tercapai. Sifat pengikatan FP terhadap NP silika dan potensi pengiriman gugus fungsional selektif rongga diselidiki. Selain itu, sifat penginderaan EV dari rongga nano polimer yang terintegrasi dengan molekul fungsional yang disiapkan menggunakan FP diselidiki ( Gambar 1 ).
 Gambar 1
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Skema persiapan rongga nano polimer yang terintegrasi dengan molekul fungsional. A) Pembentukan templat melalui kompleksasi FP dan NP silika; B) imobilisasi templat pada chip sensor berlapis Au yang dimodifikasi oleh gugus karboksi yang disiapkan melalui pembentukan lapisan tunggal yang dirakit sendiri; C) pembentukan lapisan poliMPC melalui polimerisasi radikal transfer atom yang diinisiasi oleh permukaan; D) penghilangan NP silika; E) penghilangan bagian FP melalui reduksi ikatan disulfida; F) & G) fungsionalisasi berurutan dalam rongga nano polimer melalui kimia tiol–maleimida, menghasilkan rongga nano polimer yang terintegrasi dengan molekul fungsional.
2 Hasil dan Pembahasan
FP untuk pengiriman gugus fungsi selektif lokasi di dalam rongga nano dirancang dan disintesis. N- isopropilakrilamida (NIPAm), sebagai komponen utama yang larut dalam air; N- (3-dimetilaminopropil)metakrilamida (DMAPMA), untuk interaksi dengan NP silika yang dimodifikasi oleh asam karboksilat; dan N -metakriloil- N ‘-( t -butoksikarbonil)sistamin (Boc-Cys-MA) yang mengandung ikatan disulfida sebagai bagian yang dapat dimodifikasi untuk pasca-modifikasi dikopolimerisasi dengan adanya agen reaksi berantai adisi-fragmentasi reversibel (RAFT). Setelah polimerisasi dan deproteksi gugus Boc pada residu Boc-Cys-MA melalui perlakuan HCl, N -suksimidil metakrilat bereaksi dengan gugus amino pada polimer untuk memperkenalkan gugus yang dapat dipolimerisasi, menghasilkan polimer multifungsi. Proporsi setiap komponen diperkirakan melalui pengukuran resonansi magnetik nuklir proton ( 1H -NMR), dan rasio NIPAm/DMAPMA/Boc-Cys-MA ditetapkan sebesar 3/1/1. Percobaan 1H -NMR juga mengungkapkan bahwa setiap langkah modifikasi berhasil dilakukan (Gambar S1 , Informasi Pendukung); puncak pada 1,39 ppm yang sesuai dengan gugus Boc menghilang setelah proses deproteksi (P1→P2), dan puncak yang sedikit lebih lebar pada 5,67 dan 5,35 ppm yang sesuai dengan gugus vinil diamati setelah metakrilasi (P2→FP). Pelebaran puncak menunjukkan bahwa gugus metakrilat telah tergabung ke dalam struktur polimer. Massa molekul ( Mn ) dari FP diperkirakan melalui pengukuran kromatografi permeasi gel (GPC) sebesar 5,9 × 103 g / mol dan Mw / Mn = 1,2. Dispersi massa rendah dari FP diperoleh karena efek agen RAFT yang ditambahkan selama polimerisasi.
Interaksi antara FP yang disiapkan dan NP silika templat diselidiki menggunakan pengukuran hamburan cahaya dinamis (DLS). NP silika (500 nm), dengan gugus asam karboksilat yang dimasukkan ke permukaannya, digunakan sebagai templat. Larutan FP berair (1,0 mg mL −1 ) diinkubasi dengan NP silika (1,67 mg mL −1 ). Seperti yang ditunjukkan pada Gambar S2 (Informasi Pendukung), ukuran partikel hampir sama atau sedikit lebih tinggi setelah interaksi dengan FP, dan indeks polidispersitas rendah (<0,02), yang menunjukkan bahwa monodispersitas partikel dipertahankan setelah inkubasi dengan FP. Potensial Z dengan dan tanpa FP mengungkapkan bahwa NP silika yang dimodifikasi oleh gugus COOH bermuatan negatif (–54,3 mV) diubah menjadi partikel dengan permukaan bermuatan positif (+48,3 mV). Mereka juga menunjukkan bahwa FP diadsorpsi pada NP silika melalui interaksi elektrostatik dan bahwa muatan permukaan NP silika terbalik. Permukaan bermuatan positif kuat ini mendorong dispersi stabil dalam larutan. Oleh karena itu, FP yang disiapkan berinteraksi dengan NP silika dan membentuk kompleks yang stabil. Sifat pengikatan FP yang bergantung pada konsentrasi diselidiki menggunakan FP berlabel rhodamine B (FP-RB) sebagai indikator. Seperti yang ditunjukkan pada Gambar 2a , jumlah FP yang terikat dengan NP silika meningkat seiring dengan konsentrasi FP. Konstanta pengikatan ( Ka ) diperkirakan sebesar 7,0×10 5 M −1 . Untuk monomer kationik DMAPMA, Ka dihitung sebesar 9,8 × 10 3 M −1 . Secara konvensional, Ka dari interaksi elektrostatik antara monomer adalah 10 2 –10 4 M −1 , yang menunjukkan bahwa beberapa interaksi antara residu kationik FP dan gugus karboksil pada NP silika berkontribusi pada pembentukan kompleks FP–NP silika. Oleh karena itu, kompleks yang stabil ini cocok sebagai templat untuk persiapan rongga nano polimer.
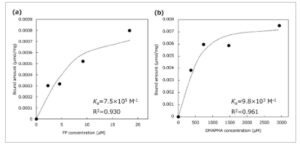 Gambar 2
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Isoterm pengikatan untuk NP silika yang dimodifikasi gugus karboksil (500 nm): a) FP dan b) DMAPMA.
Untuk mengonfirmasi pengiriman gugus fungsi selektif rongga melalui polimerisasi templat menggunakan NP silika FP sebagai templat, pengukuran mikroskopi fluoresensi dilakukan. NP silika berlabel fluoresensi hijau (500 nm; dimodifikasi gugus COOH) digunakan sebagai inti templat, dan lapisan poli (2-metakriloiloksietil fosforilkolin) (poliMPC) disiapkan ( Gambar 3a ). Ketebalan lapisan poliMPC diperkirakan melalui elipsometri sebesar 20 nm. Bintik-bintik terang fluoresensi dengan ukuran <2 µm yang berasal dari NP silika diamati melalui pencitraan fluoresensi (lensa objektif, 60×; filter, GFP; λ Ex , 440–470 nm; λ Em , 525–550 nm). Titik-titik terang fluoresensi yang diamati diimobilisasi dalam cara monodispersi pada substrat, yang menunjukkan bahwa kompleks FP–NP silika dimonodispersi karena tolakan elektrostatik yang dihasilkan dari residu monomer bermuatan positif dari FP. Kecenderungan ini dikonfirmasi oleh pengukuran mikroskop elektron pemindaian (SEM) (Gambar S3 , Informasi Pendukung). Ukuran titik-titik terang fluoresensi yang diamati (≈2 µm) melebihi ukuran sebenarnya NP silika (500 nm) karena ukuran NP silika mendekati batas difraksi. Setelah pencucian dan sonikasi dalam MeOH/AcOH (4/1, v/v), titik-titik fluoresensi terang menghilang (Gambar 3b ), yang menyiratkan bahwa NP silika yang diimobilisasi telah sepenuhnya dihilangkan dari permukaan substrat. Substrat kemudian diperlakukan dengan tris(2-karboksietil)fosfina (TCEP) untuk mengurangi ikatan disulfida dalam residu FP di dalam rongga polimer. Setelah dicuci dengan air, pewarna fluoresensi reaktif-thiol AlexaFluor647-maleimide direaksikan dengan gugus thiol yang terekspos ke rongga nano polimer. Titik-titik terang fluoresensi yang berasal dari AlexaFluor647 diamati (Gambar 3c ), mirip dengan kasus NP silika yang diperiksa dengan pengukuran fluoresensi (filter, Cy5; λ Ex , 620–660 nm; λ Em , 700–775 nm). Kesamaan dalam jumlah titik terang antara NP silika dan AlexaFluor647 (Gambar 3d,e , masing-masing) menunjukkan bahwa pewarna fluoresensi dimasukkan ke dalam rongga nano polimer yang disiapkan melalui polimerisasi templat menggunakan NP silika. Ini menyiratkan bahwa gugus thiol yang berasal dari FP dapat berhasil dihantarkan ke rongga nano polimer.
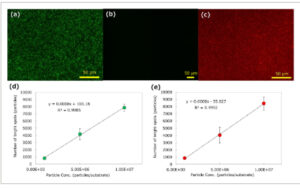 Gambar 3
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Pengukuran fluoresensi rongga nano polimer melalui perlakuan berurutan dengan TCEP dan pewarna fluoresensi: a) setelah polimerisasi pada substrat terimobilisasi kompleks FP–silika NP (lensa objektif, 60×; filter, GFP); b) setelah penghilangan NP silika (lensa objektif, 22×; filter, GFP); c) setelah perlakuan TCEP diikuti oleh konjugasi maleimida AlexaFluor647 C2 (lensa objektif, 60×; filter, Cy5); jumlah bintik fluoresensi terang berkenaan dengan jumlah kompleks FP–silika NP yang diimobilisasi, d) NP silika, dan e) AlexaFluor647.
Integrasi molekul multifungsi dalam rongga nano polimer dicapai melalui ko-introduksi pewarna fluoresen dan protein. Lapisan polimer biokompatibel disiapkan melalui ATRP yang diinisiasi permukaan dari MPC karena biokompatibilitasnya yang tinggi. [ 15 ] Setelah reduksi dengan TCEP, dua senyawa reaktif tiol—maleimida AlexaFluor488 C5 dan maleimida-C3-NTA (masing-masing 50 µ m )—direaksikan dengan gugus tiol dalam rongga nano polimer. Gugus NTA yang dimasukkan dikomplekskan dengan ion Ni 2+ melalui penambahan larutan NiCl 2 berair , dan protein G berlabel His dijangkarkan melalui kompleksasi Ni-NTA dan label His. Lebih jauh, molekul antibodi (anti-CD9) dimasukkan melalui kompleksasi antara protein G dan domain Fc antibodi. Protein G dan antibodi yang diperkenalkan diberi label fluoresensi dengan AlexaFluor647 NHS, yang dapat bereaksi dengan gugus amino yang berasal dari residu asam amino protein yang mengandung protein G dan antibodi. Film polimer diperiksa melalui mikroskop fluoresensi menggunakan dua filter (GFP: λ Ex , 440–470 nm; λ Em , 525–550 nm; Cy5: λ Ex , 620–660 nm; λ Em , 700–775 nm), mengungkapkan bahwa titik terang fluoresensi yang sesuai dengan AlexaFluor488 (hijau) dan AlexaFluor647 (merah) hampir tumpang tindih. Hasil ini menunjukkan bahwa pewarna fluoresensi AlexaFluor488 dan protein terlokalisasi bersama dalam nanocavity polimer ( Gambar 4 ). Khususnya, protein G tidak memiliki cukup gugus amino pada permukaannya untuk konjugasi dengan AlexaFluor647 NHS (Gambar S3 , Informasi Pendukung); Oleh karena itu, fluoresensi yang diperoleh dari AlexaFluor647 menunjukkan keberadaan antibodi. Lebih jauh, intensitas fluoresensi substrat meningkat seiring dengan proporsi pewarna fluoresen (Gambar S4 , Informasi Pendukung). Hal ini menunjukkan bahwa proporsi molekul fungsional dalam rongga nano polimer dapat dikontrol dengan mengubah proporsi senyawa reaktif tiol pada langkah modifikasi pertama rongga nano polimer. Kami menyimpulkan bahwa pendekatan yang diusulkan dapat menghasilkan beberapa rongga nano polimer yang terintegrasi dengan molekul fungsional.
 Gambar 4
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Gambar fluoresensi rongga nano polimer yang terintegrasi dengan molekul multifungsi. a) AlexaFluor488 dimasukkan ke dalam rongga nano melalui kimia tiol–maleimida; b) AlexaFluor647 dikonjugasikan dengan antibodi anti-CD9 yang dimasukkan ke dalam rongga melalui pengenalan berurutan Ni 2+ -NTA dan protein G berlabel His; c) gambar gabungan a) dan b).
Rongga nano polimer terintegrasi molekul multifungsi yang disiapkan digunakan sebagai permukaan penginderaan EV. AlexaFluor488 sebagai komponen pensinyalan fluoresensi dan antibodi anti-CD9 untuk menangkap EV dimasukkan ke dalam rongga nano polimer. Kemampuan pensinyalan fluoresensi terhadap EV yang disekresikan dari sel kanker prostat (PC-3) diselidiki, dan ditemukan bahwa sinyal fluoresensi berubah dengan penambahan EV. Dengan demikian, rongga nano polimer terintegrasi molekul fungsional ganda yang disiapkan dapat menangkap EV dan mengubah peristiwa pengikatan ini menjadi perubahan fluoresensi ( Gambar 5 ). Sebaliknya, respons fluoresensi rongga nano polimer tanpa antibodi dan yang dengan antibodi isotipe IgG2b, yang tidak berinteraksi dengan EV, hampir tidak menunjukkan respons fluoresensi. Antibodi yang dimasukkan ke dalam rongga nano polimer penting untuk penangkapan EV, karena EV apa pun dapat dideteksi dengan menukar antibodi dengan antigen yang diekspresikan pada EV target. Batas deteksi dihitung menjadi 0,1 fM menggunakan metode 3SD/ m ( m = kemiringan bagian linear dari isoterm pengikatan, SD = deviasi standar untuk nilai 0,01 fM EV), yang menyiratkan bahwa 60 EV µL −1 dapat dideteksi pada kondisi yang digunakan. Sensitivitas ini lebih tinggi dari atau sebanding dengan yang dilaporkan sebelumnya, yang diperoleh melalui fluoresensi, plasmonik, elektrokimia, dan spektroskopi Raman. [ 16 , 17 ] Sensitivitas yang lebih tinggi untuk mendeteksi EV telah dilaporkan baru-baru ini; namun, sistem penginderaan ini memerlukan perangkat pengukuran khusus dan/atau prosedur multi-langkah untuk mendeteksi EV. [ 18 ] Afinitas tinggi dalam sistem yang diusulkan ini dicapai dengan menggunakan nanocavity polimer di mana banyak antibodi untuk penangkapan EV terintegrasi. Meskipun mekanisme di mana AlexaFluor488 mengikat EV dan mengubah fluoresensi tidak jelas, sebagian besar pewarna fluoresensi memiliki sifat fluoresensi yang bergantung pada lingkungan; [ 19 ] Oleh karena itu, ada kemungkinan bahwa perubahan fluoresensi disebabkan oleh perubahan lingkungan di sekitar pewarna fluoresensi saat berada di dekat lipid dan/atau protein pada EV.
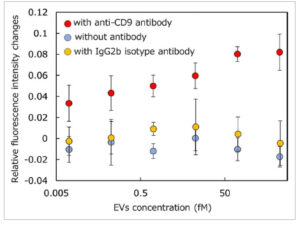 Gambar 5
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Respon fluoresensi rongga nano polimer terintegrasi molekul fungsional yang disiapkan terhadap PC-3 EV (0–100 fM); rongga nano polimer pensinyalan fluoresensi dengan antibodi anti-CD9 (merah), tanpa antibodi (biru), dan dengan antibodi isotipe IgG2b (kuning). Mikroskop fluoresensi dengan filter GFP (λ Ex : 440–470 nm dan λ Em : 525–550 nm) digunakan (n = 3).
3 Kesimpulan
Rongga nano polimer multifungsi yang terintegrasi dengan molekul disiapkan melalui metode DM menggunakan FP yang dapat dipolimerisasi sebagai pengubah templat dan pengangkut gugus fungsi. FP yang dirancang dapat mengikat erat NP silika templat karena berbagai interaksi, dan kompleks FP–NP silika terdispersi secara monodispersi dalam media berair. Gugus fungsi selektif rongga dan integrasi molekul multifungsi dalam rongga nano polimer tercapai, sebagaimana dikonfirmasi oleh mikroskopi fluoresensi sekuensial. Rongga nano polimer pensinyalan fluoresensi untuk deteksi EV disiapkan melalui metode DM menggunakan FP, dan respons yang bergantung pada antibodi diamati, yang menunjukkan bahwa platform ini dapat digunakan untuk menganalisis EV dengan menukar antibodi yang dimasukkan ke dalam rongga. Lebih jauh, gugus fungsi yang dimasukkan ke dalam rongga dapat dipilih secara bebas dengan memilih monomer yang mengandung gugus fungsi apa pun untuk sintesis FP. Dengan demikian, pendekatan yang diusulkan berpotensi untuk persiapan berbagai antarmuka terintegrasi molekul fungsional. Pendekatan mudah untuk pengiriman gugus fungsi dalam area berukuran nano ini merupakan strategi ampuh untuk membuat antarmuka nano terintegrasi molekul multifungsi untuk menganalisis EV, virus, bakteri, sel, dan protein di bidang ilmu hayati dan berguna untuk diagnosis, terapi, analisis makanan, dan analisis lingkungan.
4 Bagian Eksperimen
Bahan
Imunoglobulin G (IgG) manusia, N- (3-Dimetilaminopropil)metakrilamida (DMAPMA), asam 11-merkaptoundekanoat (MUA), N- hidroksisuksimida (NHS), etanolamin, Tris(2-piridilmetil)amina (TPMA) dan natrium dodesil sulfat, diperoleh dari Sigma–Aldrich (MO, AS). L-sistein, etilendiamin tetra-asetat, N -isopropil akrilamida (NIPAm), L(+)-Asam Askorbat, tembaga(II) bromida, Nikel (II) Klorida, Anhidrat dan metanol (MeOH) diperoleh dari Nacalai Tesque Co. (Kyoto, Jepang). Asam asetat (AcOH), etanol (EtOH), N,N- Dimetilformamida (DMF), dimetil sulfoksida (DMSO), dietil eter, diklorometana (CH 2 Cl 2 ), 2-siano-2-[(dodecylsulfanylthiocarbonyl)sulfanyl]propana, Trietilamina (TEA), Natrium klorida (NaCl), natrium dihidrogenfosfat (NaH 2 PO 4 ), dinatrium hidrogenfosfat (Na 2 HPO 4 ) dan 2,2′-azobis(isobutyronitril) (AIBN) diperoleh dari Wako Pure Chemical Industries, Ltd. (Osaka, Jepang). 2-Methacryloyloxyethylphosphorylcholine (MPC) dibeli dari NOF Corporation (Tokyo, Jepang). 1-(3-Dimetilaminopropil)-3-etilkarbodiimida hidroklorida (EDC), N -suksimidil metakrilat, dan tris(2-karboksietil)fosfina hidroklorida (TCEP) dibeli dari Tokyo Chemical Industries (Tokyo, Jepang). 2-(2-Bromoisobutyryloxy) undecyl tiol dibeli dari Surf Mods Ltd. (Tokyo, Jepang). Maleimida AlexaFluor 647 C2, asam karboksilat AlexaFluor 647, ester suksinimidil, dan maleimida AlexaFluor 488 C5 dibeli dari Thermo Fisher Scientific Inc. (Waltham, AS). Maleimida-C3-NTA dibeli dari Laboratorium Dojindo (Kumamoto, Jepang). Protein G berlabel His rekombinan dibeli dari abcam plc. (Cambridge, Inggris). Antibodi Anti-CD9 (manusia) dibeli dari MBL life science Inc. (Nagoya, Jepang). Kontrol isotipe IgG2b, tikus, tidak berlabel dibeli dari CosmoBio. Vesikel ekstraseluler (EV) yang disekresikan dari sel PC-3 (12 × 10 11 partikel/mL) dibeli dari HansaBioMed Life Sciences Ltd (Tallinn, Estonia). NP silika yang dimodifikasi oleh gugus asam karboksilat (Sicastar Ⓡ -greenF, berlabel fluoresensi hijau: λ Ex = 485 nm/λ Em = 510 nm, 50 mg mL −1 larutan berair) dibeli dari micromod Partikeltechnologie GmbH (Rostock, Jerman). N -Methacryloyl- N’ -( t -butyloxycarbonyl)cystamine (Boc-Cys-MA) disiapkan mengikuti prosedur yang dilaporkan sebelumnya. [ 20 , 21 ] Air murni disiapkan oleh sistem PURELAB Pharma Compliance (ELGA LabWater, High Wycombe, Inggris).
Persiapan FP
Proses sintesis ditunjukkan dalam Skema 1. NIPAm (68 mg, 0,6 mmol), DMAPMA (34 mg, 0,2 mmol), Boc-Cys-MA (64 mg, 0,2 mmol), 2-siano-2-[(dodecylsulfanylthiocarbonyl)sulfanyl]propana (agen RAFT; 0,86 mg, 2,5 µmol), dan AIBN (0,2 mg, 1,3 µmol) dilarutkan dalam DMF (2 mL) sebagai larutan prapolimerisasi. Larutan ditempatkan dalam labu Schlenk, dan oksigen sisa didegaskan menggunakan metode beku-pompa-cair. Polimerisasi dilakukan pada suhu 75 °C selama 24 jam dengan pengadukan pada kecepatan 100 rpm. Setelah itu, campuran reaksi dituangkan ke dalam dietil eter untuk mengendapkan polimer. Endapan dicuci tiga kali dengan dietil eter dan dikeringkan dalam vakum , menghasilkan polimer P1 sebagai padatan kuning muda (68 mg). Untuk mendeproteksi gugus Boc pada P1 , polimer P1 (68 mg) dilarutkan dalam CH2Cl2 ( 4 mL ), dan 4 N HCl dalam dioksana (0,5 mL) ditambahkan. Campuran reaksi kemudian diaduk selama 24 jam. Selanjutnya, dietil eter berlebih ditambahkan ke endapan. Endapan dicuci tiga kali dengan dietil eter dan dikeringkan dalam vakum , menghasilkan polimer P2 sebagai padatan putih (65 mg). P2 (65 mg), TEA (45 µL), dan N -succinimidyl methacrylate (30 mg) dilarutkan dalam CH2Cl2 ( 4 mL) dan diaduk pada suhu kamar selama 24 jam. Setelah reaksi, dietil eter berlebih ditambahkan ke campuran, dan endapan dikumpulkan. Endapan dicuci dengan dietil eter dan dikeringkan dalam vakum , menghasilkan FP sebagai padatan putih (41 mg). Polimer yang disintesis diidentifikasi dengan pengukuran 1H -NMR (Bruker AVANCE II, 500 MHz) menggunakan DMSO- d6 sebagai pelarut.
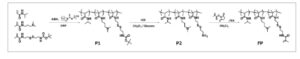 Skema 1
Skema 1
Buka di penampil gambar
Presentasi PowerPoint
Persiapan FP.
FP berlabel Rhodamine B (FP-RB, 70 mg) disiapkan seperti dijelaskan di atas, kecuali penambahan methacryloxyethyl thiocarbamoyl rhodamine B (3,2 mg, 5,0 µmol).
Massa molar FP diperkirakan melalui GPC menggunakan pompa HPLC Chromaster 5110 (Hitachi, Ltd., Tokyo, Jepang) yang dilengkapi dengan detektor RI Chromaster 5450 (Hitachi, Ltd., Tokyo, Jepang). Kolom Shodex GPC LF-804 (Showa Denko KK, Tokyo, Jepang) digunakan, dan polimer dikarakterisasi dengan standar poli(etilen oksida) dalam eluen (10 mmol/L LiBr yang dilarutkan dalam DMF) pada 1 mL min −1 . Kolom LC dipertahankan pada suhu 40 °C dengan menggunakan oven CTO-20A (Shimadzu Corporation, Kyoto, Jepang).
Pengukuran DLS
Larutan berair polimer FP (2 mg mL −1 , 100 µL) dicampur dengan larutan berair NP silika (2,0 × 10 11 partikel/mL, 100 µL) menggunakan mixer vortex. Campuran diencerkan 500 kali lipat dengan air murni, dan diameter serta potensi Z kompleks FP–silika diukur menggunakan Zetasizer Ultra (Malvern Panalytical, Malvern, Inggris).
Sifat Pengikat Silika FP
Berbagai konsentrasi larutan berair FP atau DMAPMA (0–2,0 mg mL −1 ) diinkubasi dengan silika NP (1 mg mL −1 ) selama 1 jam menggunakan thermo-shaker (1000 rpm, 25 °C). Setelah inkubasi, sentrifugasi (Suprema21, Tomy Seiko Co., Ltd., Tokyo, Jepang) dilakukan (5000 rpm, 10 menit, 25 °C). Spektrum fluoresensi (NanoDrop 3300, Thermo Fisher Scientific KK, Jepang) dari supernatan direkam, dan jumlah polimer yang terikat dengan permukaan silika NP diperkirakan.
Persiapan Film Polimer dengan Nanocavities melalui Polimerisasi Template
Substrat kaca berlapis Au (4,3 × 9,8 mm, ketebalan Au 165 nm, ketebalan Ti 5 nm) dicuci dengan air murni dan EtOH, diikuti dengan perlakuan UV–ozon selama 20 menit. Untuk modifikasi permukaan melalui interaksi thiol–Au berdasarkan pembentukan lapisan tunggal rakitan sendiri (SAM), substrat yang dibersihkan direndam dalam larutan etanol yang mengandung MUA (0,5 mm ) dan 2-(2-bromoisobutyryloxy) undecyl thiol (0,5 mm ) selama 24 jam pada suhu 30 °C. Setelah inkubasi, substrat dicuci dengan etanol. Larutan berair silika NP (19 µL, 2,0 × 10 11 partikel/mL) dan larutan berair FP 2,0 mg mL −1 (19 µL) dicampur dan diencerkan 40, 80, dan 400 kali lipat dengan DMF. Larutan encer (4 µL) diteteskan ke substrat yang dimodifikasi SAM campuran, diikuti dengan inkubasi pada suhu kamar selama 1 jam. Kemudian, substrat dicuci dengan EtOH.
MPC (500 mm ) , TPMA (1,0 mm ) , CuBr2 ( 1 mm ) , dan asam askorbat (0,5 mm ) dilarutkan dalam EtOH (1500 µL) sebagai larutan prapolimerisasi, dan campuran tersebut ditempatkan ke dalam labu Schlenk. Larutan tersebut didegaskan dengan oksigen residual menggunakan metode beku-pompa-cair. Larutan (270 µL) ditempatkan ke dalam tabung PCR yang berisi substrat NP-silika yang diimobilisasi, yang diatur dalam thermo-shaker (500 rpm, 25 °C). Polimerisasi dilakukan dalam glovebox yang diisi dengan Ar. Setelah 20 jam polimerisasi, substrat dilepaskan dan dicuci dengan EtOH dan air murni. Untuk menghilangkan NP silika templat, substrat yang terbentuk dari film polimer direndam dalam MeOH/AcOH (1/1, v/v) dan disonikasi selama 1,5 menit. Ketebalan lapisan film poliMPC yang diperoleh diukur menggunakan elipsometri (FS-1, Meiwaforsis Co., Ltd., Tokyo, Jepang). Morfologi permukaan substrat yang diimobilisasi dengan nanopartikel silika yang dimodifikasi FP setelah polimerisasi diukur melalui SEM (JCM-7000, JEOL Ltd., Tokyo, Jepang).
Pasca Modifikasi Nanocavitas Polimer
Substrat yang dibentuk dari film polimer direndam dalam larutan berair TCEP 0,5 mm ( 1,0 mL) dan diinkubasi dalam pengocok termal (250 rpm, 25 °C, 10 menit) untuk mengurangi ikatan disulfida. Setelah inkubasi, substrat dicuci dengan air murni, menghasilkan rongga nano polimer yang terpapar gugus tiol.
i) Konjugasi molekul fluoresensi: Molekul fluoresensi AlexaFluor 647 C2-maleimide dan senyawa non-fluoresensi maleimide-C3-NTA bereaksi dengan gugus tiol yang terekspos dalam rongga nano. Berbagai rasio maleimide AlexaFluor 647 C2 terhadap maleimide-C3-NTA digunakan untuk fungsionalisasi rongga nano: 25 µ m /75 µ m , 50 µ m /50 µ m , dan 75 µ m /25 µ m . Campuran (30 µL) maleimide AlexaFluor 647 C2 dan maleimide-C3-NTA yang dilarutkan dalam 10 mm fosfat -buffered saline (PBS) yang mengandung 20% DMSO dan 140 mm NaCl diteteskan ke substrat dan diinkubasi pada suhu kamar selama 1 jam. Setelah itu, substrat dicuci dengan air murni.
ii) Pengenalan beberapa pewarna fluoresensi: Larutan campuran (30 µL) AlexaFluor 488 C5 maleimide (50 µ m ) dan maleimide-C3-NTA (50 µ m ) yang dilarutkan dalam PBS yang mengandung 20% DMSO diteteskan ke substrat dan diinkubasi pada suhu kamar selama 1 jam. Substrat kemudian dicuci dengan air. Berikutnya, larutan berair NiCl2 4 mm ( 30 µL ) diteteskan pada substrat dan diinkubasi selama 15 menit. Setelah substrat dicuci dengan air murni, larutan PBS protein G berlabel His 10 µ m (30 µL) ditambahkan dan diinkubasi pada suhu kamar selama 1 jam. Setelah dicuci dengan PBS, antibodi anti-CD9 0,5 µ m yang dilarutkan dalam PBS (20 µL) diteteskan ke substrat dan diinkubasi selama 1 jam. Kemudian, substrat dicuci dengan PBS, dan 100 µ m AlexaFluor 647 NHS yang dilarutkan dalam 100 m m NaHCO3 aq . (pH 8,0, 30 µL) diteteskan ke substrat dan diinkubasi selama 1 jam, diikuti dengan pencucian dengan PBS. Sebagai referensi, substrat pewarnaan fluoresensi disiapkan seperti yang dijelaskan di atas, kecuali untuk pengenalan antibodi anti-CD9.
Pengukuran Fluoresensi
Pengukuran fluoresensi substrat berlapis film polimer dilakukan menggunakan mikroskop fluoresensi (BZ-X800, Keyence, Osaka, Jepang) yang dilengkapi dengan lensa objektif (60×), filter GFP (OP-87793, λ Ex : 440/70, λ Em : 525/50, DM: 495), dan filter Cy5 (OP-87766, λ Ex : 620/60, λ Em : 700/75, DM: 660).
Intensitas fluoresensi substrat diukur menggunakan mikroskop fluoresensi (BX3-URA, Olympus) yang dilengkapi dengan robot penanganan cairan otomatis yang dikendalikan komputer (System Instruments. Co., Ltd., Tokyo, Jepang). [ 22 – 24 ] Pengaturan mikroskop fluoresensi adalah sebagai berikut: perbesaran lensa objektif adalah 5× (LMPLFLN5X, Olympus, Tokyo, Jepang), waktu pencahayaan adalah 0,5 detik, sumber cahaya adalah lampu merkuri (HGLGPS-SET, Olympus, Tokyo, Jepang), dan filter bandpass (BWA, Olympus, Tokyo, Jepang) adalah 460–495 nm untuk eksitasi dan 510–550 nm untuk emisi. Dalam urutan penanganan cairan otomatis, 1) substrat diatur ke dalam chip pipet tipe datar, yang ditempatkan di rak ujung; 2) ujung pipet ditangkap oleh lengan robot dari rak ujung, dan larutan sampel disedot ke dalam ujung pipet (100 µL); 3) ujung pipet dipindahkan ke port inkubasi pada suhu 25 °C dan dibiarkan di sana selama 1 menit; dan 4) lengan robot dipindahkan ke port deteksi untuk memperoleh gambar fluoresensi menggunakan kamera Zyla 5.5 sCMOS (Andor Technology Ltd., Belfast, Inggris) yang dilengkapi dengan menara fluoresensi (BX3-URA, Olympus, Tokyo, Jepang).
Antibodi dan Nanocavity Pewarna Reporter Fluoresens untuk Penginderaan EV
Dispersi NP silika (1,0 × 10 11 partikel/mL) yang mengandung 1,0 mg mL −1 polimer FP diencerkan 40 kali lipat dengan DMF. Larutan yang diencerkan (0,1 µL) diteteskan ke substrat SAM yang dimodifikasi campuran di dua titik dan diinkubasi selama 1 jam. Substrat kemudian dicuci dengan etanol. Film polimer berbasis MPC disiapkan seperti yang dijelaskan di atas. Setelah polimerisasi, NP silika cetakan dihilangkan melalui sonikasi dalam MeOH/AcOH (1/1, v/v) selama 1,5 menit. Untuk mengurangi ikatan disulfida, substrat direndam dalam TCEP berair 0,5 mm selama 10 menit dan dicuci dengan air murni. Pada langkah pasca-modifikasi, 30 µL larutan PBS yang mengandung 50 µ m AlexaFluor488 C5 maleimide dan 50 µM maleimide-C3-NTA diteteskan ke substrat dan diinkubasi pada suhu ruangan selama 1 jam. Kemudian, 4 mM NiCl 2 aq. (30 µL) ditambahkan (15 menit), diikuti dengan penambahan larutan PBS protein G berlabel His 10 µ m (30 µL, 1 jam). Setelah dicuci dengan PBS, 0,5 µ m antibodi (antibodi anti-CD9 atau antibodi Kontrol Isotipe IgG2b) dalam PBS (20 µL) diteteskan ke substrat dan diinkubasi selama 1 jam, menghasilkan pewarna fluoresen dan rongga nano polimer yang terintegrasi dengan antibodi.
Kemampuan pensinyalan fluoresensi dari chip yang disiapkan dievaluasi menggunakan mikroskop fluoresensi yang dilengkapi dengan robot penanganan cairan otomatis yang disebutkan sebelumnya (Gambar S5 , Informasi Pendukung). EV yang mengandung PBS yang disekresikan dari sel PC-3 (0, 0,01, 0,1, 1, 10, 100, atau 1000 fM) digunakan sebagai larutan sampel. Percobaan dilakukan dalam duplikat, dan empat daerah minat yang berbeda dipilih dari setiap chip, di mana dua titik dipilih dari area yang dimasukkan pewarna fluoresensi dan yang lainnya dari area polyMPC. Intensitas fluoresensi relatif dalam percobaan pengikatan dihitung menggunakan persamaan (F − F 0 )/(F 0 − F MPC ), di mana F dan F 0 menunjukkan intensitas fluoresensi area yang dimasukkan pewarna fluoresensi sebelum dan setelah inkubasi, dan F MPC menunjukkan intensitas fluoresensi area polyMPC.





Tinggalkan Balasan