BSTRAK
Imunoblot, yang juga dikenal sebagai western blot, merupakan prosedur yang sudah mapan dalam ilmu hayati. Prosedur ini umumnya digunakan untuk menentukan ukuran relatif dan kelimpahan protein tertentu, serta modifikasi protein pascatranslasi. Meskipun metode ini banyak digunakan karena kesederhanaannya, prosesnya dapat memakan waktu berjam-jam atau bahkan berhari-hari. Meskipun ada upaya besar untuk mengurangi waktu prosedur secara keseluruhan, khususnya untuk inkubasi antibodi, langkah-langkah yang melibatkan pembilasan membran tetap tidak berubah sejak pengembangan teknik imunoblot. Dalam konteks ini, kami memperkenalkan perangkat inovatif yang disebut “Smart Wash,” yang dirancang untuk mengurangi interval pencucian secara signifikan dengan memanfaatkan pemutar salad bermotor. Prinsip Smart Wash mirip dengan mesin cuci rumah tangga: wadah menampung membran selama siklus pembilasan, dan keranjang menggerakkan membran bersama dengan larutan pencuci dalam wadah. Kami telah mengoptimalkan kondisi pembilasan, termasuk volume larutan pencuci, kecepatan putaran, jumlah siklus pencucian, dan arah. Perangkat sederhana ini memberdayakan para peneliti untuk secara signifikan meningkatkan efisiensi dan produktivitas analisis imunoblotting.
Singkatan
AP
alkali fosfatase
Bahasa Indonesia: CDR
pengurasan dan pengisian ulang siklus
CGS-1
Bisa Mendapatkan Solusi Imunoenhancer Signal-1
CGS-2
Bisa Mendapatkan Solusi Imunoenhancer Signal-2
PBS-T
buffer fosfat salin yang mengandung 0,1% Tween20
1 Pendahuluan
Imunoblot, juga dikenal sebagai western blot, sangat penting dalam berbagai penelitian ilmiah dan klinis. Teknik ini menilai kelimpahan dan ukuran relatif protein dan modifikasi pascatranslasinya [ 1 – 6 ]. Imunoblot melibatkan serangkaian inkubasi dengan reagen imunokimia yang berbeda, diselingi dengan langkah-langkah pembilasan membran. Sementara setiap langkah sangat penting untuk identifikasi dan kuantifikasi protein yang diinginkan secara akurat, pembilasan sangat penting untuk menghilangkan reagen yang tidak terikat dan meminimalkan latar belakang, sehingga meningkatkan rasio signal-to-noise (S/N). Pembilasan yang tidak memadai dapat menyebabkan latar belakang yang tinggi, sehingga menghasilkan rasio S/N yang lebih rendah. Meskipun imunoblot menghasilkan wawasan berharga dalam penelitian akademis, diagnostik, dan pengujian terapeutik, ini adalah proses yang padat karya dan memakan waktu. Setiap iterasi dapat memakan waktu berjam-jam atau bahkan berhari-hari untuk diselesaikan, membuat pengujian ini lebih memakan waktu daripada teknik canggih lainnya. Untuk mengatasi keterbatasan ini, prosedur telah berkembang, dengan inovasi selanjutnya meningkatkan sensitivitas, kecepatan, dan kuantifikasi [ 7 – 14 ]. Instrumen baru seperti Bandmate Automated Western Blot Processor, SNAP id 2.0 Protein Detection System, dan iBind Automated Western Systems juga telah diperkenalkan. Meskipun banyak laporan merinci metode yang ditingkatkan untuk inkubasi membran dengan berbagai probe selama immunoblot, kemajuan signifikan dalam langkah-langkah pembilasan membran masih langka. Pendekatan umum melibatkan menempatkan membran dalam wadah dengan cukup PBS-Tween 20 untuk merendamnya sepenuhnya dan mengaduknya (biasanya selama 10 menit, diulang tiga kali). Proses ini memakan waktu setidaknya 30 menit setelah inkubasi antibodi primer dan sekunder. Dalam laporan kami sebelumnya [ 15 , 16 ], kami menggunakan pemutar salad komersial untuk mempercepat pembilasan membran dalam waktu singkat (∼5 menit), tetapi kondisinya tidak sepenuhnya dioptimalkan. Selain itu, kami mengamati kualitas gambar yang bervariasi saat menggunakan pemutar salad manual, tergantung pada kecepatan putaran dan operator yang melakukan percobaan. Dalam penelitian ini, kami memperkenalkan pemutar salad bermotor yang diberi nama “Smart Wash” dan mengoptimalkan kondisi pembilasan. Smart Wash tidak hanya mempercepat proses pembilasan (sekitar 3 menit setelah inkubasi antibodi, bukan 30 menit), tetapi juga menghasilkan hasil yang konsisten dan meminimalkan kesalahan operator.
2 Bahan dan Metode
2.1 Perakitan Perangkat “Smart Wash”
Kami mengembangkan sistem untuk menggerakkan dan mengendalikan OXO Salad Spinner (dimensi wadah: 26,6 × 26,6 × 15,2 cm, SKU: 32480V2B). Keranjang diputar oleh rakitan motor roda gigi bertenaga baterai (Walfront, 25GA-370 DC 12 V Micro Gear Box Motor) baik searah jarum jam maupun berlawanan arah jarum jam pada kecepatan maksimum 350 rpm tanpa solusi apa pun (Gambar 1A,B ). Perangkat lunak kontrol dirancang untuk menyediakan kontrol perangkat keras yang diperlukan dan antarmuka pengguna dengan beberapa layar yang menyampaikan informasi status. Hal ini memungkinkan protokol untuk diedit, disimpan, dan diambil.
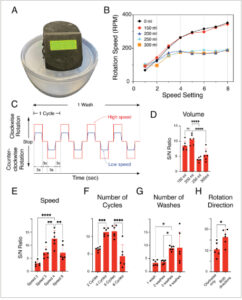 GAMBAR 1
GAMBAR 1
Buka di penampil gambar
Presentasi PowerPoint
(A) Foto perangkat Smart Wash. (B) Kecepatan putaran keranjang dengan dan tanpa PBS-T. Kehadiran lebih dari 200 mL PBS-T mengurangi kecepatan. (C) Diagram skema langkah-langkah Smart Wash. (D–H) Efek berbagai kondisi pembilasan pada rasio S/N. Kondisi standar adalah 200 mL PBS-T, pengaturan kecepatan #4, empat siklus per pencucian, tiga pencucian, dan rotasi searah jarum jam dan berlawanan arah jarum jam. (D) Volume PBS-T yang berbeda. (E) Pengaturan kecepatan yang berbeda. (F) Jumlah siklus yang berbeda per pencucian. (G) Jumlah pencucian yang berbeda. (H) Arah putaran. Gambar sumber dan pengukuran fluoresensi ditunjukkan pada Gambar S1 dan S2 . **** p < 0,0001, *** p < 0,001, ** p < 0,005, * p < 0,05.
2.2 Antigen dan Antibodi
Media terkondisikan yang mengandung alkaline phosphatase (His) 6 yang disekresikan (AP-His, GenHunter) dari sel HEK-293 yang ditransfeksi digunakan untuk penelitian ini [ 16 ]. pEGFP juga ditransfeksi ke dalam sel HEK-293. Lisat sel HEK-293 yang disiapkan dengan buffer RIPA (Thermo Fisher Scientific) dengan adanya koktail penghambat protease (Calbiochem) juga digunakan [ 16 ]. Antibodi yang digunakan dalam penelitian ini, termasuk informasi pengenceran, tercantum dalam Tabel Pendukung .
2.3 SDS-PAGE, Transfer Elektroforesis, Slot Blot, Inkubasi Antibodi dengan Membran, dan Akuisisi Gambar
Prosedur ini dilakukan seperti yang dijelaskan sebelumnya [ 15 , 16 ]. Kecuali dinyatakan lain, membran PVDF digunakan dalam penelitian ini. Membran untuk slot blot disiapkan dengan Hoefer PR648 dan membawa AP-His yang disekresikan dan media kultur kontrol yang mengandung 10% Fetal Bovine Serum (120 µL/slot, masing-masing 6 slot, Gambar S1A ). Untuk inkubasi antibodi, 10% reagen Can Get Signal-1 dan -2 (TOYOBO) digunakan untuk antibodi primer dan sekunder, masing-masing, menggunakan metode cyclic draining, and filling (CDR) [ 15 , 16 ]. (Informasi terperinci tersedia di Tabel Pendukung . Antibodi terikat divisualisasikan untuk deteksi fluoresensi dan kemiluminesensi menggunakan Sistem Pencitraan Azure c600 (Azure Biosystems). Untuk deteksi kemiluminesensi, Kit Substrat Kemiluminesensi Peroksidase LumiGLO (SeraCare) digunakan.)
2.4 Pencucian Membran
2.4.1 Pencucian Konvensional
Setelah inkubasi antibodi, membran dibilas secara menyeluruh dengan air deionisasi untuk menghilangkan sebagian besar antibodi yang tidak terikat hingga gelembung yang berhubungan dengan deterjen menghilang (Film S1 ). Selanjutnya, membran dibilas dengan PBS-T (50 mL) dalam wadah (12,5 × 10 cm) dengan pengadukan selama 10 menit, tiga kali setelah inkubasi antibodi primer, dan selama 5 menit, enam kali setelah inkubasi antibodi sekunder. Total volume PBS-T yang dibutuhkan untuk satu membran adalah 450 mL.
2.4.2 Pencucian Cerdas
Membran dibilas secara menyeluruh dengan air deionisasi seperti dijelaskan di atas (Film S1 ), diikuti dengan pembilasan cepat namun menyeluruh di bawah keranjang menggunakan sistem Smart Wash kami dengan PBS-T dalam berbagai kondisi (Film S2 dan S3 ). Satu pembilasan terdiri dari beberapa pencucian dalam sistem Smart Wash. Gambar 1C mengilustrasikan pengoperasian unit secara terperinci. Prosedur terperinci untuk Smart Wash disediakan dalam Informasi Pendukung .
2.5 Pengukuran Kuantitatif
Gambar TIF 16-bit mentah berurutan yang diperoleh dari slot blot dianalisis oleh Image Studio Lite (Ver. 5.2.5, LI-COR Biosciences). Untuk mencegah sinyal jenuh, kami memetakan rata-rata dan deviasi standar unit relatif (RU) yang diperoleh dari masing-masing dari enam sampel. Semua analisis statistik dilakukan di GraphPad Prism (Ver. 10.3.1, GraphPad Software).
3 Hasil dan Pembahasan
Tahap pembilasan sangat penting untuk menghilangkan reagen tak terikat yang dapat mengganggu deteksi molekul target dan membantu mengurangi sinyal latar belakang. Meningkatkan rasio S/N dapat meningkatkan sensitivitas pengujian. Variabilitas dalam kondisi pembilasan seperti durasi pembilasan dan penggunaan volume dapat menjadi penyebab ketidakkonsistenan hasil yang diamati dengan protokol blotting lainnya. Dengan demikian, mengoptimalkan tahap pembilasan merupakan kunci keberhasilan imunoblot. Karena Smart Wash merupakan perangkat baru, kondisi pembilasan optimal yang diperlukan untuk meningkatkan rasio S/N harus ditentukan secara empiris.
Gambar 1C menunjukkan detail langkah-langkah Smart Wash: satu siklus terdiri dari (1) putaran searah jarum jam selama 5 detik, (2) jeda selama 3 detik, (3) putaran berlawanan arah jarum jam selama 5 detik, dan (4) jeda selama 3 detik. Kami menguji berbagai parameter, termasuk volume larutan pencuci per pencucian, kecepatan putaran, jumlah siklus, jumlah pencucian, dan arah putaran (arah sederhana atau kombinasi arah searah jarum jam dan berlawanan arah jarum jam). Untuk menilai faktor-faktor ini secara kuantitatif, kami menggunakan teknik slot blot menggunakan media terkondisi dengan deteksi fluoresensi, yang dipilih karena kemampuan kuantifikasi yang unggul, dan rentang dinamis yang lebar. Setelah menangkap gambar beberapa membran dalam kondisi pembilasan yang berbeda, kami mengukur kekuatan sinyal untuk AP-His dan media kontrol dan menghitung rasio S/N (Gambar 1D–H , Gambar S1 dan S2 ).
Awalnya, kami mengkarakterisasi kecepatan putaran keranjang dalam berbagai kondisi (Gambar 1B dan Gambar S1B ). Peningkatan hampir linear dalam kecepatan putaran keranjang diamati hingga pengaturan kecepatan #4 tanpa adanya PBS-T, dengan peningkatan yang berkurang melampaui pengaturan #4. Hasil serupa diperoleh saat 150 mL PBS-T digunakan, di mana bagian bawah keranjang sedikit menyentuh larutan, sehingga menghasilkan pembentukan gelembung minimal (Gambar S1B ). Sebaliknya, peningkatan volume PBS-T mengurangi output putaran, mencapai titik terendah pada 160 rpm melampaui pengaturan #3. Penurunan ini mungkin disebabkan oleh daya motor yang tidak cukup untuk mempertahankan putaran dengan adanya volume PBS-T yang lebih besar dan resistansi cairan, serta gelembung terkait deterjen yang dihasilkan selama putaran (Gambar S1B ). Pengaturan kecepatan yang lebih tinggi dan volume PBS-T yang lebih besar menghasilkan lebih banyak gelembung.
Prinsip utama pembilasan membran dalam prosedur imunoblotting adalah difusi pasif. Seseorang mungkin berasumsi bahwa menggunakan volume PBS-T yang lebih besar dalam perangkat Smart Wash akan meningkatkan rasio S/N. Namun, temuan kami menunjukkan bahwa volume yang lebih besar sebenarnya mengurangi rasio S/N (Gambar 1D ). Gambar S1C menunjukkan bahwa sementara sinyal pada slot AP-His lebih tinggi dengan 250 dan 300 mL PBS-T, slot kontrol menampilkan sinyal yang lebih tinggi dibandingkan dengan 150 dan 200 mL, yang menunjukkan pembilasan yang tidak memadai. Volume 150 atau 200 mL PBS-T memberikan pembilasan yang lebih efisien, sehingga menghasilkan rasio S/N yang lebih tinggi (Gambar 1D dan Gambar S1C ). Hal ini sebagian dapat dijelaskan oleh kecepatan rotasi yang berkurang dan peningkatan pembentukan gelembung dengan volume PBS-T yang lebih besar seperti dijelaskan di atas. Meskipun deterjen umumnya digunakan dalam imunoblot, gelembung yang berlebihan dapat berdampak buruk pada pembilasan membran yang efisien. Pengamatan ini sejalan dengan temuan kami bahwa pengaturan kecepatan #4 menghasilkan sinyal yang lebih rendah pada slot kontrol dibandingkan dengan pengaturan kecepatan yang lebih rendah (#2 dan #3), meningkatkan rasio S/N (Gambar 1E dan Gambar S1D ).
Bahasa Indonesia: Ketika gambar immunoblot menunjukkan sinyal latar belakang yang tinggi, biasanya waktu dan volume pembilasan ditingkatkan untuk mengurangi sinyal latar belakang, sering kali bersamaan dengan melakukan perubahan buffer tambahan. Namun, pembilasan yang terlalu agresif terkadang dapat mengurangi sinyal yang diinginkan. Kami mengamati efek tersebut (Gambar 1F ): delapan siklus per pencucian (Gambar S2A ) dan empat pencucian per pembilasan (Gambar S2B ) mengurangi sinyal pada slot AP-His. Sebaliknya, pembilasan yang tidak memadai meningkatkan sinyal pada slot kontrol, seperti yang terlihat pada dua siklus per pencucian (Gambar S2A ) dan satu atau dua pencucian per pembilasan (Gambar S2B ). Dengan demikian, pengoptimalan yang cermat sangat penting untuk deteksi yang sensitif. Rotasi searah jarum jam sederhana memberikan rasio S/N yang cukup tinggi dengan antibodi anti-His-tag tetapi menggabungkan rotasi searah jarum jam dan berlawanan arah jarum jam meningkatkan rasio S/N (Gambar 1H , Gambar S2C ). Untuk antibodi anti-AP, penggunaan kedua rotasi juga meningkatkan rasio S/N dengan mengurangi sinyal slot kontrol (Gambar S2C ). Singkatnya, kondisi Smart Wash yang optimal meliputi penggunaan 200 mL PBS-T, pengaturan kecepatan ke #4, melakukan empat siklus per pencucian, dan melakukan tiga pencucian per pembilasan dengan rotasi dua arah di setiap siklus. Proses ini memerlukan total 1,5 L PBS-T. Kondisi Smart Wash yang dioptimalkan ini menghasilkan hasil yang sebanding dengan metode konvensional baik dalam kekuatan sinyal maupun rasio S/N, seperti yang ditunjukkan menggunakan slot blot (Gambar 2A ). Protokol yang ditetapkan disajikan dalam Informasi Pendukung . Setiap pencucian memerlukan waktu 65 detik, dengan total sekitar 3 menit, yang secara signifikan mengurangi durasi pembilasan keseluruhan dibandingkan dengan 30 menit yang diperlukan oleh metode pencucian konvensional.
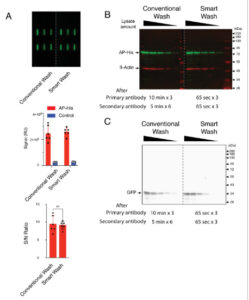 GAMBAR 2
GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
Perbandingan antara pencucian konvensional dan Smart Wash (kondisi standar). (A) Sinyal AP-His yang disekresikan dari slot individual diukur dan diplot, dan rasio S/N dihitung. (B dan C) Jumlah lisat sel yang berbeda (pengenceran serial 1:2 dimulai dari 6 µg/jalur; B: HEK293 yang ditransfeksi AP-His; C: HEK293 yang ditransfeksi GFP) dipisahkan dengan SDS-PAGE, diikuti dengan imunoblot. (B) Deteksi fluoresensi simultan dengan antibodi anti-β-aktin dan anti-His-tag. (C) Deteksi kemiluminesensi dengan antibodi anti-GFP.
Perangkat Smart Wash semi-otomatis dirancang untuk menstandardisasi dan menyederhanakan prosedur pembilasan dalam immunoblot. Untuk menggambarkan manfaat secara keseluruhan, kami menerapkan kondisi Smart Wash yang dioptimalkan pada membran PVDF yang dihasilkan dari SDS-PAGE (Gambar 2B,C ). Perbandingan antara pencucian konvensional dan Smart Wash menunjukkan hasil yang sebanding dalam deteksi fluoresensi dan chemiluminescent. Imunoblot fluoresensi memiliki keuntungan unik yang memungkinkan beberapa target untuk diuji pada blot yang sama secara bersamaan, tanpa perlu stripping, dan probe ulang. Smart Wash cukup efisien untuk deteksi simultan AP berlabel His dan β-aktin, tanpa perbedaan yang jelas dalam batas deteksi menggunakan pengenceran serial lisat sel (Gambar 2B ). Deteksi chemiluminescent dari GFP yang ditransfeksi dengan cepat dicapai menggunakan Smart Wash, menghasilkan hasil yang setara dengan yang diperoleh dengan pencucian konvensional (Gambar 2C ). Selain itu, Smart Wash diterapkan pada membran nitrocellulose (Gambar S3 ). Analisis slot blot mengungkapkan rasio S/N yang serupa antara Smart Wash dan pencucian konvensional. Deteksi simultan AP berlabel His dan β-aktin pada membran nitroselulosa menunjukkan hasil paralel antara dua metode pembilasan menggunakan pengenceran serial lisat sel (Gambar S3B ). Perlu dicatat bahwa wadah Smart Wash yang transparan memungkinkan pemantauan membran dengan mudah (Film S3 ), dan hingga empat membran (8 × 6,5 cm) dapat dibilas secara bersamaan tanpa perubahan drastis pada kualitas gambar. Tidak ada robekan membran yang diamati selama langkah pembilasan, yang menunjukkan operasi Smart Wash yang lembut. Penyetelan halus kondisi pembilasan dapat menghasilkan hasil yang konsisten dan kuantitatif, tergantung pada antibodi spesifik yang digunakan dalam penelitian. Kami berspekulasi bahwa salah satu alasan untuk pembilasan yang dipercepat menggunakan Smart Wash adalah peningkatan difusi pasif karena volume larutan yang lebih tinggi. Selain itu, pergerakan larutan meningkatkan efisiensinya, seperti yang ditunjukkan pada Gambar 1D,E , yang menghasilkan pembilasan membran yang cepat dan efisien.
4 Penutup
Secara tradisional, langkah pembilasan dalam imunoblot membutuhkan banyak tenaga kerja dan waktu. Untuk mengatasi tantangan ini, kami mengembangkan pemutar salad bermotor, Smart Wash, yang sama efektifnya dengan metode pencucian tradisional dan dapat diaplikasikan pada membran PVDF dan nitrocellulose untuk deteksi fluorescent dan chemiluminescent. Keunggulan Smart Wash meliputi (1) peningkatan kecepatan (sekitar 3 menit setelah inkubasi antibodi dengan Smart Wash, bukan 30 menit dengan pencucian konvensional), (2) portabilitas, (3) kontrol pembilasan yang presisi, (4) hemat biaya dibandingkan dengan instrumen otomatis komersial, dan (5) berkurangnya kesalahan operator karena kontrol yang presisi ini. Dirancang menggunakan pemutar salad komersial, rakitan motor tutup (unit kontrol) dapat digunakan dengan beberapa wadah, yang memungkinkan pembilasan membran secara serial. Menggabungkan metode CDR [ 15 , 16 ] dengan Smart Wash secara drastis mengurangi waktu keseluruhan untuk seluruh prosedur, yang memungkinkan jumlah imunoblot yang jauh lebih tinggi per hari saat membran yang diblokir tersedia. Dengan demikian, perangkat sederhana ini secara signifikan meningkatkan efisiensi dan produktivitas analisis imunoblotting.





Tinggalkan Balasan