Abstrak Grafis
Efek praperlakuan permukaan in situ elektrokimia dari kolektor arus tembaga, untuk baterai logam litium bebas anoda dengan elektrolit konsentrasi tinggi terlokalisasi berbasis sulfolana dieksplorasi. Prosedur praperlakuan potensial konstan dan arus konstan menguntungkan kinerja anoda. Efek yang diamati dikaitkan dengan pengaruh sinergis dari struktur anorganik-organik yang seimbang, sifat viskoelastis yang ditingkatkan, dan morfologi lapisan yang homogen pada skala mikro/nano.
Abstrak
Karya ini mengeksplorasi efek praperlakuan elektrokimia in situ dari kolektor arus tembaga (CuCC), yang bertindak sebagai anoda dalam baterai logam litium bebas anoda (AFLMB) dengan elektrolit konsentrasi tinggi terlokalisasi berbasis sulfolana. Dua metode praperlakuan elektrokimia, yang tidak melibatkan pengendapan kelebihan potensial litium menjadi fokus. Strategi ini diselidiki dalam hal pertumbuhan lapisan pasif, evolusi morfologi permukaan, komposisi antarmuka yang terbentuk, dan kinerja elektrokimia untuk AFLMB. Lapisan pasif yang terbentuk pada CuCC (antarfase elektrolit padat Cu [SEI]) dikarakterisasi in situ melalui keseimbangan mikro kristal kuarsa elektrokimia dengan pemantauan redaman, yang menunjukkan bahwa Cu–SEI menunjukkan sifat viskoelastis yang dapat dideteksi. Karakterisasi morfologi CuCC yang dimodifikasi menunjukkan struktur Cu–SEI yang sangat homogen dengan kekasaran permukaan yang rendah. Komposisi dan sifat fisik lapisan Cu–SEI berkorelasi dengan kinerja elektrokimia anoda. Efek positif yang diamati dari prosedur untuk preformasi SEI dikaitkan dengan pengaruh sinergis dari komposisi anorganik-organik yang seimbang, sifat viskoelastis yang ditingkatkan, dan morfologi lapisan yang homogen. Studi ini menunjukkan dampak positif dari praperlakuan yang dirancang dan memberikan perbandingan yang tepat antara pendekatan in situ yang diusulkan dan keadaan terkini.
1 Pendahuluan
Penyimpanan energi merupakan pendekatan penting untuk memanfaatkan potensi energi terbarukan yang tak terbatas. Didorong oleh kebutuhan teknologi penyimpanan yang efisien, pengembangan baterai isi ulang dapat secara efektif berkontribusi pada perlindungan lingkungan melalui pengurangan emisi gas rumah kaca, konservasi sumber daya alam, dan transisi cepat menuju mobilitas berkelanjutan. [ 1 , 2 ] Baik untuk aplikasi stasioner maupun bergerak, sistem baterai Li-ion (LIB) merupakan solusi penyimpanan yang berguna, yang telah menjadi topik penelitian yang sangat menarik perhatian. Dalam hal ini, salah satu konsep LIB yang paling maju, baterai logam litium bebas anoda (AFLMB), memiliki potensi untuk meningkatkan kepadatan energi secara signifikan karena menghilangkan kebutuhan akan anoda grafit konvensional dengan kapasitas terbatas atau aplikasi elektroda logam litium yang besar. [ 3 , 4 ] Namun, AFLMB saat ini menunjukkan masalah dengan efisiensi Coulombik (CE) dan stabilitas siklus, yang disebabkan oleh antarmuka anoda-elektrolit yang tidak stabil selama pelapisan dan pelepasan litium metalik, yang mendorong pertumbuhan litium dendritik dan peningkatan masalah keamanan yang ada. [ 3 ]
Ada beberapa strategi utama untuk pencegahan atau minimalisasi ketidakstabilan antarmuka litium dan pembentukan dendrit. Dengan melibatkan antarmuka padat-elektrolit (SEI) yang ditingkatkan atau antarmuka buatan, [ 5 – 7 ] kolektor arus berpori, [ 8 ] substrat yang sangat litofilik, [ 9 ] rekayasa pemisah khusus, [ 10 ] dll., pembentukan dan pertumbuhan dendrit litium dapat dihambat secara signifikan. Meskipun demikian, sebagian besar pendekatan ini melibatkan langkah-langkah teknologi tambahan, ex situ, yang menghasilkan upaya ekstra dan mempersulit pemanfaatan praktisnya. Faktor penting yang memainkan peran sentral dalam stabilisasi antarmuka litium-elektrolit adalah sifat elektrolit. Telah ditunjukkan bahwa pengembangan elektrolit tingkat lanjut merupakan rute yang menjanjikan untuk memodulasi pelapisan dan pelepasan litium guna mengurangi kemungkinan pembentukan dendrit dan pemudaran kapasitas yang sesuai. Namun, pengaruh sifat elektrolit pada stabilitas antarmuka logam alkali-elektrolit bersifat kompleks dan kurangnya pemahaman tentang mekanisme yang dengannya sistem elektrolit spesifik memengaruhi kinerja anoda AFLMB menghambat kemajuan jenis baterai ini. [ 11 ] Telah diamati bahwa SEI dan sifat-sifatnya memiliki dampak utama pada cara pertumbuhan litium. Dalam upaya untuk lebih memahami perkembangan profil konsentrasi dalam baterai logam-litium (LMB), Wasalathanthri et al. [ 12 ] secara teoritis menganalisis cara pertumbuhan litium dan menyimpulkan bahwa dalam LMB, penipisan elektrolit terjadi secara eksklusif di bagian utama SEI dan minimal di fase elektrolit cair. [ 12 ] Oleh karena itu, morfologi litium yang tumbuh dapat dikontrol dengan menyetel sifat-sifat SEI dan khususnya, transpor ionik yang dipercepat, konsentrasi Li + yang tinggi di SEI, dan peningkatan homogenitas struktural lapisan tersebut penting untuk mengurangi kemungkinan penipisan Li + yang kuat dan pembentukan dendrit yang cepat. [ 12 ] Dalam konteks ini, beberapa karya eksperimental telah menunjukkan bahwa SEI yang homogen dan stabil, kaya akan fase anorganik, baik untuk mempertahankan gradien konsentrasi litium rendah dan pelapisan berkelanjutan tanpa dendrit pada kerapatan arus tinggi. [ 7 ]Selain itu, untuk menjelaskan dampak SEI yang awalnya terbentuk pada kolektor arus tembaga (CuCC) sebelum dimulainya pelapisan litium, berbagai kelompok penelitian mempelajari perilaku elektrokimia CuCC yang dimodifikasi SEI dalam sejumlah elektrolit terbatas, termasuk 0,5 M litium bis(trifluorometilsulfonil)imida (LiTFSI)/1-butil-1-metilpirolidinium-bis(trifluorometilsulfonil)imida (Py 14 TFSI)–1-butil-1-metilpirolidinium bis(fluorosulfonil) imida (Py 14 FSI) (1:1, v/v), 0,6 M litium difluoro(oksalat)borat (LiDFOB)–0,6 M litium tetrafluoro borat (LiBF 4) /dietil karbonat (DEC)–4–fluoro-1,3–dioksolana–2-on (FEC), dan 1 M LiPF 6 dalam 1:1 v/v etilena karbonat/dimetil karbonat (EC/DMC). [ 13 , 14 ] Ditemukan bahwa endapan SEI awal pada CuCC tidak stabil, endapan ini dapat dengan mudah direkonstruksi selama siklus berikutnya dan tidak memiliki dampak positif pada kinerja pelapisan-pelepasan litium dalam elektrolit ini. Namun, upaya lebih lanjut diperlukan untuk memahami apakah kesimpulan ini analog untuk jenis media elektrolit lainnya dan untuk menemukan prosedur praperlakuan in situ yang berguna yang memodifikasi permukaan CC dan secara efektif meningkatkan kinerja siklus anoda.
Elektrolit konsentrasi tinggi (HCE) mendapat perhatian sebagai solusi yang mungkin untuk masalah pengendapan litium dendritik, karena stabilitas elektrokimia yang ditingkatkan dan kepadatan pembawa muatan yang tinggi, yang memungkinkan pembentukan SEI yang homogen dan kaya anorganik. [ 15 ] Namun, HCE memiliki konduktivitas ionik yang rendah, viskositas yang tinggi, dan keterbasahan yang lemah, yang membatasi aplikasi praktisnya. [ 15 ] Strategi yang menjanjikan untuk mengatasi kelemahan ini adalah mengencerkan HCE dengan pelarut/pengencer inert yang sesuai, tanpa mempengaruhi koordinasi garam-pelarut litium primer dalam HCE dan membentuk apa yang disebut elektrolit konsentrasi tinggi terlokalisasi (LHCE). [ 16 ] LHCE telah menunjukkan kinerja yang ditingkatkan dalam LMB yang memungkinkan pengendapan lapisan litium yang jauh lebih teratur pada anoda dibandingkan dengan elektrolit encer konvensional. [ 15 , 16 ] Ada beberapa jenis LHCE, berdasarkan konsep ini, terutama yang melibatkan LiPF 6 , LiFSI, atau LiTFSI sebagai garam; karbonat organik, eter, atau sulfon sebagai pelarut; dan senyawa yang sangat terfluorinasi (misalnya 1,1,2,2–tetrafluoroetil–2,2,3,3-tetrafluoropropil eter, TTE) sebagai pengencer. [ 16 ] Di antara contoh-contoh ini, LHCE berbasis sulfon/sulfolana (SL) adalah alternatif baru yang kurang diteliti, yang menawarkan sifat-sifat menguntungkan tambahan, termasuk stabilitas anoda yang tinggi, mengurangi sifat mudah terbakar, dan dampak lingkungan negatif yang rendah. [ 16 – 19 ] Sifat terakhir dari elektrolit ini berasal dari tekanan uap yang sangat rendah, sifat mudah terbakar yang dapat diabaikan, dan permeabilitas kulit minimal dari komponen SL. [ 20 ] Selain itu, SL sangat stabil dan sudah digunakan dalam industri kimia, dan dapat digunakan kembali berkali-kali dan metode industri untuk regenerasi SL bekas telah dikembangkan.
Tujuan dari pekerjaan saat ini adalah untuk mengeksplorasi efek pembentukan SEI awal pada CuCC dalam LHCE berbasis SL (LiTFSI dalam SL:TTE [2:3, mol:mol], 10 vol% dari FEC) dan untuk menyarankan prosedur praperlakuan in situ praktis yang berhasil bekerja di lingkungan kimia ini. Oleh karena itu, dua jenis praperlakuan elektrokimia, yang tidak melibatkan pengendapan kelebihan potensial Li (OPD) dipelajari dalam hal pertumbuhan lapisan pasif, morfologi permukaan, komposisi antarmuka yang terbentuk, dan kinerja elektrokimia dari CuCC yang dimodifikasi. Perhatian khusus diberikan pada karakterisasi in situ dengan menggunakan keseimbangan mikro kristal kuarsa elektrokimia (EQCM) dengan pemantauan redaman, yang menunjukkan bahwa lapisan Cu–SEI memiliki perilaku viskoelastis yang cukup besar. Studi ini menunjukkan dampak dari prosedur praperlakuan yang dirancang dan memberikan analisis komparatif dari efek positif dari strategi yang disarankan untuk perbaikan anoda.
2 Hasil dan Pembahasan
2.1 Perilaku Voltammetri dan Mikrogravimetri CuCC dalam LHCE Berbasis SL
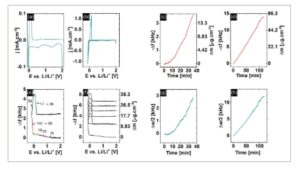
Untuk menentukan kondisi optimal untuk preformasi Cu–SEI yang direncanakan, perilaku elektrokimia CuCC awalnya dipelajari dalam SL LHCE dengan menggunakan voltametri siklik. Untuk memperoleh informasi gravimetrik yang terkait dengan proses pembentukan Cu–SEI selama percobaan voltametri, perubahan frekuensi, Δ f , dan peredaman resonator, Δ w , diukur secara in situ dengan menggunakan EQCM. Kurva voltametri dan gravimetri yang sesuai disajikan dalam Gambar 1 a,b ,e,f, dan sinyal Δ w yang direkam selama voltametri ditampilkan dalam Gambar S1a,b, Informasi Pendukung. Pemindaian katodik awal dari voltametri siklik menunjukkan proses reduksi dengan arus maksimum pada sekitar E = 1,35 V, yang dijelaskan dalam literatur sebagai pembentukan lapisan SEI awal pada CuCC. [ 13 ] Proses ini diikuti oleh puncak arus kedua pada E = 0,5 V, yang dikaitkan dengan pengendapan underpotensial (UPD) litium pada tembaga [ 13 ] dan peningkatan tajam arus katoda, dimulai pada sekitar E = 0 V, yang dikaitkan dengan OPD Li, Gambar 1a . Sapuan anoda voltamogram yang sesuai dengan jelas memperlihatkan pelarutan litium yang dikaitkan dengan kuantitas litium yang diendapkan oleh proses OPD dan UPD, masing-masing, yang menunjukkan karakter reversibel dari kedua fenomena tersebut. Selama siklus voltametri berikutnya, dua proses pengendapan-pelarutan reversibel lebih lanjut hadir. Namun, puncak katoda pada E = 1,35 V yang dikaitkan dengan pembentukan Cu-SEI awal tidak terlihat lebih lanjut dalam voltamogram dan selanjutnya, penurunan arus katoda dalam rentang potensial yang luas (1,75-0 V) dapat diamati dalam pemindaian CV berikutnya (Gambar S1c, Informasi Pendukung). Perilaku redoks ini dapat dikaitkan dengan pembentukan lapisan SEI yang berkelanjutan.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
a) Siklus voltametri pertama dan e) frekuensi terkait yang diukur dalam 0,75 M LiTFSI dalam SL:TTE (2:3, mol:mol), 10 vol% dari FEC. b) Kurva voltametri berturut-turut dan f) perubahan frekuensi/massa terkait yang diukur dalam 0,75 M LiTFSI dalam SL:TTE (2:3, mol:mol), 10 vol% dari FEC. c,d) Frekuensi dan perubahan redaman g,h) yang diukur selama modifikasi CuCC dengan menggunakan prosedur (c,g) CCF dan (d,h) CPF. Angka-angka pada Gambar 1e menunjukkan M app .
Pengukuran frekuensi in situ diubah menjadi beban massa dengan menerapkan persamaan Sauerbrey. [ 21 ] Respons gravimetrik menunjukkan peningkatan massa dengan siklus voltametrik. Selama sapuan katoda pertama, peningkatan massa sedang dalam rentang potensial E = 1,20 hingga −0,05 V dapat dideteksi. Perubahan massa ini dapat dikaitkan dengan puncak Li UPD dalam voltamogram, dan menjadi jelas bahwa proses katoda pertama yang awalnya dijelaskan sebagai pembentukan SEI pada permukaan tembaga tidak disertai dengan akumulasi massa (Gambar 1e ). Kemungkinan besar proses redoks ini dapat dikaitkan dengan pembentukan produk reaksi terlarut yang tidak teradsorpsi pada tahap awal ini pada permukaan elektroda tembaga. Lebih jauh lagi, massa molar nyata, M app , dihitung untuk rentang potensial 1,20–0 V bervariasi antara 18 dan 33 g mol −1 , tergantung pada potensial, dan nilai-nilai ini berkorelasi baik dengan pengendapan senyawa anorganik seperti LiF ( M LiF = 25,94 g mol −1 ) dan Li 2 O ( M Li2O = 29,88 g mol −1 ). Dapat diasumsikan bahwa senyawa anorganik yang mengandung Li ini terbentuk dengan bantuan proses Li UPD dan sebagai tambahan, sejumlah kecil senyawa organik juga terintegrasi karena M app mencapai batas atas 33 g mol −1 . Pada overpotensial yang lebih tinggi, akumulasi massa yang lebih cepat mulai dari E = −0,05 V dan berakhir pada E = 0,02 V dalam sapuan anoda terbalik dapat dikaitkan dengan Li OPD, seperti yang ditunjukkan dalam voltamogram. Namun, dalam rentang potensial ini, M app dimulai dengan 102 g mol −1 dan turun hingga 59 g mol −1 pada E = −0,15 V. M ap yang lebih tinggi yang diamati dibandingkan dengan M Li dan M LiF dapat dikaitkan dengan pengendapan produk organik, misalnya, yang disebabkan oleh dekomposisi reduktif FEC, yang akhirnya menghasilkan massa molar rata-rata 102–59 g mol −1 . Contoh produk organik tersebut adalah radikal netral yang dihasilkan oleh dekomposisi FEC setelah pelepasan ion F − ( M dF-FEC = 87 g mol −1 ) dan molekul vinilena karbonat ( M VC = 86 g mol −1 ). [ 22 ] Pelarutan litium yang diendapkan diamati selama pemindaian anodik antara E = 0,02 dan E = 0,2 V, diikuti oleh plateau massa konstan, yang bertahan hingga akhir sapuan anoda. M app selama pelarutan berjumlah M app = 16−36 g mol −1 , yang menunjukkan bahwa tidak hanya Li + yang meninggalkan permukaan elektroda, tetapi proses ini disertai oleh spesies SEI terlarut lainnya dengan massa molar yang lebih tinggi. Rincian tentang evaluasi M app , berdasarkan satu transfer elektron, disajikan pada Gambar S2, Informasi Pendukung. Perlu dicatat bahwa perubahan massa selama pemindaian anoda tidak kembali ke level nol awal, yang menunjukkan pengendapan ireversibel dan memungkinkan untuk menentukan massa SEI yang tersisa yang diendapkan pada permukaan elektroda tembaga setelah setiap siklus voltametri berikutnya.
Setelah menetapkan kontak elektroda Cu/kuarsa dengan SL LHCE, sebelum voltametri siklik, sinyal redaman resonator meningkat hampir 20 kali w ≈ 20 kHz. Perubahan ini berkorelasi dengan viskositas elektrolit, dan hampir sama dengan redaman teoritis yang dapat diperkirakan dengan menerapkan persamaan Kanazawa–Gordon [ 23 , 24 ] (Informasi Pendukung), yang mendukung validitas pengukuran keseimbangan mikro kristal kuarsa (QCM). Sapuan voltametri katoda awal disertai dengan perubahan redaman konstan yang sangat rendah hingga E = −0,068 V, diikuti oleh sinyal redaman yang kira-kira dua kali lebih rendah daripada perubahan frekuensi. Nilai yang diamati untuk kedua sinyal meningkat dengan nomor siklus, yang menunjukkan akumulasi SEI pada elektroda tembaga (Gambar S1, Informasi Pendukung). Lebih jauh, redaman yang jauh lebih rendah daripada perubahan frekuensi memungkinkan penerapan persamaan Sauerbrey dan analisis mikrogravimetri dari proses pengendapan pada tahap awal ini.
2.2 Perlakuan Awal Elektrokimia CuCC
Berdasarkan analisis voltametri dan mikrogravimetri dari proses redoks yang berlangsung di antarmuka LHCE Cu–SL, dapat disimpulkan bahwa dua jenis strategi praperlakuan in situ untuk preformasi Cu–SEI dapat diwujudkan: 1) prosedur yang tidak melibatkan dan 2) metode yang melibatkan OPD litium. Dalam hal ini, upaya kami difokuskan pada jenis pendekatan pertama, karena tujuan dari penelitian saat ini adalah untuk mengklarifikasi peran SEI yang awalnya dibangun sebelum dimulainya OPD Li pada kinerja anoda tembaga dalam LHCE berbasis SL. Mikrogravimetri in situ telah mengungkapkan bahwa lapisan bawah SEI yang kaya anorganik dapat awalnya dibentuk dalam kisaran potensial 1,20–0 V dan komponen organik diendapkan pada tahap selanjutnya. Untuk mewujudkan struktur seperti itu, adalah rasional untuk menerapkan potensial positif konstan di dekat 0 V untuk waktu yang cukup lama (prosedur CPF). Sebaliknya, prosedur pembentukan arus konstan (CCF) menawarkan pendekatan alternatif untuk pengendapan antarmuka anorganik/organik dengan memvariasikan potensi dalam batas pembentukan SEI yang kaya anorganik (misalnya, antara 0 dan 1 V). Dapat dianggap bahwa dengan menggunakan kedua strategi tersebut, pembentukan SEI yang stabil dan kaya anorganik dapat dicapai.
Selain itu, perbandingan yang memadai dengan perilaku CuCC yang dimodifikasi dengan praperlakuan berdasarkan Li OPD dan dengan kinerja sampel referensi (tanpa praperlakuan apa pun) disediakan. Untuk mengurangi jumlah cacat morfologi permukaan pada lapisan tembaga yang menyebabkan artefak pengukuran dan untuk meningkatkan reproduktifitas eksperimen kami, lapisan tembaga kelas baterai komersial yang digunakan dalam penelitian saat ini dipoles secara elektro. Prosedur elektrokimia untuk pemolesan elektro, perubahan morfologi permukaan yang disebabkan oleh proses ini dan dampak dari prosedur ini pada kinerja siklus CuCC disajikan dalam Gambar S3, Informasi Pendukung. Setelah menyelesaikan pemolesan elektro, CuCC dipraperlakuan secara elektrokimia dalam LHCE berbasis SL menggunakan tiga prosedur berbeda: CCF, dan dua metode yang melibatkan praperlakuan potensial konstan (CPF dan CPF-01). Profil arus/potensial dari prosedur CCF dan CPF tidak termasuk pelapisan litium dan hanya mencakup proses redoks yang terkait dengan UPD Li dan dekomposisi elektrolit, yang terjadi pada potensial lebih tinggi dari E = 0 V. Berbeda dengan CCF dan CPF, prosedur CPF-01 melibatkan pembentukan elektrokimia pada E < 0 V. Uraian terperinci tentang prosedur pembentukan dapat ditemukan pada Gambar S4, Informasi Pendukung.
Secara paralel, prosedur praperlakuan CCF dan CPF dipelajari dengan menggunakan EQCM di samping sinyal listrik untuk memperoleh informasi tentang efek gravimetrik yang menyertai modifikasi permukaan. Evolusi frekuensi resonansi yang terkait dengan penerapan praperlakuan CCF dan CPF dan dihitung berdasarkan perubahan massa persamaan Sauerbrey disajikan dalam Gambar 1c,d . Dapat diamati bahwa penerapan teknik CCF dan CPF menghasilkan pengendapan lapisan SEI awal pada permukaan CuCC, karena penurunan frekuensi resonansi menunjukkan akumulasi massa. Secara khusus, lapisan SEI tumbuh secara linear untuk prosedur CPF, sedangkan dalam kasus CCF pertumbuhan lapisan bersifat nonlinier dan waktu induksi awal diperlukan untuk meningkatkan laju pertumbuhan. Penting untuk dicatat bahwa berbeda dengan pengukuran voltametrik, prosedur kedua praperlakuan elektroda menunjukkan peningkatan bertahap dalam peredaman resonator, yang menunjukkan nilai yang sedikit lebih rendah daripada perubahan frekuensi yang sesuai (Gambar 1g,h ). Perilaku ini menunjukkan bahwa pada waktu eksperimen tingkat lanjut, proses reduksi-dekomposisi yang terjadi pada antarmuka elektroda menghasilkan pengendapan lapisan Cu–SEI dengan viskoelastisitas atau kekasaran yang cukup besar. Telah ditetapkan dengan jelas bahwa secara eksklusif kedua jenis fenomena ini dapat meredam osilasi resonator kuarsa. [ 25 , 26 ] Oleh karena itu, untuk menganalisis apakah perkembangan antarmuka yang kasar, viskoelastisitas atau kombinasi kedua fenomena tersebut menginduksi perilaku disipatif resonator, evolusi morfologi/topologi permukaan elektroda selama prosedur praperlakuan diselidiki.
2.3 Evolusi Morfologi Permukaan dan Mikrostruktur CuCC yang Diolah Sebelumnya
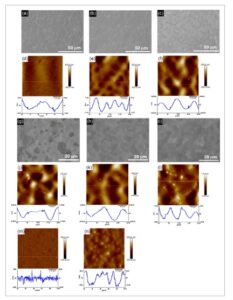
Perubahan morfologi permukaan, yang dipicu oleh praperlakuan tembaga CCF dan CPF, dipelajari pada berbagai tahap dari kedua proses tersebut dengan mikroskop elektron pemindaian (SEM) dan mikroskop gaya atom (AFM). Pola morfologi dari foil CuCC yang dipoles secara elektro yang belum dibentuk sebelumnya menampilkan fitur bergelombang yang khas, di mana kristalit tembaga terlihat jelas pada perbesaran tinggi ( Gambar 2 a,d ). Analisis AFM dari karakteristik morfologi ini menunjukkan kekasaran minimal Ra = 5,9–10,6 nm untuk foil CuCC dan Ra = 3,35–3,71 nm untuk substrat kuarsa berlapis tembaga. Nilai-nilai ini akan berfungsi dalam penelitian kami sebagai morfologi referensi.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Pencitraan SEM permukaan Cu: a) foil Cu yang dipoles secara elektro yang tidak dimodifikasi; b) setelah 50 siklus CCF, c) setelah 100 siklus CCF, g) setelah 5 menit CPF, h) setelah 40 menit CPF, dan i) setelah 100 menit CPF. AFM permukaan Cu: d) foil Cu yang dipoles secara elektro yang tidak dimodifikasi; e) setelah 50 siklus CCF, f) setelah 100 siklus CCF, j) setelah 5 menit CPF, k) setelah 40 menit CPF, dan l) setelah 100 menit CPF. AFM substrat kuarsa yang disemprotkan Cu: m) tidak dimodifikasi dan n) dimodifikasi setelah 100 menit CPF. Profil tinggi linier disediakan di bawah gambar AFM.
Selama perawatan CCF, setelah 50 siklus galvanostatik dalam SL LHCE, morfologi permukaan berubah yang disebabkan oleh modifikasi dengan Cu–SEI awal dan struktur butiran karakteristik CuCC menjadi kurang terlihat (Gambar 2b ). Dalam 50 siklus berikutnya (total 100), kekasaran permukaan semakin meningkat, dan pencitraan SEM menampilkan kepadatan jumlah objek berbentuk bola yang tinggi, yang dihasilkan dari pertumbuhan tambahan lapisan SEI (Gambar 2c ). Pencitraan AFM mengonfirmasi morfologi ini dan menunjukkan peningkatan kekasaran tambahan (Gambar 2e,f ).
Penerapan prosedur CPF menghasilkan evolusi morfologi permukaan elektroda yang berbeda. Pada 5 menit awal CPF, permukaan tembaga sebagian ditutupi dengan lapisan SEI tipis, yang memperlihatkan area melingkar seperti lubang yang terlihat (Gambar 2g ). Pada tahap pembentukan lanjutan (50 menit), lapisan SEI tumbuh lebih jauh, membentuk morfologi datar dua tingkat (Gambar 2h ), yang berevolusi menjadi struktur 3D kasar pada waktu pengendapan 100 menit (Gambar 2i–l ). Dari perspektif mekanis, dapat diantisipasi bahwa mikrostruktur 3D, yang dibentuk dengan bantuan prosedur praperlakuan CPF, harus lebih efektif mengakomodasi regangan yang disebabkan oleh pengendapan litium. Validitas hipotesis ini akan diperiksa dengan karakterisasi elektrokimia anoda (bagian Kinerja Elektrokimia).
Untuk memperkirakan pengaruh morfologi permukaan terhadap redaman dan sinyal frekuensi resonansi, analisis teoritis disipasi gelombang geser pada antarmuka padat-cair berdasarkan karya Daikhin et al. [ 25 ] dilakukan. Respon QCM (yaitu, pergeseran frekuensi resonansi,mathematical equation, dan peredaman resonansi didefinisikan sebagai lebar puncak resonansi, w ) yang dipicu oleh morfologi antarmuka bergantung pada geometri karakteristik kekasaran dan skala panjang gelombang geser dalam cairan dan resonator kuarsa.
Dalam percobaan QCM, morfologi antarmuka dan kekasaran mungkin memiliki besaran yang bervariasi dan dengan demikian batas interpretasi teoritis, tergantung pada parameter kekasaran harus ditentukan. Menurut Daikhin et al. [ 25 ] antarmuka endapan kasar dapat dicirikan oleh serangkaian panjang, vertikal,mathematical equation, dan lateral,mathematical equation, dan berdasarkan parameter ini, dua jenis antarmuka, sesuai dengan kekasaran sedikit (mathematical equation) dan kekasaran yang kuat (mathematical equation) dapat dipertimbangkan. Analisis AFM morfologi yang telah dilakukan untuk sampel yang dimodifikasi SEI mengkonfirmasi validitasmathematical equationuntuk seluruh rentang kondisi pengendapan, menunjukkan karakteristik antarmuka yang sedikit kasar.
Oleh karena itu, dengan menggunakan panjang karakteristikmathematical equationDanmathematical equationdiperoleh dengan AFM dan kedalaman penetrasi gelombang geser δ , pergeseran frekuensi resonansi yang sesuai dan lebar resonansi, yang disebabkan oleh sedikit kekasaran, secara teoritis diperkirakan dengan menerapkan persamaan berikut:
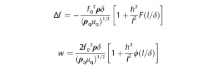
Pada Persamaan ( 1 ) dan ( 2 ),mathematical equationDanmathematical equationadalah fungsi skala,mathematical equationmenunjukkan frekuensi kuarsa yang tidak dimuat,mathematical equationmenunjukkan impedansi mekanik kuarsa, ρ menunjukkan kepadatan elektrolit,mathematical equationmenunjukkan modulus geser kuarsa, dan δ menunjukkan kedalaman penetrasi gelombang geser dalam cairan. Seperti yang dijelaskan oleh Daikhin et al. [ 25 ] mathematical equationDanmathematical equationmemiliki bentuk yang ditentukan oleh morfologi permukaan dan perilaku asimtotik universal untukmathematical equationDanmathematical equation, yang memungkinkan untuk memperkirakan pengaruh geometrik antarmuka pada kondisi tertentu ini. Secara praktis, suku kedua dalam tanda kurung pada Persamaan ( 1 ) dan ( 2 ) memperhitungkan pengaruh antarmuka yang tidak merata antara elektrolit dan substrat dan bergantung padamathematical equationrasio. Padamathematical equationDanmathematical equation, masing-masing, fungsi penskalaan memperoleh bentuk yang disederhanakan, dijelaskan pada Bagian 4, Informasi Pendukung.
Karakterisasi AFM dari morfologi permukaan sampel kuarsa/Cu–SEI membantu analisis efek kekasaran pada disipasi resonator kuarsa dalam elektrolit. Evaluasi vertikal,mathematical equationdan lateral,mathematical equationSkala panjang yang diperoleh secara eksperimental menunjukkan bahwa kekasaran permukaan memiliki dampak yang dapat diabaikan pada frekuensi resonansi dan peredaman di SL LHCE (Bagian 3, Gambar S5, Informasi Pendukung). Oleh karena itu, sifat viskoelastis lapisan Cu–SEI menginduksi fenomena disipasi osilasi kuarsa, dan efek ini terkait dengan komposisi kimia dan sifat struktural lapisan Cu–SEI. Meskipun peredaman resonansi tidak dapat diabaikan, interpretasi kualitatif mikrogravimetri in situ menunjukkan peningkatan bertahap M ap selama pengendapan SEI CPF (Gambar S6, Informasi Pendukung). Pengamatan ini menunjukkan bahwa kuantitas senyawa organik dengan M ap yang lebih tinggi tumbuh pada waktu pembentukan yang lebih awal, yang menunjukkan gradien distribusi komponen SEI di seluruh ketebalan lapisan, yang menghasilkan lapisan SEI bagian dalam yang kaya anorganik dan lapisan SEI bagian luar yang kaya organik. Berdasarkan analisis hasil elektrokimia dan QCM, dimungkinkan untuk mengusulkan mekanisme preformasi SEI berikut di SL LHCE ( Skema 1 ), yang melibatkan tiga tahap berikutnya.

Skema 1
Buka di penampil gambar
Presentasi PowerPoint
Mekanisme praformasi SEI di LHCE berdasarkan sulfolane.
1) Proses reduksi awal pada E = 1,35 V, terkait dengan dekomposisi elektrolit, yang menghasilkan pembentukan produk organik yang larut. Produk-produk tersebut tidak teradsorpsi pada permukaan tembaga dan kemungkinan besar terkait dengan dekomposisi FEC awal. [ 22 ] Diketahui bahwa FEC terurai secara reduktif pada potensial yang lebih tinggi dari 1 V versus Li/Li + , yang menekan reduksi komponen-komponen lainnya. [ 3 ] 2) Pembentukan lapisan tipis awal (dalam rentang potensial 1–0 V), yang sebagian besar terdiri dari domain-domain anorganik (partikel) dan mungkin sejumlah kecil komponen organik (tidak ditunjukkan pada skema), misalnya, produk-produk dekomposisi FEC yang teradsorpsi pada permukaannya dari elektrolit. Dapat diasumsikan bahwa lapisan anorganik terbentuk dengan bantuan Li UPD pada tembaga. 3) Pada potensial yang mendekati 0 V (pada E = 0,02 V), interfase secara bertahap mengakumulasi senyawa-senyawa organik (produk-produk dekomposisi, atau sebagai hasil dari polimerisasi) dengan berat molekul yang lebih tinggi.
Untuk menganalisis komposisi kimia lapisan Cu–SEI dan mengkorelasikan data analitis dengan kinerja elektrokimia CuCC yang dimodifikasi, karakterisasi spektroskopi fotoelektron sinar-X (XPS) dilakukan.
2.4 Komposisi Kimia Interfase Cu–SEI
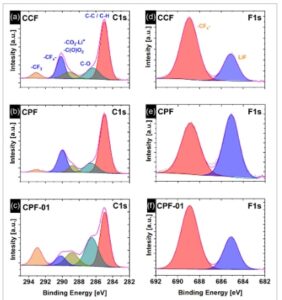
Komposisi kimia dari lapisan SEI yang diendapkan dikarakterisasi dengan XPS untuk menganalisis konsentrasi masing-masing komponen, yang dipengaruhi oleh prosedur praperlakuan. Oleh karena itu, spektrum XPS dari lapisan Cu–SEI setelah praperlakuan elektrokimia dengan teknik CCF (SEI CCF ), CPF (SEI CPF ), dan CPF-01 (SEI CPF-01 ) diukur dan sinyal tingkat inti dari unsur-unsur yang terdeteksi, yaitu C, O, F, S, dan Li diinterpretasikan. Hasil XPS berkorelasi baik dengan data spektroskopi yang telah tersedia pada komposisi lapisan SEI dalam elektrolit berbasis SL. [ 16 , 17 ] Gambar 3 menunjukkan perbandingan antara spektrum tingkat inti (C1 s dan F1 s ) dari lapisan Cu–SEI yang terbentuk dengan menerapkan tiga prosedur praperlakuan yang berbeda. Kurva XPS eksperimental ditampilkan bersama dengan komponen yang dipasang dan kecocokan selubung. Konsentrasi unsur (dalam at%) ditentukan dengan asumsi distribusi homogen tanpa ketergantungan kedalaman, menerapkan penampang fotoemisi dan faktor asimetri dari Yeh dan Lindau. [ 27 ] Analisis kuantitatif unsur dari tiga jenis sampel dapat ditemukan di Tabel S1, Informasi pendukung.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
a–c) C1 s dan d–f) Spektrum fotoelektron sinar-X tingkat inti F1 untuk Cu–SEI dilakukan menggunakan teknik (a,d) CCF, (b,e) CPF, dan (c,f) CPF-01 .
Spektrum C1 s menunjukkan dua puncak pada sekitar 285,0 dan 287,0 eV, yang dibedakan dengan baik untuk ketiga sampel. Komponen pertama dapat dikaitkan dengan atom karbon yang terikat hanya pada atom C atau H (R CH 2 ), sedangkan puncak kedua terkait dengan atom karbon dalam satu lingkungan oksigen, seperti pada R CH 2 CO . [ 28 – 31 ] Rasio kedua komponen ini ≈3:1 dan 4:1 untuk komposisi dekat permukaan sampel CPF dan CCF merupakan indikasi bahwa FEC, TTE, dan SL atau produk dekomposisinya dengan ikatan C C memiliki kontribusi yang kuat pada struktur SEI ini. Komponen C1 s pada energi pengikatan (BE) yang lebih tinggi antara 288,8 dan 290,2 eV terkait dengan atom karbon dengan dua atau tiga atom oksigen tetangga dan koordinasi ion Li yang lemah. [ 28 – 31 ] Untuk kelengkapan interpretasi ini, spektrum O1 s yang sesuai juga dianalisis dan disajikan pada Gambar S7, Informasi Pendukung. Senyawa yang mengandung C F dapat dibuktikan dalam spektrum C1 s dalam rentang BE yang luas, yaitu, 287,3–293,7 eV, di mana puncak pada 293,2 eV dikaitkan dengan atom karbon terfluorinasi penuh (seperti pada gugus CF 3 dalam TFSI − ). [ 32 ] Kami percaya bahwa sinyal XPS dari gugus CF x berasal dari spesies elektrolit yang terikat/terintegrasi dalam struktur SEI atau produk dekomposisinya, karena sampel dicuci secara menyeluruh dengan pelarut organik (DMC) dan dikeringkan dalam vakum selama 24 jam.
Perlu dicatat bahwa kontribusi fluor dalam LiF dan dalam senyawa organik dapat dibedakan dengan analisis spektrum F1 s . Dalam semua sampel yang diukur, F1 s menampilkan dua komponen utama pada 685,0 dan 689,0 eV. Mereka ditugaskan ke dua struktur kimia yang terintegrasi dalam lapisan SEI: kelompok LiF dan CF x , masing-masing, [ 32 ] keduanya dihasilkan dari spesies elektrolit atau dekomposisinya. Karena kuantitas relatif dan distribusi LiF merupakan faktor kunci untuk homogenitas SEI, sifat fisik lapisan SEI, dan kinerja elektrokimia CuCC yang dimodifikasi, kuantifikasi LiF merupakan langkah penting dari karakterisasi XPS SEI. Jumlah relatif LiF dan rasionya terhadap kuantitas komponen organik dalam SEI bervariasi tergantung pada metode praperlakuan. Dapat diamati bahwa jumlah F total dalam lapisan Cu–SEI yang telah dibentuk sebelumnya oleh CCF dan CPF lebih rendah daripada dalam sampel yang dimodifikasi oleh CPF-01, F CCF = F CPF = 12,6–10,1%, dibandingkan dengan F CPF-01 = 17%. Namun, menjadi jelas bahwa LiF, komponen yang sering dikaitkan dengan peningkatan kinerja anoda, hadir dalam SEI CPF dan SEI CPF-01 dengan sekitar 5% dan hanya sekitar 3% dalam SEI CCF . Oleh karena itu, berdasarkan jumlah LiF yang relatif rendah dalam komposisi ketiga Cu–SEI, dapat diharapkan bahwa tidak hanya LiF yang dapat memainkan peran untuk kinerja anoda tetapi juga distribusi komponen anorganik dan organik dan proporsinya. Peningkatan jumlah total F dalam SEI CPF-01 terkait dengan kontribusi komponen F1 yang lebih besar pada 689,0 eV (sekitar 12%, dibandingkan dengan 9% dan 5% untuk SEI CCF dan SEI CPF , masing-masing). Pengamatan ini berkorelasi dengan M ap yang diperoleh dengan menggunakan EQCM, yang menunjukkan bahwa lebih banyak produk dekomposisi organik yang mengandung F dimasukkan dalam lapisan SEI pada E < 0 V dan pada tahap awal pembentukan SEI ( E > 0 V) pengendapan komponen M ap rendah (misalnya, LiF) mendominasi.
Umumnya, lapisan LiF yang diendapkan pada anoda dapat dianggap sebagai isolator elektronik yang sempurna, karena jumlah cacatnya yang rendah dan penghalang transpor yang tinggi. [ 33 , 34 ] Lebih jauh lagi, LiF menampilkan modulus Young yang tinggi (70 GPa), memberikan stabilitas mekanis yang signifikan pada elektroda selama siklus dan berpotensi mengurangi pembentukan dan pertumbuhan dendrit. Selain itu, diamati bahwa LiF terbentuk pada permukaan elektroda sebagai partikel yang terdistribusi secara acak, dan bukan sebagai lapisan kontinu. Dalam konteks pembahasan ini, ada dua jenis pemahaman utama mengenai fungsi LiF dalam SEI. Pengetahuan umum tentang peran LiF dalam lapisan SEI adalah bahwa ia memiliki fungsi pelindung, yang mendorong pengendapan litium yang seragam. Terkait dengan ini, eksperimen elektrokimia pelapisan litium pada anoda berlapis LiF mengonfirmasi dampak positif lapisan LiF dalam mewujudkan pengendapan litium yang teratur. [ 32 , 34 ] Pengamatan ini juga berkorelasi dengan perilaku elektrolit berkonsentrasi tinggi yang mengandung fluor (misalnya, dengan FEC dan LiFSI), menunjukkan pembentukan SEI kaya LiF, pada permukaan anoda. [ 35 – 37 ]
Sebaliknya, ditemukan bahwa dalam SEI yang terbentuk pada litium, LiF memiliki struktur granular dan selanjutnya, fase LiF ditutupi dengan lapisan Li 2 CO 3 . [ 38 ] Selain itu, diamati bahwa SEI pada grafit memiliki lapisan internal yang terdiri dari spesies anorganik (terutama domain LiF dan Li 2 O) dan bagian luar yang terutama terdiri dari produk dekomposisi pelarut organik. [ 39 ] Analisis SEI pada litium, yang dilakukan dengan mikroskopi krio-elektron, mengungkapkan bahwa LiF hadir dalam bentuk partikel. [ 40 ] Pengamatan ini menunjukkan bahwa LiF tidak memiliki kontak langsung dengan elektrolit dan tidak memainkan peran protektif dalam struktur SEI. Terkait dengan diskusi ini, analisis mikrogravimetri dari pembentukan Cu–SEI telah menunjukkan bahwa dalam LHCE berbasis SL, SEI kaya anorganik dapat diendapkan padamathematical equationdan dengan penurunan potensi lebih lanjut (mathematical equation) kontribusi komponen organik dengan M app yang lebih tinggi , yang kemungkinan besar terbentuk di atas, ditingkatkan.
Analisis literatur menunjukkan bahwa mekanisme yang digunakan LiF untuk memengaruhi perilaku anoda selama pengendapan/pelarutan Li masih kontroversial. Namun, penerapan komponen elektrolit berfluorinasi tinggi telah sangat meningkatkan kinerja elektroda negatif, khususnya masa pakai siklus dan kemampuan laju. Hal ini menunjukkan bahwa peningkatan kinerja anoda dapat menjadi hasil kontribusi sinergis LiF dan berbagai senyawa organik yang sifatnya bergantung pada komposisi elektrolit. Oleh karena itu, dapat disarankan bahwa pada ketebalan konstan tiga faktor utama menentukan stabilitas lapisan SEI selama pelapisan/pelapisan litium: 1) rasio antara LiF dan senyawa organik dalam lapisan, 2) sifat fase organik, dan 3) mikro/nanostruktur SEI dan sifat mekanis yang sesuai dari komposit organik-anorganik yang terbentuk.
Analisis XPS menunjukkan bahwa kuantitas senyawa organik hampir konstan, setara dengan 21–24% karbon yang terintegrasi dalam lapisan SEI. Namun, komponen F1 pada 689,0 eV menunjukkan bahwa bagian relatif dari gugus CF x yang terintegrasi dalam lapisan Cu–SEI bergantung pada pendekatan praperlakuan, yang menampilkan jumlah tertinggi dalam SEI CPF-01 dan terendah dalam SEI CPF . Pengamatan ini menunjukkan bahwa jumlah komponen elektrolit yang mengandung gugus CF x , seperti TTE dan TFSI − dan produk dekomposisinya, dalam struktur SEI, relatif terhadap kuantitas LiF, akan berperan dalam efisiensi pelapisan-pelapisan litium pada antarmuka Cu–SEI. Dalam konteks ini, lapisan Cu–SEI yang ideal harus tersusun dari struktur hibrida seimbang dari domain LiF terdistribusi teratur yang terikat dengan fase organik dengan perilaku konduksi viskoelastis dan ionik. Jenis struktur seperti itu akan memberikan kestabilan mekanis, fleksibilitas, dan fluks Li-ion yang homogen secara bersamaan, yaitu karakteristik fisik yang sangat menguntungkan untuk peningkatan kinerja anoda.
2.5 Kinerja Elektrokimia
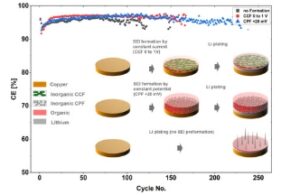
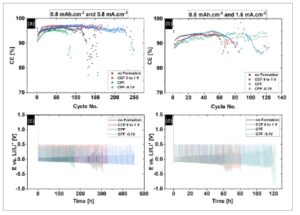
Setelah menyelesaikan preformasi dengan prosedur CCF, CPF, dan CPF-01, kinerja CuCC untuk pengendapan dan pelarutan litium dikarakterisasi secara galvanostatik pada dua kerapatan arus yang berbeda ( j = 0,8 mA cm −2 , j = 1,6 mA cm −2 ) dan kapasitas konstan C = 0,8 mAh cm −2 . Eksperimen arus konstan dilakukan dengan menerapkan siklus lengkap dalam sel Li || Cu asimetris, di mana jumlah litium yang diendapkan pada CuCC larut sepenuhnya dalam semua siklus. Berdasarkan evaluasi parameter elektrokimia yang diperoleh dari uji galvanostatik, yaitu efisiensi arus, kelebihan potensial, dan jumlah siklus yang berhasil sebelum kerusakan siklus reguler elektroda, kinerja elektrokimia CuCC yang dimodifikasi dinilai. Analisis gabungan dari kuantitas ini meningkatkan pemahaman tentang efek prosedur praperlakuan pada siklabilitas CuCC dalam LHCE berbasis SL. Profil potensial yang sesuai dan efisiensi arus pelapisan-pelepasan litium, yang diukur pada CuCC yang telah dipraperlakuan dan sampel yang tidak dipraperlakuan disajikan dalam Gambar 4. Perbandingan profil potensial semua jenis sampel pada berbagai tahap siklus arus konstan disajikan dalam Gambar S8 dan S9, Informasi Pendukung. Eksperimen galvanostatik jangka panjang yang dilakukan pada j = 0,8 mA cm −2 menunjukkan bahwa modifikasi CuCC dengan menerapkan prosedur CCF dan CPF, yang tidak melibatkan OPD litium, menunjukkan peningkatan yang nyata dari stabilitas siklus. Secara khusus, CuCC yang diolah dengan CPF menunjukkan peningkatan terbesar dari kinerja siklus, hampir dua kali lebih banyak siklus dibandingkan dengan sampel CuCC yang tidak dibentuk sebelumnya, diikuti oleh sampel yang dipraperlakuan dengan CCF. CuCC yang dilakukan dengan prosedur CPF-01, yang melibatkan Li OPD, menampilkan kinerja yang paling tidak stabil, berakhir setelah hanya 75 siklus. Perilaku ini kemungkinan besar terkait dengan pengendapan litium yang tidak homogen, yang memicu pertumbuhan dendrit awal dan kegagalan siklus. [ 3 ] Prosedur CPF-0.1 melibatkan langkah potensial langsung ke E = −0.1 V, di mana sejumlah besar senyawa organik diendapkan. Akibatnya, dalam kondisi ini, struktur SEI anorganik-organik yang optimal tidak terbentuk dan lapisan bawah kaya anorganik yang menstabilkan tidak lengkap.
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
a,b) Efisiensi arus dan c,d) profil siklus galvanostatik sel Li || Cu setelah praperlakuan CuCC.
Potensial berlebih selama siklus galvanostatik semua jenis sampel menunjukkan tren linier, diikuti oleh pertumbuhan dan penurunan kinerja siklus yang cepat dan hampir eksponensial. Dapat diamati bahwa sama seperti penurunan kinerja, peningkatan potensi berlebih berlangsung jauh lebih cepat untuk sampel CuCC yang tidak dimodifikasi dan yang diolah dengan CPF-01 (Gambar 4c,d dan S8, Informasi Pendukung). Selain itu, efisiensi arus pada j = 0,8 mA cm −2 untuk CuCC yang tidak diolah menunjukkan nilai konstan sebesar 96% hingga siklus ke-120, sedangkan sampel yang diolah dengan CCF dan CPF menunjukkan peningkatan CE hampir sebesar 1% (CE = 97%). CE terendah hanya sebesar 94% menunjukkan CuCC yang diolah dengan CPF-01 terbentuk oleh keterlibatan Li OPD. Setelah menerapkan arus siklus dua kali lebih tinggi ( j = 1,6 mA cm −2 , Gambar 4 ), kecenderungan peningkatan potensial berlebih sangat ditingkatkan dan efisiensi arus serta siklus hidup menurun secara signifikan (Gambar 4b,f ). Meskipun kinerja siklus semua sampel menurun pada kerapatan arus yang lebih tinggi, sampel CuCC yang telah diolah terlebih dahulu masih menunjukkan siklabilitas elektrokimia yang lebih baik. Selain itu, efek positif dari praperlakuan CPF ditunjukkan oleh siklus galvanostatik sel CPF LFP || Cu–SEI penuh (Gambar S10, Informasi Pendukung). Selain siklus hidup yang ditingkatkan (yaitu, jumlah siklus galvanostatik yang berhasil), sel penuh dengan anoda praperlakuan CPF menunjukkan tegangan lebih yang lebih rendah di seluruh percobaan. Ia juga mempertahankan kapasitas pelepasan yang lebih tinggi selama lebih banyak siklus dan memastikan CE yang lebih tinggi secara konsisten (Gambar S11, Informasi Pendukung). Peningkatan kinerja sel yang diamati merupakan hasil dari peningkatan efisiensi pelapisan/pelepasan litium melalui penerapan praperlakuan CPF.
Dengan mempertimbangkan kondisi eksperimen konstan untuk siklus galvanostatik (yaitu, komposisi elektrolit tetap, volume elektrolit, kerapatan arus, dan kapasitas litium yang digunakan), alasan perbedaan yang diamati dalam perilaku elektrokimia sel terletak pada sifat antarmuka tembaga–elektrolit. Karena pelapisan litium pada tembaga diatur oleh interaksi antara komposisi SEI dan mikrostruktur, homogenitas, dan sifat mekanis lapisan SEI, ketiga jenis faktor tersebut harus diperhitungkan saat menganalisis subjek ini.
Dalam hal ini, analisis XPS mengungkap perbedaan antara komposisi kimia di dekat permukaan lapisan Cu–SEI yang terbentuk di bawah penerapan tiga jenis metode praperlakuan. Terkait dengan komposisi Cu–SEI, hasil tentang rasio senyawa organik yang mengandung LiF/F berkorelasi baik dengan kinerja elektrokimia anoda tembaga, yang menunjukkan kinerja terbaik lapisan SEI dengan rasio LiF terhadap CF x (CPF) tertinggi. Selain itu, pengamatan menyeluruh terhadap morfologi permukaan dan homogenitas CuCC yang dimodifikasi CPF melalui SEM dan AFM menunjukkan permukaan yang sangat teratur dan kekasaran rendah di area yang luas.
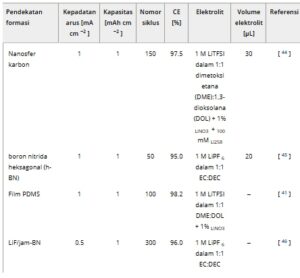
Akhirnya, analisis QCM yang dilakukan dalam pekerjaan kami menunjukkan bahwa lapisan SEI, yang dibentuk oleh penerapan LHCE berbasis SL, menampilkan viskoelastisitas yang ditingkatkan. Seiring dengan yang efektif lainnya untuk stabilisasi lapisan antarmuka litium, Cu–SEI buatan elastis dan viskoelastis dijelaskan dalam literatur sebagai solusi yang mungkin untuk masalah ketidakstabilan pelapisan litium. [ 5 ] Contoh lapisan seperti itu yang sudah diketahui termasuk polidimetilsiloksan (PDMS) @Cu atau Li, [ 41 ] LPS-PDMS @Cu atau Li, [ 5 , 41 ] dan lapisan polimer adaptif. [ 42 ] Seiring dengan jenis lapisan SEI buatan ini, pendekatan teknologi lebih lanjut untuk pembentukan Cu–SEI tercantum dalam Tabel 1 . [ 42 – 52 ] Dibandingkan dengan strategi peningkatan ini, pendekatan kami menghasilkan kinerja elektrokimia anoda yang serupa [ 47 , 48 ] dan bahkan lebih unggul. [ 50 , 52 ] Berdasarkan analisis literatur yang disajikan dalam Tabel 1 , dapat dikonfirmasi bahwa metode praperlakuan kami memungkinkan kinerja siklus anoda yang kompetitif. Namun, keuntungan utama dari strategi kami terletak pada struktur yang dirancang secara rasional yang menggabungkan beberapa properti yang diinginkan menjadi satu matriks. Metode yang diusulkan dalam studi saat ini tidak memerlukan langkah persiapan tambahan, memungkinkan pembentukan antarmuka elektrolit padat buatan (ASEI) in situ, dan peningkatan keamanan dan keberlanjutan dengan desain elektrolit yang ramah lingkungan, berbiaya rendah, dan mudah terbakar rendah. Lebih jauh lagi, dengan kombinasi efektif prosedur elektropolishing dan praperlakuan yang tidak melibatkan Li OPD viskoelastis, stabil secara mekanis, dan homogen pada lapisan antarmuka skala besar terbentuk. Stabilitas antarmuka ini juga ditingkatkan dengan realisasi struktur 3D dengan metode CPF, yang secara lebih efektif mempertahankan perubahan morfologi dinamis antarmuka selama pelapisan dan pengelupasan litium.
Tabel 1. Parameter siklus galvanostatik dan kondisi eksperimen untuk berbagai ASEI.
3 Kesimpulan
Efek dari praperlakuan permukaan in situ elektrokimia anoda CuCC, untuk AFLMB dengan LHCE berbasis SL, dianalisis dengan menggunakan berbagai teknik karakterisasi, termasuk siklus galvanostatik dan voltametri, SEM, AFM, XPS, dan EQCM. Ditunjukkan bahwa prosedur praperlakuan elektrokimia yang tidak melibatkan Li OPD (CPF dan CCF) memiliki dampak positif pada kinerja anoda, menampilkan siklus hidup yang lebih panjang daripada CuCC yang tidak dimodifikasi dan elektroda tembaga yang dipraperlakuan dengan prosedur berbasis OPD. Analisis mikrogravimetri dari pembentukan SEI pada CuCC menunjukkan bahwa dalam LHCE berbasis SL, SEI yang kaya anorganik dapat diendapkan dalam rentang potensial 0–1 V dan dengan penurunan potensial lebih lanjut ( E < 0 V) atau dengan menahan potensial mendekati 0 V kontribusi komponen organik dengan M app yang lebih tinggi , yang kemungkinan besar terbentuk di atas ditingkatkan. EQCM dan karakterisasi struktur permukaan dari pertumbuhan lapisan pasif selama prosedur CCF dan CPF mengindikasikan bahwa lapisan Cu–SEI memiliki perilaku viskoelastis yang cukup besar dan struktur lapisan yang sangat homogen dengan kekasaran permukaan yang rendah. Korelasi antara karakterisasi struktur dan sifat elektrokimia dari lapisan SEI yang telah dibentuk sebelumnya mengindikasikan bahwa efek positif dari struktur dan komposisi SEI pada kinerja elektrokimia dikaitkan dengan pengaruh sinergis dari komposisi anorganik–organik yang seimbang, sifat viskoelastis yang ditingkatkan, dan morfologi lapisan yang homogen pada skala mikro/nano. Pembentukan awal lapisan SEI yang homogen melalui prosedur CPF dan CCF memungkinkan percepatan pengangkutan ion Li dan distribusi kerapatan arus yang seragam yang mengurangi kemungkinan pembentukan dendrit litium. Analisis struktur permukaan dan mikrogravimetri mengungkapkan perbedaan substansial antara jenis lapisan SEI CCF dan CPF. Sementara pertumbuhan lapisan CCF seragam dan akhirnya menghasilkan SEI yang tipis dan halus, prosedur pengendapan CPF memungkinkan pembentukan lapisan pasif 3D yang seragam, namun berpori dan tebal yang jauh lebih cepat dan lebih efisien. Karakterisasi elektrokimia menunjukkan bahwa jenis pelapis ini (SEI CPF) memiliki sifat pelindung yang lebih baik karena tekanan mekanis yang disebabkan oleh nukleasi dan pertumbuhan litium dapat dengan mudah diakomodasi oleh struktur anorganik-organik 3D dari antarmuka SEI prabentuk berbasis CPF. Dalam hal ini, rasio optimal komponen organik dan anorganik, struktur mikro 3D, dan perilaku viskoelastis lapisan SEI memainkan peran yang menentukan dalam kinerja elektrokimia anoda. Studi ini menunjukkan dampak dari prosedur praperlakuan yang dirancang dan memberikan perbandingan yang tepat antara pendekatan terkini yang diusulkan dan pencapaian yang tersedia dalam literatur. Efek positif yang diamati dari metode praperlakuan CPF dapat bermanfaat untuk peningkatan kinerja kolektor arus berstruktur 3D dan aplikasinya dalam AFLMB, di mana dampak bersama dari luas permukaan yang tinggi dan pelapisan litium yang seragam dapat diharapkan. Aplikasi berbasis LHCE pada SL dalam AFLMB berpotensi untuk meningkatkan keselamatan, dan perlindungan lingkungan, mendukung upaya yang menantang dari transformasi energi yang cepat dan transisi ke mobilitas yang berkelanjutan.
4 Bagian Eksperimen
Bahan Kimia dan Material
SL dengan kemurnian 99% diperoleh dari Alfa Aesar dan dikeringkan selama 3 hari pada suhu 50 °C menggunakan saringan molekuler dengan diameter pori 0,3 nm (Carl Roth, Jerman). TTE dan FEC dibeli dari TCI Chemicals dan dikeringkan pada suhu ruangan selama 3 hari menggunakan saringan molekuler. Litium bis(trifluoromethanesulfonyl)imide (LiTFSI), juga dipesan dari TCI Chemicals, dikeringkan dalam vakum pada suhu 100 °C selama 24 jam. Elektrolit yang digunakan dalam pengukuran elektrokimia adalah 1,5 dan 0,75 M LiTFSI dalam SL/TTE (rasio molar 2:3) dengan penambahan 10 vol% FEC.
Sebelum digunakan, lapisan logam litium (≥99,9%) (Alfa Aesar) dibersihkan dengan sikat nilon. Lapisan tembaga bermutu baterai (MTI) digunakan sebagai pengumpul arus/substrat untuk pengujian elektrokimia dan persiapan sampel guna mempelajari berbagai jenis SEI.
Sebelum digunakan, lembaran tembaga yang dipoles secara elektro dibersihkan dengan merendamnya dalam 0,1 MH 2 SO 4 selama 5 menit, lalu dibilas dengan air suling. Substrat dikeringkan dengan aliran nitrogen atau argon, lalu dikeringkan lebih lanjut dalam vakum selama 30 menit. Setelah dibersihkan, lembaran tembaga dipotong menjadi kepingan berukuran 11 mm dan disimpan dalam lingkungan argon.
Karakterisasi Elektrokimia dan Persiapan SEI
Percobaan elektrokimia dilakukan dengan menggunakan potensiostat/galvanostat Biologic VMP3. Berbagai SEI dibentuk oleh siklus arus konstan (CCF) dan potensial konstan (CPF).
Untuk memperoleh permukaan yang rata dan seragam pada lapisan tembaga, proses elektropolishing dikembangkan. Dalam proses ini, lapisan tembaga berfungsi sebagai anoda, sementara pelat tembaga berfungsi sebagai katoda dalam susunan dua sel elektroda. Elektrolit yang digunakan untuk elektropolishing terdiri dari 50 vol% H 3 PO 4 , 30 vol% etanol, dan 20 vol% air sulingan ganda.
Pemolesan elektro dilakukan melalui tiga siklus galvanostatik, yang masing-masing berlangsung selama 3 menit pada kerapatan arus 4 A dm −2 , dengan jeda 2 menit di antara siklus. Pendekatan ini berhasil menghasilkan permukaan tembaga yang dipoles. Voltametri siklik dalam LHCE berbasis SL dilakukan dalam batas potensial dari 2 hingga −0,15 V pada 5 mV s −1 .
Prosedur CCF melibatkan siklus antara 0 dan 1 V dengan arus konstan 0,02 mA cm −2 selama 100 siklus, sementara metode CPF melibatkan penerapan arus konstan 0,01 mA cm −2 dari potensial rangkaian terbuka ke 20 mV, dan kemudian menahan potensial pada 20 mV hingga arus lebih rendah dari −0,5 μA tercapai. Sel setengah koin tipe 2025 dirakit dalam kotak sarung tangan berisi Ar dengan lapisan tembaga poles polos sebagai substrat untuk pengendapan logam litium dan lapisan litium sebagai elektroda lawan. Sel koin dirakit dengan satu pegas gelombang baja, satu spacer baja, dan pemisah Celgard. Jumlah konstan 1,5 M LiTFSI dalam SL:TTE (rasio molar 2:3) dan 10 vol% elektrolit FEC digunakan dalam setiap sel, dengan volume total 60 μL. Luas efektif lapisan tembaga untuk pengendapan litium adalah 0,95 cm 2 (diameter: 1,1 cm). Selama setiap siklus, litium 0,8 mAh cm −2 diendapkan pada substrat pada berbagai kerapatan arus dan litium dilepaskan hingga potensial mencapai 0,5 V versus Li/Li + . CE didefinisikan sebagai kapasitas pelepasan litium dibagi dengan kapasitas pelapisan litium. Untuk menguji anoda yang dimodifikasi dalam sel penuh, LiFePO 4 (MTI Corporation) pada 2 mAh cm −2 digunakan sebagai material katoda. Pengukuran EQCM dilakukan dalam sel PTFE buatan lab yang dilengkapi dengan resonator kristal kuarsa (10 MHz), yang dibeli dari KVG Quartz Crystal Technology, dilapisi dengan lapisan perekat krom 10 nm dan lapisan tipis tembaga (200 nm) di atasnya dengan penguapan termal. Penerimaan kuarsa dipantau oleh kartu komputer PCI Saunders 250B Network Analyzer (Saunders & Associates Inc.) yang dikontrol oleh perangkat lunak yang ditulis di laboratorium. Resonator kuarsa juga dihubungkan ke potensiostat VMP3 dan secara bersamaan digunakan sebagai elektroda kerja untuk prosedur pembentukan SEI dan pengukuran voltametri siklik. Pengaturan EQCM yang digunakan dalam penelitian saat ini dijelaskan dalam ref. 53. Strip litium berfungsi sebagai elektroda pembanding dan referensi. Desain eksperimen ini cocok untuk perekaman operando perubahan frekuensi, f, dan parameter peredaman, w, dari kurva resonansi.
AFM
Pengukuran AFM dilakukan menggunakan mikroskop gaya atom Dimension Icon (Bruker Co., AS) dalam kotak sarung tangan berisi argon (M. Braun Inertgas-Systeme GmbH, Jerman) dengan konsentrasi H 2 O dan O 2 di bawah 1 ppm untuk mempertahankan SEI. Pengukuran dilakukan dalam mode penyadapan PeakForce yang dilengkapi dengan probe udara ScanAsyst. Semua gambar AFM termasuk analisis permukaan dan estimasi kekasaran, diproses dengan prosedur perataan polinomial orde ketiga menggunakan perangkat lunak Analisis Nanoscope (Bruker Co., AS) untuk menghilangkan kemiringan dan kelengkungan yang tidak diinginkan.
SEM dan XPS
Dalam rangkaian pengendapan terpisah, sampel untuk analisis SEM dan XPS disiapkan. Setelah pengendapan, sampel dibilas secara menyeluruh dengan dimetil karbonat. SEM emisi medan resolusi sangat tinggi, Hitachi S-4800, digunakan untuk karakterisasi morfologi sampel. XPS dilakukan dengan spektrometer silikon dan germanium Specs (SAGE) (tekanan dasar <1 × 10 −8 mbar) yang dilengkapi dengan penganalisa elektron Phoibos 150 menggunakan radiasi AlKα monokromatik terfokus ( hν = 1486,7 eV). Untuk mencegah paparan udara, setelah persiapan, sampel diangkut ke ruang vakum sangat tinggi (UHV) dengan menggunakan kotak transfer yang tertutup rapat. BE dari semua spektrum yang direkam dinormalisasi menurut puncak tingkat inti C1 s (C C) pada 285,0 eV





Tinggalkan Balasan