Abstrak Grafis
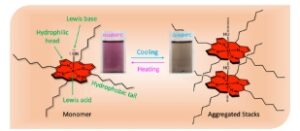
Aluminium(III) porfirin (AlC7P) yang bersifat amfifilik telah dikembangkan, dan sifat fotofisika yang diinduksi agregasi yang bergantung pada suhu telah diteliti. Perubahan fotofisika yang diamati akibat agregasi dalam haxana menjadikan AlC7P kandidat yang cocok untuk termometer molekuler luminescent.
Abstrak
Porfirin aluminium(III) amfifilik (AlC7P) telah dirancang, dan fotofisika yang diinduksi agregasinya telah dilaporkan. Posisi meso dari porfirin aluminium(III) difungsionalkan dengan rantai heptil (C7), sedangkan porfirin sentral memiliki gugus OH aksial pada pusat Al. Sifat hidrofilik ( OH) dan hidrofobik (C7) dikombinasikan dengan fungsionalitas asam Lewis (pusat Al) dan basa Lewis ( gugus OH) untuk memfasilitasi pembentukan agregasi melalui perakitan sendiri. Studi spektroskopi menunjukkan bahwa agregasi dapat dimodulasi oleh pelarut dan suhu; agregasi lebih menonjol dalam pelarut hidrokarbon rantai panjang, seperti heksana dan n -heptana, dan disukai pada suhu yang lebih rendah. Pada kondisi suhu rendah, molekul agregat menunjukkan hasil fluoresensi rendah, sedangkan pada suhu yang lebih tinggi, perakitan sendiri rusak untuk menunjukkan hasil fluoresensi tinggi. Perilaku fotofisika yang diinduksi agregasi bergantung suhu yang diamati dalam heksana menjadikan porfirin ini ideal untuk termometer molekuler luminesensi.
1 Pendahuluan
Termokromisme merujuk pada perubahan warna yang reversibel sebagai respons terhadap pemanasan atau pendinginan. Perubahan warna ini terkait erat dengan sifat optik molekuler, seperti karakteristik penyerapan dan emisi. Termokromisme dapat ditetapkan dengan mengamati bagaimana sifat optik ini bervariasi terhadap suhu. Akibatnya, molekul yang menunjukkan termokromisme berpotensi sebagai termometer molekuler luminescent (LMT). [ 1 – 14 ] LMT menawarkan beberapa keunggulan dibandingkan termometer tradisional. [ 15 ] Mereka merespons dengan cepat, menunjukkan sensitivitas tinggi, dan memberikan resolusi spasial yang lebih besar, yang tidak dapat dicapai oleh banyak teknik termometri lainnya. Lebih jauh lagi, karena LMT dapat digunakan secara nondestruktif di area yang terlalu kecil untuk termometer konvensional, mereka memungkinkan pengukuran suhu dalam situasi yang tidak mungkin. Salah satu contoh penggunaan LMT adalah dalam terapi fototermal (PTT). [ 16 – 18 ] PTT adalah pengobatan antikanker yang melibatkan penggunaan laser untuk memanaskan tumor hingga sedikit di atas 42 °C. Suhu ini cukup untuk menyebabkan kematian sel kanker sambil menjaga jaringan sehat di sekitarnya di bawah suhu yang berbahaya. LMT memberikan umpan balik langsung pada suhu tumor dan jaringan di sekitarnya, yang memungkinkan modulasi daya laser untuk memastikan bahwa hanya sel kanker yang terpengaruh. Selain itu, LMT bermanfaat untuk umpan balik termometri kecepatan tinggi dan resolusi spasial tinggi yang diperlukan dalam sistem mikrofluida. [ 13 ] Dalam perangkat lab-on-a-chip, yang menangani cairan pada skala nano hingga pikoliter, termometer konvensional, bahkan yang terkecil, tidak memadai untuk memantau seluruh sistem secara bersamaan. [ 1 , 19 ] LMT memungkinkan pengukuran suhu cairan yang akurat di seluruh sistem dengan kecepatan dan resolusi tinggi. Contoh-contoh ini menyoroti beragam aplikasi LMT.
Banyak sistem yang mengesankan telah dilaporkan dalam literatur untuk aplikasi dalam penginderaan suhu luminescent (LMT). [ 1 , 5 , 17 ] Beberapa fitur penting untuk probe suhu yang efektif. Di antara ini, sensitivitas optik yang tinggi terhadap suhu dan fotostabilitas yang baik adalah karakteristik yang paling dicari. Dalam konteks ini, berbagai jenis molekul telah dipertimbangkan untuk penginderaan suhu, termasuk pewarna organik, seperti piren, [ 1 ] C 70 , [ 9 ] dan BODIPY, [ 6 ] dan sistem anorganik, seperti kerangka organik uranium (V, VI) valensi campuran, [ 4 ] dan turunan porfirin. [ 2 , 7 , 10 , 20 – 22 ] Porfirin adalah fotosensitizer terkenal yang dikarakterisasi oleh hasil kuantum fluoresensi dan fotostabilitasnya yang tinggi. Sifat strukturalnya dapat dimodifikasi dengan mensubstitusi gugus pada posisi perifer atau dengan menggabungkan elemen yang berbeda ke dalam rongga sentral. [ 23 , 24 ] Karena karakteristik serbaguna ini, porfirin telah digunakan secara luas dalam aplikasi seperti fotosintesis buatan, [ 25 – 29 ] elektronik molekuler, [ 30 , 31 ] fotonik, [ 32 ] sensor molekuler, [ 33 ] dan terapi fotodinamik. [ 34 ] Mengingat keserbagunaannya, masuk akal untuk mempertimbangkan potensi sifat termokromik dalam molekul porfirin. [ 2 , 7 , 10 , 20 – 22 , 35 , 36 ] Faktanya, hal ini telah dieksplorasi menggunakan porfirin fosfor(V), porfirin seng(II) yang diperluas π, dan oktaetilporfirin platinum(II) untuk aplikasi LMT.
Porfirin aluminium (III) sangat menonjol di antara berbagai porfirin karena mereka memiliki situs asam-basa Lewis. [ 37 , 38 ] Pusat aluminium dalam molekul bertindak sebagai asam Lewis. Properti ini telah dimanfaatkan untuk membuat sistem donor-akseptor multikomponen, yang telah didokumentasikan dalam literatur untuk mempelajari proses yang diinduksi foto, termasuk transfer energi dan elektron. [ 39 – 46 ] Lebih jauh, porfirin aluminium(III) telah digunakan untuk mengembangkan tumpukan molekul pada permukaan semikonduktor, polimer 1D, nanoring, dan struktur lainnya. [ 47 – 49 ] Meskipun ada aplikasi ini, potensi penuh porfirin aluminium(III) belum terwujud. Kelompok hidroksi aksial bertindak sebagai basa Lewis potensial (LB) dalam bentuk murninya. Koeksistensi pusat asam Lewis (LA) dan basa dapat memfasilitasi perakitan sendiri; namun, perakitan sendiri ini seringkali cukup tidak stabil untuk memengaruhi sifat optik untuk aplikasi sensor. Salah satu pendekatan untuk meningkatkan stabilitas ini adalah dengan memodifikasi empat posisi meso unit porfirin. Dengan demikian, sifat molekuler yang ditingkatkan dapat dimanfaatkan untuk aplikasi tertentu.
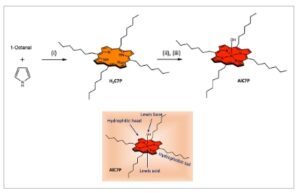
Untuk mencapai tujuan ini, AlC7P disintesis dengan unit heptil hidrofobik (C7) yang terletak di posisi meso (lihat Skema 1 ). Unit heptil berfungsi sebagai ekor nonpolar, sedangkan cincin porfirin pusat, yang mencakup gugus Al OH, bertindak sebagai kepala polar. Gugus OH aksial juga berfungsi sebagai LB, dengan aluminium bertindak sebagai pusat LA. Kombinasi komponen hidrofilik dan hidrofobik menjadikan molekul ini amfifilik. Studi kami menunjukkan bahwa keberadaan unit nonpolar dan polar berkontribusi pada kelarutan AlC7P dalam hampir semua pelarut organik umum, mulai dari heksana nonpolar hingga pelarut polar seperti asetonitril dan CH 3 OH. Sifat amfifilik ini memberi molekul tersebut sifat termokromik yang unik. Yang terpenting, sifat penyerapan dan fluoresensi peka terhadap suhu, menjadikan sistem ini kandidat ideal untuk digunakan sebagai termometer luminescent.
Skema 1
Buka di penampil gambar
Presentasi PowerPoint
Sintesis porfirin aluminium(III) amfifilik yang diteliti AlC7P. Kondisi reaksi : (i) BF 3 .OEt 2 , CH 2 Cl 2 , pengadukan di bawah N 2 untuk (ii) AlMe 3 , Toluena, dan (iii) H 2 O. Sisipan menunjukkan berbagai fungsi dalam AlC7P.
2 Hasil dan Pembahasan
2.1 Sintesis dan Karakterisasi
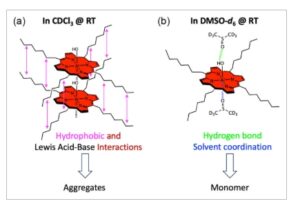
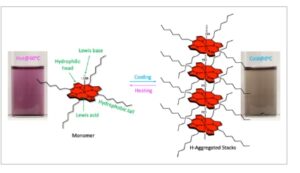
Rincian sintesis dan karakterisasi struktural H 2 C7P dan AlC7P disediakan di bagian eksperimen. Karakterisasi awal senyawa dilakukan menggunakan spektrometri massa ionisasi elektrospray (ESI), seperti yang ditunjukkan pada Gambar S1 dan S2, Informasi Pendukung. Spektrum massa mengungkap puncak ion induk yang menonjol pada 703,5400 untuk H 2 C7P dan 745,5325 untuk AlC7P, yang sesuai dengan massa ( m/z ) dari [M + H] + . Selain itu, spektrum resonansi magnetik proton-nuklir ( 1 H NMR) dari porfirin yang dipelajari ditunjukkan pada Gambar S3–S5, Informasi Pendukung. Dalam spektrum 1 H NMR dari H 2 C7P, baik efek perisai dan deshielding terlihat untuk proton dalam molekul, yang dikaitkan dengan efek arus cincin dari siklus makro porfirin. [ 50 ] Efek serupa diamati dalam spektrum 1 H NMR AlC7P dalam CDCl 3 . Namun, pemeriksaan spektrum yang cermat mengungkapkan set puncak tambahan untuk setiap proton, dan intensitas puncak ini meningkat dengan konsentrasi sampel, seperti yang ditunjukkan pada Gambar S4, Informasi Pendukung. Hasil ini menunjukkan bahwa AlC7P agregat melalui perakitan sendiri dalam larutan. Seperti yang ditunjukkan pada Gambar 1 , agregasi ini didorong oleh dua faktor: (1) interaksi hidrofobik antara rantai C7 dan (2) interaksi asam-basa Lewis. Unit C7 meningkatkan interaksi hidrofobik antara molekul, sementara atom oksigen LB membentuk ikatan koordinasi dengan pusat aluminium LA. Unit meso -heptil dipilih untuk meningkatkan kelarutan AlC7P dalam pelarut nonpolar dan untuk mengurangi jarak intermolekul di antara mereka untuk meningkatkan sifat agregasi. Bersama-sama, interaksi komplementer ini memfasilitasi pembentukan tumpukan agregasi, seperti yang ditunjukkan pada Gambar 1a . Untuk mengonfirmasi interaksi LA-LB, kami mengukur 1 H NMR dalam DMSO- d 6 , yang berfungsi sebagai LB. Tidak adanya set puncak tambahan menunjukkan bahwa AlC7P sebagian besar ada dalam bentuk monomer (Gambar S5, Informasi Pendukung). Hal ini dapat disebabkan oleh molekul DMSO- d 6 yang mengganggu perakitan sendiri dengan membentuk ikatan hidrogen dan koordinasi (Gambar 1b ). Penting untuk dicatat bahwa struktur yang ditunjukkan pada Gambar 1 adalah skenario yang paling mungkin berdasarkan fungsionalitas AlC7P yang tersedia. Selain itu, pada Gambar 1a, rantai heptil digambarkan dalam bentuk gerhana untuk menyorot interaksi van der Waal di antara rantai tersebut, tetapi tidak ada bukti eksperimental yang mengonfirmasinya. Selain itu, studi NMR 1 H yang bergantung pada suhu dilakukan pada suhu 25 dan 50 °C, Gambar S5, Informasi Pendukung. Setelah memanaskan sampel hingga 50 °C, NMR mengungkapkan satu puncak untuk setiap jenis proton. Secara keseluruhan, hasil NMR menunjukkan bahwa agregasi sensitif terhadap pelarut, konsentrasi, dan suhu.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Interaksi nonkovalen yang diusulkan: a) perakitan sendiri dalam pelarut nonkoordinasi dan b) pembentukan monomer dalam pelarut koordinasi AlC7P pada suhu ruangan. Catatan: Jenis tumpukan agregasi yang terhalang dan interaksi pelarut-AlC7P diprediksi berdasarkan fungsionalitas molekuler dan pengamatan spektroskopi.
2.2 Spektroskopi Penyerapan dan Fluoresensi
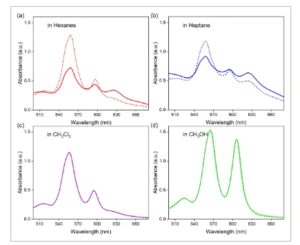
Karakterisasi awal menunjukkan bahwa AlC7P rentan terhadap agregasi melalui perakitan sendiri dalam pelarut yang tidak terkoordinasi. Agregasi ini dapat dicegah menggunakan pelarut terkoordinasi atau dengan meningkatkan suhu. AlC7P dilarutkan dalam berbagai pelarut, termasuk heksana, n – heptana, CH2Cl2 , dan CH3OH , untuk menyelidiki sifat elektronik selama proses agregasi. Spektrum absorbansi dikumpulkan pada suhu kamar dan suhu tinggi. Seperti yang ditunjukkan pada Gambar 2 , perubahan signifikan diamati dalam spektrum serapan AlC7P saat diukur dalam heksana dan n -heptana antara suhu kamar dan suhu 50–55 °C. Pada suhu tinggi, pita serapan pada 559 dan 596 nm tumbuh lebih intens, sedangkan pita serapan sekitar 630 nm berkurang. Perubahan spektral ini menunjukkan agregasi terjadi pada suhu kamar dan terurai pada suhu yang lebih tinggi. Menariknya, perubahan ini tidak diamati dalam CH 2 Cl 2 dan CH 3 OH. Tidak adanya perubahan dalam CH 3 OH diharapkan; sebagai LB, CH 3 OH dapat berkoordinasi dengan pusat aluminium LA, sehingga mencegah pembentukan agregat. Akibatnya, spektrum penyerapan tetap independen suhu dalam kondisi ini. Namun, koordinasi pelarut menggeser spektrum ke panjang gelombang ≈10 nm lebih panjang, sebuah fenomena yang terdokumentasi dengan baik dalam literatur. [ 51 ] Selain itu, agregasi lemah (dibuktikan dengan pita penyerapan lemah sekitar 620 nm) diamati dalam pelarut nonkoordinasi CH 2 Cl 2 , kemungkinan karena pusat klorida LB yang lemah. Secara keseluruhan, studi penyerapan menunjukkan bahwa agregasi signifikan terjadi pada heksana dan n -heptana, agregasi lemah pada CH 2 Cl 2 , dan tidak ada agregasi pada CH 3 OH. Oleh karena itu, CH 2 Cl 2 dipilih untuk studi penyerapan dan fluoresensi kuantitatif. Antara heksana dan n -heptana, heksana menunjukkan sifat termal yang lebih efektif, sehingga menyebabkan pemilihan heksana untuk penelitian lebih lanjut mengenai sifat spektroskopi yang diinduksi agregasi.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Spektrum serapan elektronik AlC7P dalam berbagai pelarut dan pada dua suhu. Garis utuh menunjukkan absorbansi pada suhu kamar (RT), dan garis putus-putus menunjukkan absorbansi pada suhu tinggi. a) heksana (RT hingga 50 °C), b) n -heptana (RT hingga 55 °C), c) CH 2 Cl 2 (RT hingga 40 °C), dan d) CH 3 OH (RT hingga 50 °C).
Spektrum serapan dan fluoresensi kuantitatif AlC7P dalam CH2Cl2 ditunjukkan pada Gambar 3a . Spektrum serapan menunjukkan karakteristik porfirin yang khas, yang menampilkan pita-B yang kuat (pita Soret) pada 417 nm, bersama dengan dua pita-Q yang lebih lemah pada 556 dan 594 nm. Khususnya, ada serapan lemah yang meluas hingga 700 nm, yang tidak khas untuk tetraphenylaluminium(III) porfirin (AlTPP) [ 38 ] atau octaethylaluminum(III) porfirin (AlOEP). [ 52 ] Ini menunjukkan bahwa sebagian sampel mungkin masih teragregasi. Spektrum fluoresensi AlC7P diukur dengan panjang gelombang eksitasi 550 nm (yang sebagian besar mengeksitasi monomer) dan 620 nm (yang secara eksklusif mengeksitasi bentuk agregat). Seperti yang ditunjukkan pada Gambar 3b , eksitasi AlC7P pada 550 nm menghasilkan dua pita emisi pada ≈ 604 dan 660 nm, yang merupakan karakteristik porfirin aluminium(III) yang mengandung tetraarilporfirin. [ 38 ] Sebaliknya, eksitasi pada 620 nm menghasilkan spektrum yang sangat berbeda, yang menampilkan pita pada 638 dan 690 nm, yang diyakini berasal dari bentuk agregat. Hasil ini menunjukkan bahwa AlC7P dalam CH 2 Cl 2 berada dalam kesetimbangan antara bentuk monomer dan agregat.
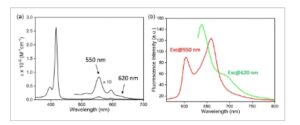
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
a) Penyerapan dan b) spektrum fluoresensi (konsentrasi = 1,74 × 10 −5 M) AlC7P dalam CH 2 Cl 2 pada suhu kamar, 25 °C.
2.3 Studi Termokromik
Agregasi secara signifikan memengaruhi geometri dan struktur elektronik molekul. Perubahan ini dapat diamati dalam sifat optik, karena molekul agregat memiliki struktur elektronik yang sangat berbeda dari monomer yang sesuai. Suhu adalah salah satu faktor eksternal yang dapat digunakan untuk memodulasi agregasi, dan akibatnya, sifat optiknya. Mengamati perubahan warna AlC7P dalam pelarut yang tepat sebagai fungsi suhu adalah salah satu cara paling sederhana untuk menunjukkan termokromik. Gambar 4 menunjukkan sifat termokromik AlC7P dalam heksana. Ketika larutan didinginkan hingga 0 °C, larutan berubah menjadi abu-abu muda, seperti yang ditunjukkan di sisi kanan Gambar 4. Pada suhu ini, diharapkan bahwa AlC7P membentuk keadaan agregat karena interaksi hidrofobik dan interaksi asam-basa Lewis. Ketika suhu dinaikkan hingga 60 °C, larutan berubah menjadi merah muda, seperti yang digambarkan di sisi kiri Gambar 4 . Pada suhu yang lebih tinggi, interaksi antarmolekul antara AlC7P rusak karena molekul berada dalam keadaan kinetik yang tinggi. Hal ini menghasilkan pembentukan AlC7P monomerik, yang menunjukkan warna merah muda khas yang merupakan karakteristik larutan aluminium(III) porfirin.
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Sifat termokromik dan perubahan struktur AlC7P yang sesuai pada es bersuhu 0 °C (kanan) dan pada suhu 6 °C (kiri) dalam heksana. Catatan: Jenis agregasi yang terhalang digunakan untuk meningkatkan kejernihan gambar.
Spektrometer UV-Vis yang dikontrol Peltier digunakan untuk mengumpulkan spektrum absorbansi AlC7P yang bergantung pada suhu dalam heksana. Selama studi optik, larutan ditempatkan dalam kuvet tertutup untuk mempertahankan konsentrasi yang konstan. Pendekatan ini mencegah penguapan heksana pelarut di seluruh percobaan. Studi dilakukan dengan menggunakan konsentrasi pita-Q dan Soret (pita-B) dan ditunjukkan pada Gambar 5 dan S6, Informasi Pendukung, masing-masing. Perubahan spektral termokromik lebih jelas pada pita-Q dibandingkan dengan konsentrasi pita-B karena peningkatan agregasi pada konsentrasi yang lebih tinggi. Ketika suhu dinaikkan dari 5 hingga 55 °C, absorbansi pada 559 nm meningkat dengan faktor 2,6, sedangkan absorbansi pada 625 nm menurun dengan faktor 2,1 (Gambar 5a ). Bentuk sigmoidal kurva ini (Gambar 5b ) menunjukkan transisi dari bentuk teragregasi ke bentuk tidak teragregasi dalam rentang suhu ini. Untuk menilai reversibilitas sifat termokromik AlC7P, absorbansi pada 559 nm (pita Q) diukur saat suhu didaur ulang antara 5 dan 55 °C sebanyak enam kali, seperti yang ditunjukkan di bagian kanan Gambar 5e . Khususnya, tidak ada penurunan yang terlihat pada sifat termokromik selama jumlah siklus yang dilakukan.
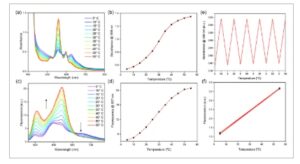
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
a) Absorbansi bergantung-T (@konsentrasi pita-Q (1,42 × 10 −4 M), b) kurva absorbansi versus suhu pada 559 nm, c) spektrum fluoresensi bergantung-T (konsentrasi = 1,42 × 10 −4 M), eksitasi = 576 nm, d) kurva intensitas fluoresensi versus suhu pada 657 nm, dan e,f) kurva reversibilitas. Semua penelitian dilakukan dalam heksana. Selama penelitian ini, larutan ditempatkan dalam kuvet tertutup untuk mempertahankan konsentrasi yang konstan.
Untuk lebih jauh menetapkan agregasi, plot Beer–Lambert dibuat, yang menunjukkan absorbansi versus konsentrasi pada suhu kamar dalam heksana. Spektrum absorbansi diukur pada rentang konsentrasi dari 1,9 × 10 −6 M hingga 1,5 × 10 −4 M. Konsentrasi versus absorbansi diplot pada dua panjang gelombang yang berbeda: 556 dan 624 nm. Hubungan nonlinier yang diamati pada Gambar 6 menunjukkan bahwa agregasi terjadi pada suhu kamar. Pada konsentrasi ≈ 5 × 10 −5 M, kemiringan absorbansi pada 556 nm (puncak monomer) menjadi lebih dangkal, sementara pada konsentrasi yang sama, kemiringan pada 624 nm (puncak agregat) menjadi sedikit lebih curam. Temuan ini memperjelas hasil spektrum absorbansi yang bergantung pada suhu. Untuk pita Soret, konsentrasi AlC7P dalam larutan adalah 4,01 × 10 −6 M, yang lebih rendah dari konsentrasi agregasi pada suhu kamar. Sebaliknya, konsentrasi AlC7P yang digunakan untuk mengukur pita Q adalah 1,42 × 10 −4 M, yang lebih tinggi dari konsentrasi agregasi pada suhu kamar. Hal ini menjelaskan mengapa sifat termokromik tidak terlalu menonjol dalam pengukuran pita Soret dibandingkan dengan pengukuran pita Q.
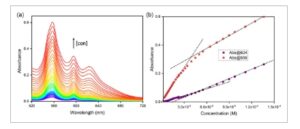
Gambar 6
Buka di penampil gambar
Presentasi PowerPoint
a) Spektrum serapan AlC7P dengan peningkatan konsentrasi dari 1,9 × 10 −6 hingga 1,5 × 10 −4 M dalam heksana. b) Plot Beer–Lambert AlC7P pada 556 dan 624 nm dalam heksana pada suhu kamar, 25 °C.
Studi fluoresensi bergantung-T dilakukan pada AlC7P menggunakan panjang gelombang eksitasi 576 nm, yang sesuai dengan titik isosbestic di wilayah pita-Q dari spektrum serapan. Seperti yang ditunjukkan pada Gambar 5c , pada suhu rendah (5 °C), spektrum fluoresensi menunjukkan puncak pada 603, 640, 657, dan 705 nm. Menurut studi fluoresensi kuantitatif (lihat Gambar 3b ), pita pada 603 dan 657 nm dikaitkan dengan monomer, sedangkan pita pada 640 dan 705 nm dikaitkan dengan bentuk agregat. Saat suhu meningkat, puncak 640 dan 705 nm mulai menghilang, sedangkan puncak pada 603 dan 657 nm tumbuh secara signifikan lebih kuat. Kurva sigmoid intensitas fluoresensi pada 657 nm sebagai fungsi suhu (Gambar 5d ), bersama dengan reproduktifitas intensitas fluoresensi pada 5 dan 55 °C selama enam siklus berulang (Gambar 5f ), menunjukkan kekokohan sistem. Temuan ini selanjutnya mendukung studi penyerapan, yang menunjukkan bahwa AlC7P terutama ada dalam bentuk agregat pada suhu yang lebih rendah, yang rusak saat suhu naik.
Studi optik dapat digunakan untuk mengungkap sifat agregasi. Secara umum, agregasi porfirin dapat terjadi dalam dua jenis: agregasi J dan H. [ 53 – 56 ] Selama proses ini, fitur penyerapan pita Soret berubah secara jelas karena pergeseran biru dan merah akan menghasilkan agregasi H dan J, masing-masing. Fakta bahwa pita 400 nm meningkat dengan meningkatnya konsentrasi atau menurun dengan meningkatnya suhu menunjukkan penyelarasan ‘tatap muka’ agregasi H terlibat dalam studi ini (Gambar S6, Informasi Pendukung).
Studi optik menunjukkan bahwa struktur molekul dan elektronik sangat berbeda pada kondisi suhu/konsentrasi rendah dan tinggi. Agregat memiliki absorbansi yang berbeda dari monomer, yang memberikan larutan sifat termokromiknya. Untuk lebih menjelaskan geometri dan struktur elektronik AlC7P, perhitungan teori fungsi kerapatan (DFT) dilakukan. Gambar 7 menunjukkan struktur yang dioptimalkan pada permukaan energi potensial Born–Oppenheimer dari serangkaian tumpukan agregat H yang dihitung menggunakan fungsional B3LYP dan basis set 6-311 G(d, p) sebagaimana diparameterisasi dalam Gaussian 16. [ 57 ] Rincian DFT tambahan dan koordinat atom yang dioptimalkan (Tabel S2, Informasi Pendukung) diberikan dalam informasi pendukung. Dua cincin porfirin disusun saling berhadapan, dengan empat gugus heptil pada setiap porfirin yang memanjang ke luar secara bertahap untuk mengurangi tolakan sterik. Pusat aluminium terletak pada bidang porfirin. Ketika menganalisis monomer AlC7P, diamati bahwa orbital molekul yang paling tinggi terisi (HOMO) dan orbital molekul yang paling rendah tidak terisi (LUMO) terlokalisasi pada cincin porfirin, dengan estimasi celah HOMO–LUMO sebesar 2,74 eV. Sebaliknya, dimer bertumpuk menunjukkan celah HOMO–LUMO sebesar 2,02 eV, yang 0,72 eV lebih rendah daripada celah monomer. Dalam dimer ini, porfirin yang mengandung LB bebas ( gugus OH) berfungsi sebagai HOMO, sedangkan porfirin dengan LA bebas (pusat aluminium) berfungsi sebagai LUMO. Perilaku ini konsisten di semua ukuran tumpukan yang dihitung, meluas hingga enam unit AlC7P dalam tumpukan terbesar yang diperiksa dalam penelitian ini.

Gambar 7
Buka di penampil gambar
Presentasi PowerPoint
DFT menghitung orbital batas (HOMO dan LUMO) dari serangkaian tumpukan agregat H.
Peta potensial elektrostatik (ESP) dihitung untuk tumpukan agregat tipe-H ini, lihat Gambar 8. Menariknya, dipol dihasilkan dalam tumpukan karena disparitas elektron: sisi dengan LB bebas (unit hidroksi) menjadi lebih kaya elektron, sedangkan sisi dengan LA bebas (pusat Al) menjadi lebih miskin elektron. Distribusi muatan yang tidak merata ini meningkat seiring dengan meningkatnya jumlah unit AlC7P dalam agregat. Salah satu konsekuensi signifikan dari dipol ini adalah dampaknya pada sifat transfer muatan. Fitur spektral yang diamati pada konsentrasi tinggi atau suhu rendah dalam studi penyerapan dan fluoresensi kemungkinan muncul dari transisi transfer muatan, yang melibatkan pergerakan kerapatan elektron dari bagian tumpukan yang kaya elektron ke bagian tumpukan yang miskin elektron. Fitur penyerapan panjang gelombang panjang pada suhu tinggi atau rendah dapat dihasilkan dari transisi transfer muatan ini. Demikian pula, fitur fluoresensi panjang gelombang panjang dan intensitasnya yang berkurang juga dapat dikaitkan dengan sifat transfer muatan dalam agregat.

Gambar 8
Buka di penampil gambar
Presentasi PowerPoint
DFT menghitung peta ESP dari serangkaian tumpukan agregat H. Warna merah dan biru masing-masing menunjukkan daerah yang kaya dan miskin elektron.
Studi fluoresensi beresolusi waktu dari AlC7Por dilakukan dalam heksana, dengan suhu dan konsentrasi yang bervariasi. Sampel tereksitasi pada 560 nm, dan emisi terekam pada pita fluoresensi energi tinggi 655 nm. Gambar S7, Informasi Pendukung, mengilustrasikan profil peluruhan fluoresensi, dan data tentang waktu hidup keadaan singlet tereksitasi dirangkum dalam Tabel S1, Informasi Pendukung. Untuk tujuan pembahasan, kami mempertimbangkan nilai rata-rata. Waktu hidup fluoresensi AlC7P tetap konsisten pada ≈5,50 ns di berbagai suhu dan konsentrasi. Temuan ini menunjukkan bahwa senyawa agregat itu gelap dan tidak berfluoresensi; dengan demikian, waktu hidup yang diamati semata-mata dikaitkan dengan monomer yang ada bebas, yang berada dalam kesetimbangan dengan spesies agregat. Menurut model Kasha, sifat emisif agregat H dipengaruhi oleh transisi yang diizinkan dan dilarang oleh spin. [ 58 – 61 ] Pada dimer tipe H dengan penyelarasan ‘berhadapan muka’, peluruhan radiatif ditekan karena transisi tersebut dilarang simetri, sehingga agregat menjadi tidak memancarkan.
3 Metode Fisika
3.1 NMR dan Spektroskopi Massa
Spektrum NMR direkam pada spektrometer NMR Bruker Advance 400 MHz menggunakan CDCl3 atau DMSO -d6 sebagai pelarut . Spektrum massa ESI direkam pada spektrometer massa Bruker MicroTOF-III menggunakan injeksi langsung dari kolom cairan berkinerja tinggi UltiMate 3000 dan CH3CN sebagai pelarut.
3.2 Spektroskopi Penyerapan dan Emisi
Spektrum UV/Vis direkam menggunakan spektrometer UV/Vis Agilent Cary 100. Studi penyerapan suhu variabel dilakukan dengan Spektrofotometer UV–Vis Varian Cary 50, yang dilengkapi dengan Aksesori Peltier Sel Tunggal Agilent Cary. Untuk mencegah penguapan pelarut dan mempertahankan konsentrasi konstan selama pengukuran, kuvet sampel disegel, dan suhunya divariasikan dari 5 hingga 55 °C. Spektrum fluoresensi keadaan stabil ditangkap menggunakan spektrofluorometer Photon Technologies International Quanta Master 8075-11, yang dilengkapi lampu Xenon 75 W dan beroperasi dengan perangkat lunak FelixGX. Panjang gelombang eksitasi 576 nm dipilih sebagai titik isosbestic di wilayah pita-Q dari spektrum penyerapan. Selain itu, Spektrofotometer Fluoresensi Eclipse Varian Cary dengan Aksesori Peltier Sel Tunggal Varian Cary digunakan untuk spektrum yang bergantung pada suhu. Lebar celah eksitasi dan emisi ditetapkan masing-masing sebesar 2,5 dan 5,0 nm. Sekali lagi, untuk mencegah penguapan pelarut dan mempertahankan konsentrasi yang konsisten, suhu divariasikan dari 5 hingga 55 °C, dan kuvet sampel disegel. Untuk meningkatkan kejelasan hasil dan mengurangi rasio sinyal terhadap derau, spektrum emisi pada setiap suhu dihitung sebagai rata-rata dari lima pemindaian.
3.3 Perhitungan DFT
Semua struktur aluminium(III) porfirin amfifilik awalnya dibangun pada PC lokal menggunakan perangkat lunak GaussView 6 (GV6.0). Perhitungan DFT dilakukan pada superkomputer menggunakan rangkaian perangkat lunak Gaussian 16. [ 57 ] B3LYP adalah metode DFT yang dipilih untuk penelitian ini. Set basis terpolarisasi valensi terbagi 6-31 G(d,p) digunakan untuk memodelkan senyawa. Dengan demikian, metode B3LYP digabungkan dengan basis 6-31 G(d,p) untuk membentuk model kimia B3LYP/6-31 G(d,p) yang digunakan untuk mengoptimalkan geometri semua struktur di sini ke titik stasioner pada permukaan Born–Oppenheimer dan menghitung lima keadaan singlet tereksitasi pertama dari semua spesies kimia dalam penelitian saat ini. Semua struktur dioptimalkan tanpa kendala simetri sebagai singlet kulit tertutup yang netral. Kendala konvergensi medan yang konsisten dan grid DFT yang digunakan dalam perhitungan adalah nilai default G16, yaitu “Tight” dan “UltraFine”. Optimalisasi parameter geometrik masing-masing spesies kimia dalam penelitian dilanjutkan hingga gaya maksimum, gaya root-mean square (RMS), perpindahan maksimum, dan perpindahan RMS mencapai atau kurang dari minimum Gaussian 16 default dan perubahan energi yang diprediksi pada siklus optimalisasi parameter geometrik berturut-turut berada dalam kisaran −5×10 −9 AU
3.4 Spektroskopi Fluoresensi Terselesaikan Waktu
Peralatan penghitung foton tunggal berkorelasi waktu yang memanfaatkan laser dioda berdenyut pikodetik digunakan untuk mengukur peluruhan fluoresensi porfirin. Pulsa eksitasi dikirimkan pada 560 nm oleh laser dioda pikodetik (PicoQuant, PDL 800-B), 54 ps FWHM, pada laju pengulangan 10 MHz. Fluoresensi porfirin diukur oleh pelat pengganda foton mikro Hamamatsu R3809 yang disaring oleh monokromator ganda. Kartu PC penghitung foton tunggal (Becker & Hickl, SPC-730) digunakan untuk pengumpulan data. Waktu respons instrumen sistem adalah 80 ps.
4 Kesimpulan
Sifat termokromik telah diinduksi secara efektif dalam aluminium(III) porfirin dengan memanfaatkan interaksi asam-basa Lewis dan karakteristik hidrofobik. Pengenalan rantai C7 hidrofobik meningkatkan kelarutan aluminium(III) porfirin dan memungkinkan perilaku termokromiknya. Ketika ditempatkan dalam pelarut nonpolar, AlC7P menunjukkan sifat termokromik karena agregasi porfirin pada suhu yang lebih rendah, yang terpisah menjadi monomer ketika dipanaskan. Transisi ini terutama terjadi dalam kisaran suhu 5 hingga 55 °C. Pergeseran warna yang nyata terjadi saat suhu berubah, disertai dengan pemadaman fluoresensi pada suhu yang lebih rendah. Karakteristik ini menunjukkan bahwa AlC7P memiliki potensi yang menjanjikan sebagai LMT.
Bagian Eksperimen
Umum
Bahan kimia dan pelarut diperoleh dari Alfa Aesar, Acros Organics, Fisher Chemical, Sigma-Aldrich, dan Tokyo Chemical Industry (TCI). Bahan kromatografi diperoleh dari Sigma-Aldrich atau SiliCycle. 5,10,15,20-tetraheptylporphyrin (H 2 C7P) dan turunan Al(III) 5,10,15,20-tetraheptylaminum(III) porphyrin (AlC7P) disiapkan seperti yang dijelaskan di bawah ini.
Sintesis 5,10,15,20-Tetraheptylporphyrin (H 2 C7P)
Campuran reaksi disiapkan dengan melarutkan pirol (1,88 g, 1,94 mL, 28,0 mmol) dan oktanal (3,60 g, 4,38 mL, 28,0 mmol) dalam CH2Cl2 kering ( 750 mL ) . Labu dibilas dengan N2 selama 1 jam, dan BF3.Et2O ( 0,07 g, 0,08 mL, 0,49 mmol) ditambahkan, mengubah larutan menjadi merah. Reaksi diaduk pada suhu kamar dalam gelap selama 2 jam. p – Kloranil (6,88 g, 28,0 mmol) ditambahkan ke larutan di bawah aliran N2 . Larutan diaduk pada suhu kamar selama 12 jam tambahan , mengubah larutan menjadi warna gelap. Larutan disaring vakum untuk menghilangkan kotoran padat dan dipekatkan di bawah tekanan rendah. Produk dimurnikan pada kolom Al2O3 pendek . Kolom dielusi dengan CH2Cl2 : heksana (50:50). Pemurnian ini diulang pada kolom Al2O3 lainnya . Senyawa murni yang terkumpul adalah padatan berwarna ungu. Hasil: 425 mg (9%). ESI MS: m / z 703,5400 untuk [M + H ] + , dihitung 703,5674 untuk C48H71N4 + . 1 H NMR (400 MHz, CDCl 3 ): δ, ppm 9,47 (s, 8 H), 4,94 (t, 8 H, J = 7,92 Hz), 2,52 (q, 8 H, J = 7,68 Hz), 1,81 (q, 8 H, J = 7,48 Hz), 1,54 (q, 8 H, J = 6,72 Hz), 1,37 (m, 8 H), 1,26 (bm, 8 H), 0,91 (m, 12 H), dan −2,63 (s, 2 H).
Sintesis 5,10,15,20-tetraheptilaluminium(III) porfirin (AlC7P)
Larutan H 2 C7P (55 mg, 0,074 mmol) dalam 5 mL toluena kering disiapkan, dan trimetilaluminium (0,2 mL, 2,0 M dalam heksana) ditambahkan di bawah atmosfer N 2 . Larutan diaduk di bawah kain gelap pada suhu kamar selama 19 jam. Sekitar 1 mL air kemudian ditambahkan tetes demi tetes, dan larutan diaduk pada suhu kamar selama 22 jam tambahan. Toluena dihilangkan di bawah tekanan rendah, dan senyawa dimurnikan menggunakan kolom Al 2 O 3 dengan eluen CH 2 Cl 2 : CH 3 OH (= 98:2). Senyawa murni dikumpulkan sebagai padatan hijau tua. Hasil: 53 mg (91%). ESI MS: m/z 745,5325 untuk [M + H] + , dihitung 745,5365 untuk C 48 H 70 AlN 4 O + . 1 H NMR (400 MHz, CDCl 3 @ 50 °C): δ, ppm 9,50 (s, 8 H), 4,72 (m, 8 H), 2,39 (m, 8 H), 1,62 (m, 8 H), 1,39 (m, 8 H), 1,25 (m, 8 H), dan 0,83 (m, 20 H). Spektrum 1 H NMR senyawa ini mengandung dua set puncak, satu untuk senyawa teragregasi dan satu untuk senyawa yang tidak teragregasi. Hal ini membuat interpretasi NMR menjadi sulit, karena beberapa puncak tidak jelas.





Tinggalkan Balasan