Abstrak
Untuk menyaring parameter bioproses yang optimal pada throughput yang lebih tinggi, para peneliti yang mengembangkan biofarmasi baru semakin beralih ke sistem kultivasi miniatur dengan konsumsi ruang dan media yang berkurang. Namun, sistem ini masih menghadapi tantangan terkait dengan pemantauan berkelanjutan parameter bioproses kritis, khususnya, karena integrasi sensor seringkali sulit, dan volume sampel untuk pengukuran offline terbatas. Dalam karya ini, platform sensor lab-on-a-chip mikrofluida cetak 3D yang baru disajikan, yang secara khusus dirancang agar kompatibel dengan berbagai sistem kultivasi (termasuk labu kocok, bioreaktor, dan mikrobioreaktor khusus). Sistem mikrofluida bertindak sebagai bypass miniatur, mengintegrasikan sensor untuk pemantauan real-time parameter bioproses utama (seperti pH, pO₂, pCO₂, glukosa, dan laktat) tanpa mengorbankan volume kultur. Sistem ini telah berhasil diterapkan dalam bukti konsep untuk kultivasi Escherichia coli dan Saccharomyces cerevisiae . Selain itu, platform ini juga mencakup unit pengambilan sampel terpadu untuk pengumpulan volume kecil, sehingga berpotensi memungkinkan analisis campuran analit kompleks seperti asam amino atau protein rekombinan. Dengan demikian, sistem yang disajikan merupakan alat yang berharga untuk pemantauan daring dan analisis luring secara real-time, yang berkontribusi pada optimalisasi proses produksi biofarmasi.
1 Pendahuluan
Pengembangan biofarmasi baru merupakan usaha yang panjang dan mahal, di mana penemuan dan penelitian praklinis diikuti oleh uji klinis selama bertahun-tahun–menghasilkan biaya rata-rata lebih dari $2 miliar untuk membawa obat ke pasar. [ 1 , 2 ] Akibatnya, penelitian di bidang ini semakin berfokus pada sistem kultivasi miniatur yang memungkinkan paralelisasi, yang memungkinkan peneliti untuk menyaring dan mengoptimalkan beberapa parameter (misalnya, galur, komposisi medium) pada throughput tinggi secara bersamaan sebelum meningkatkan proses untuk produksi biofarmasi. [ 3 ] Pendekatan ini berpotensi untuk secara substansial mengurangi biaya yang sangat besar dan penundaan waktu yang lama yang terkait dengan pengembangan biofarmasi baru. [ 3 ]
Namun, sistem kultivasi miniaturisasi bukannya tanpa tantangan. Salah satu masalahnya adalah memastikan analisis berkelanjutan dari parameter spesifik proses yang penting seperti glukosa, pH, pO 2 , dan/atau pCO 2 . Misalnya, pelat mikrotiter yang memungkinkan throughput tinggi pada volume rendah [ 4 ] memerlukan pengukuran atline karena integrasi probe online sangat menantang. Karena analisis atline dilakukan dengan cara yang terputus dari proses, [ 5 ] prosedur pengambilan sampel diperlukan–yang mengakibatkan pengurangan volume kultur. Ini adalah kelemahan utama mengingat volume kecil (0,2–10 mL) dari sistem kultivasi berbasis pelat mikrotiter, [ 6 ] yang mengakibatkan interval pengambilan sampel yang panjang dan dengan demikian menghambat pemantauan parameter proses yang berkelanjutan. Oleh karena itu, penelitian semakin diarahkan pada pengembangan mikrobioreaktor (0,1–20 mL) dengan sensor terintegrasi untuk pemantauan bioproses online dengan waktu respons yang singkat, [ 7 – 9 ] sebuah fitur yang penting untuk pemahaman dan pengoptimalan proses. Khususnya, pencetakan 3D telah muncul sebagai teknik penting untuk fabrikasi mikrobioreaktor tersebut, karena (karena kemampuan pembuatan prototipe yang cepat) sistem ini dapat secara fleksibel diadaptasi untuk menampung berbagai jenis sensor. [ 7 , 10 , 11 ] Misalnya, Frey et al. [ 12 ] dan Panjan et al. [ 13 ] keduanya membuat mikrobioreaktor cetak 3D yang memungkinkan pemantauan bioproses daring terhadap parameter penting (seperti pH, glukosa, dan gas terlarut) selama budidaya ragi Saccharomyces cerevisiae ( S. cerevisiae ). Namun, bahkan dalam sistem ini, peneliti masih terbatas dalam jumlah parameter yang dapat dianalisis karena tidak semua sensor atau pengujian daring kompatibel dengan sistem miniaturisasi dan mikrofluida (karena ukuran, prinsip, atau desainnya).
Dalam karya ini, kami telah mengembangkan platform sensor mikrofluida lab-on-a-chip (LOC) cetak-3D baru yang terbuat dari bahan poliakrilat yang biokompatibel. [ 14 ] Perangkat ini dapat dihubungkan ke berbagai sistem kultivasi dan bertindak sebagai sistem bypass mini yang di dalamnya terintegrasi berbagai sensor. Hal ini memungkinkan dan memfasilitasi pemantauan bioproses daring terhadap parameter-parameter utama (pH, pO 2 , pCO 2 , glukosa, laktat) selama proses kultivasi sel mikroba dan mamalia. Untuk mengatasi keterbatasan sensor daring yang ada dalam hal jumlah parameter yang dapat dianalisis, unit pengambilan sampel tambahan telah diintegrasikan untuk memungkinkan pengambilan sampel volume kecil. Unit ini–dikombinasikan dengan sistem analisis seperti kromatografi cair mini-spektrometri massa (µLC-MS)–memiliki potensi untuk berguna dalam analisis campuran yang lebih kompleks seperti asam amino atau protein rekombinan (misalnya, antibodi).
2 Hasil
2.1 Desain dan Prinsip Pengoperasian Platform Sensor LOC Mikrofluida
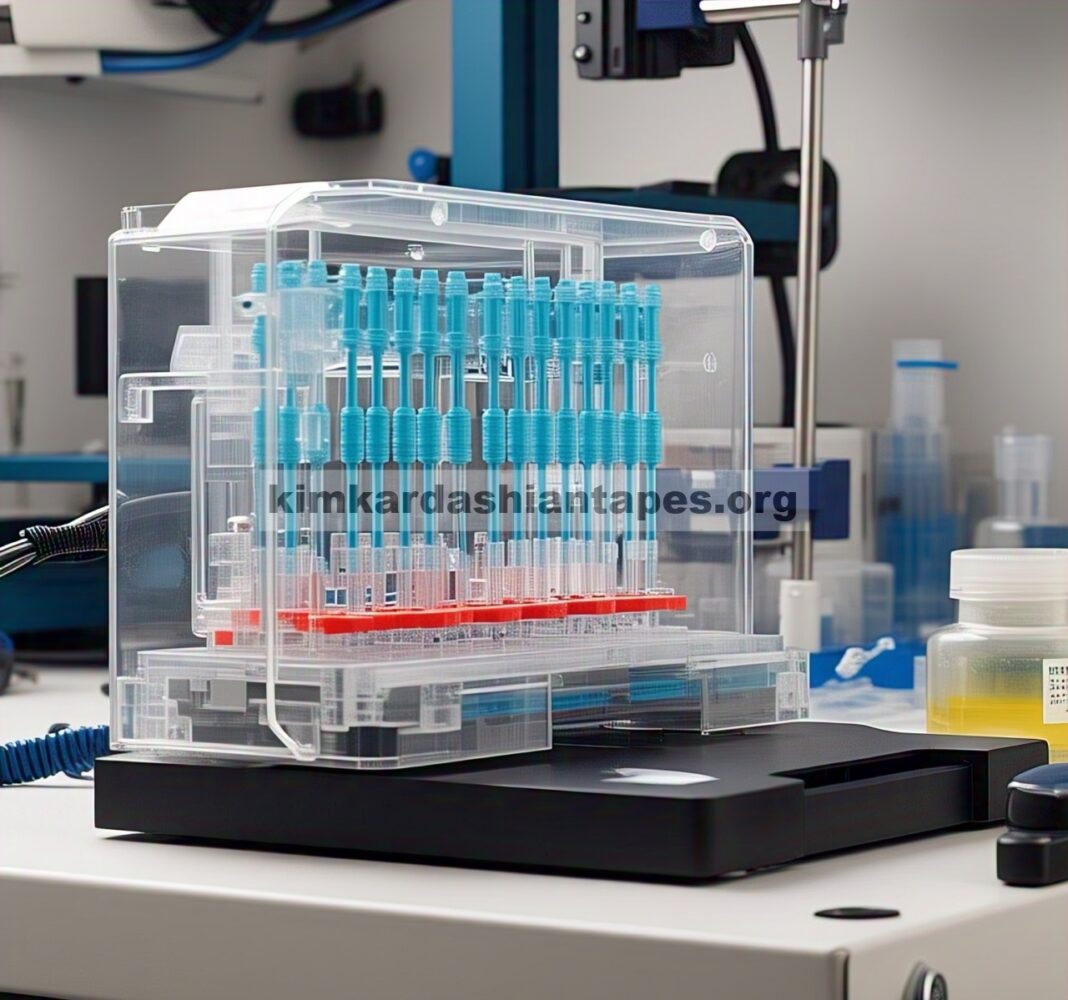
Representasi grafis dari platform sensor LOC mikrofluida cetak-3D, termasuk semua unit fungsionalnya, ditunjukkan pada Gambar 1. Perangkat mikrofluida bertindak sebagai bypass, dengan saluran masuk dan keluarnya terhubung ke bejana kultivasi (misalnya, labu goyang) melalui pipa (Gambar 1A ), dan medium dimasukkan ke dalam platform dengan menggunakan pompa peristaltik. Unit pertama (Gambar 1B ) digunakan untuk analisis gas dan pH dan berisi colokan sensor yang tersedia secara komersial untuk parameter utama (yaitu, dO2 , dCO2 , pH). Pada dasarnya, colokan sensor ini terdiri dari matriks polimer yang berisi pewarna indikator fluoresensi yang berfluoresensi setelah eksitasi oleh LED. Fluorofor adalah indikator yang peka terhadap analit di mana sinyal fluoresensi ditekan oleh molekul analit masing-masing yang ada dalam cairan di sekitarnya. [ 15 ]
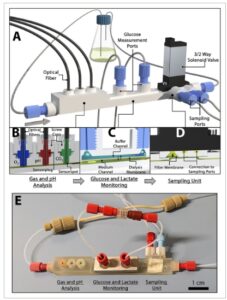
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Ilustrasi platform sensor mikrofluida. A) Gambar render platform sensor dan sisipan B) unit analisis pH dan gas dengan colokan sensor terintegrasi, C) unit untuk penginderaan glukosa dan laktat, dan D) unit pengambilan sampel. E) Foto sistem termasuk konektor dan tabung.
Analit-analit kunci ini perlu dipantau selama proses kultivasi karena perubahan pH dan kadar O 2 merupakan indikasi pertumbuhan (tetapi juga dapat memengaruhi laju pertumbuhan dan biosintesis protein). [ 16 ] CO 2 , sebagai bagian dari sistem penyangga dan sebagai produk respirasi, sangat memengaruhi pertumbuhan sel, keadaan metabolisme, dan pembentukan produk dalam sel mamalia seperti sel Ovarium Hamster Cina (CHO). [ 17 , 18 ] Masing-masing colokan sensor dikirimkan secara steril dan kemudian diintegrasikan ke dalam platform mikrofluida yang disterilkan dengan uap panas dalam kondisi steril menggunakan tutup ulir cetak 3D. Selanjutnya, serat optik dihubungkan ke colokan sensor terintegrasi dan mentransfer sinyal yang dihasilkan secara optik ke sistem pemantauan yang sesuai untuk analisis pH dan gas daring.
Berbeda dengan karya kami sebelumnya, [ 19 , 20 ] di mana dimensi saluran tipikal 0,5 × 0,5 mm (lebar × tinggi) memungkinkan fabrikasi struktur internal kompleks pada volume mati yang diminimalkan dan tanpa tekanan balik yang berlebihan, dimensi saluran untuk unit penginderaan ini ditingkatkan menjadi lebar 3 mm dan tinggi 1,5 mm. Penyesuaian ini diperlukan untuk memungkinkan integrasi colokan sensor (dimensi saluran yang lebih lebar) dan untuk mengurangi risiko terperangkapnya gelembung udara pada colokan sensor terintegrasi (ketinggian saluran yang meningkat), yang dapat mengganggu proses pengukuran. Lihat juga Gambar S1 (Informasi Pendukung) yang menggambarkan representasi grafis dari masing-masing unit penginderaan.
Unit analisis kedua (lihat Gambar 1C ) berisi membran dialisis dan konektor ke sistem biosensor TRACE C2 yang tersedia secara komersial untuk pemantauan glukosa dan laktat daring. Sementara glukosa merupakan sumber karbon penting selama proses kultivasi, [ 21 , 22 ] laktat merupakan atribut kualitas kritis selama kultivasi sel mamalia karena merupakan produk glikolisis anaerobik dan indikator status metabolisme seluler. [ 23 ] Dalam platform sensor mikrofluida, unit analisis glukosa dan laktat terdiri dari struktur dasar dan tutup yang membentuk dua saluran individual yang dipisahkan oleh membran dialisis terintegrasi. Silakan lihat Gambar S2 (Informasi Pendukung) untuk representasi desain berbantuan komputer (CAD) grafis dari unit analisis glukosa dan laktat ini, yang mengilustrasikan dua bagian sistem ini.
Saluran bawah berisi medium kultur sel dengan glukosa dan laktat yang keduanya berdifusi melalui membran dialisis terintegrasi ke saluran atas yang berisi larutan penyangga transpor. Selanjutnya, penyangga ditransfer ke biosensor laktat dan glukosa elektrokimia dari sistem TRACE. Biosensor ini terdiri dari elektroda lapisan tebal platinum, dilapisi dengan enzim yang sesuai (glukosa oksidase atau laktat oksidase) yang mengubah educt menjadi glukonolakton dan piruvat, masing-masing. Dalam kedua reaksi, H 2 O 2 terbentuk yang kemudian dapat dideteksi secara amperometrik. [ 24 ] Dimensi saluran dirancang untuk mengakomodasi membran dialisis yang disediakan dengan sistem biosensor komersial. Dengan demikian, panjang dan lebar saluran atas dan bawah masing-masing berukuran 25 dan 3 mm.
Akhirnya, unit ketiga (lihat Gambar 1D ) memungkinkan pengambilan sampel volume kecil dengan menggunakan membran filter, katup magnetik, dan pembuangan volume yang ditentukan berbasis pompa suntik. Unit pengambilan sampel juga terdiri dari struktur dasar dan tutup yang dirakit dan dipisahkan oleh membran filter 0,2 µm yang memungkinkan penarikan volume sampel bebas sel kecil untuk analisis senyawa (misalnya, asam amino atau antibodi rekombinan) di mana tidak ada sensor daring yang tersedia. Kedua bagian ini dirancang untuk mengoptimalkan proses pengambilan sampel sebagai berikut: Bagian dasar membuat saluran dengan lebar 7 mm, panjang 10 mm (70 mm 2 ), dan tinggi minimal 0,2 mm. Dengan demikian, dimensi ini memastikan volume sampel yang cukup dapat ditarik melalui membran filter. Tutupnya memiliki saluran memancar yang mengarahkan cairan dari seluruh membran filter menuju struktur corong dengan diameter 1,5 mm. Corong ini kemudian mentransfer volume ke port pengambilan sampel melalui katup magnetik yang terpasang pada unit pengambilan sampel. Representasi CAD grafis dan gambar teknis yang merinci dimensi unit ini ditunjukkan pada Gambar S3 dan S4 (Informasi Pendukung). Uraian terperinci tentang prosedur pemompaan dan pengambilan sampel disertakan dalam Bagian 2.3 dan Gambar S5 (Informasi Pendukung).
Foto platform sensor yang telah dirakit, termasuk batang skala (Gambar 1E ), menunjukkan ukuran kecil keseluruhan sistem (volume internal: 266 µL).
2.2 Budidaya dan Pemantauan Bioproses
Untuk percobaan kultivasi, platform sensor LOC mikrofluida dihubungkan melalui pipa ke kultivasi labu goyang sel Escherichia coli (E. coli) , S. cerevisiae , atau CHO dalam kondisi steril, dan kemudian pompa peristaltik digunakan untuk memindahkan kaldu kultur melalui platform sensor mikrofluida dan kembali ke labu goyang. Labu ini berisi port pengambilan sampel tambahan yang cocok untuk pengukuran referensi offline glukosa, pH, dan densitas optik (OD 600 ). Yang penting, seluruh pengaturan eksperimen–termasuk labu goyang, pompa peristaltik, dan platform sensor–dirancang untuk diintegrasikan ke dalam inkubator untuk mencapai suhu dan kondisi CO 2 yang optimal (lihat Gambar S6 , Informasi Pendukung untuk pengaturan eksperimen dan sambungan tabung pada tutup labu goyang). Gambar 2 dan 3 menunjukkan percobaan kultur labu goyang untuk dua mikroorganisme berbeda, yaitu spesies bakteri E. coli (Gambar 2A ) dan ragi S. cerevisiae (Gambar 3A ), yang banyak digunakan dalam penelitian bioteknologi untuk produksi protein rekombinan atau berbagai biofarmasi.
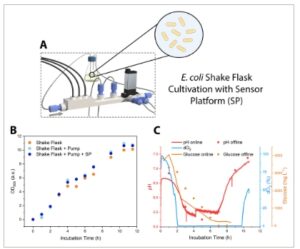
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Aplikasi platform sensor LOC mikrofluida untuk A) pemantauan bioproses dari kultivasi tabung goyang dengan E. coli. B) Kurva pertumbuhan (OD 600 ) untuk tiga pengaturan kultivasi yang berbeda: hanya tabung goyang, tabung goyang + pemompaan dengan pompa peristaltik, dan kultivasi dengan platform sensor (SP) yang terhubung ke tabung goyang dan penggunaan pompa peristaltik. C) Pemantauan bioproses pH, dO 2 , dan glukosa menggunakan platform sensor mikrofluida.
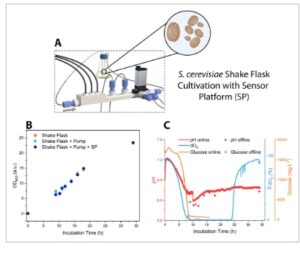
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Aplikasi platform sensor LOC mikrofluida untuk A) pemantauan bioproses kultivasi labu goyang dengan S. cerevisiae. B) Kurva pertumbuhan (OD 600 ) untuk tiga pengaturan kultivasi yang berbeda: hanya labu goyang, labu goyang + pemompaan dengan pompa peristaltik, kultivasi dengan platform sensor (SP) yang terhubung ke labu goyang, dan penggunaan pompa peristaltik. C) Pemantauan bioproses pH, dO 2 , dan glukosa menggunakan platform sensor mikrofluida.
Efek dari platform sensor dan prosedur pemompaan terkait pada viabilitas sel selama kultivasi pertama kali diuji untuk E. coli . OD 600 dipantau melalui pengukuran offline dan dibandingkan antara tiga pengaturan kultivasi: hanya mengocok labu, mengocok labu dan memompa melalui tabung, dan kultivasi mengocok labu dengan platform sensor yang terhubung. Seperti yang ditunjukkan pada Gambar 2B , baik proses pemompaan maupun aliran melalui platform sensor tidak mengganggu viabilitas sel E. coli selama kultivasi 12 jam, dan perilaku pertumbuhan ditemukan sangat mirip di ketiga pengaturan.
Pemantauan bioproses yang sesuai menggunakan platform sensor mikrofluida untuk tiga parameter dO2 , pH, dan glukosa digambarkan dalam Gambar 2C . Diamati bahwa kadar oksigen menurun dengan cepat (karena digunakan oleh sel bakteri untuk respirasi aerobik) dan telah habis dalam waktu 2 jam setelah kultivasi labu goyang, yang menunjukkan bahwa pasokan oksigen merupakan faktor pembatas selama proses kultivasi ini. Setelah ≈10 jam, kadar oksigen meningkat karena penurunan pertumbuhan sel dan kebutuhan oksigen. Selain itu, kadar glukosa menurun, dan glukosa habis dalam waktu 7–8 jam–di mana pada titik itu pemantauan sumber karbon ini dihentikan. Demikian pula, pH menurun selama kultivasi ini, karena E. coli menghasilkan lebih banyak metabolit asam (asam fermentasi) seperti asetat, laktat, dan lainnya. [ 26 , 27 ] Peningkatan pH secara tiba-tiba setelah ≈4 jam disebabkan oleh protokol kultivasi di mana suhu inkubasi diturunkan dari 37 menjadi 20 °C untuk produksi protein yang lebih baik dan pertumbuhan sel yang lebih sedikit. Setelah glukosa habis (≈7 jam), pH meningkat lebih lanjut karena metabolisme asam amino dan pembentukan amonia. [ 28 ]
Secara umum, pengukuran pH offline sesuai dengan nilai yang ditentukan dengan platform sensor, dan perbedaan kecil kemungkinan terjadi karena penundaan pengukuran untuk sampel offline, di mana metabolisme sel mungkin masih mengubah nilai pH.
Nilai glukosa referensi offline yang diukur oleh Roche CEDEX Bio yang tersedia secara komersial cenderung lebih tinggi daripada nilai glukosa yang ditentukan oleh sistem biosensor TRACE daring dan dengan demikian, perbedaan ini tidak dapat dijelaskan oleh penundaan pengukuran.
Untuk memastikan bahwa sistem cetak 3D tidak membahayakan keakuratan pengukuran glukosa daring, sistem tersebut dikalibrasi terlebih dahulu menggunakan larutan penyangga yang disediakan oleh produsen. Selanjutnya, glukosa dicampurkan pada konsentrasi yang ditentukan ke dalam larutan penyangga fosfat (PBS) dan diukur secara kuantitatif. Seperti yang ditunjukkan pada Gambar S7 (Informasi Pendukung), glukosa dapat diukur secara akurat dalam larutan yang ditentukan ini setelah kalibrasi sistem. Oleh karena itu, penyimpangan yang diamati antara pengukuran glukosa daring dan luring selama proses kultivasi bukan disebabkan oleh integrasi sensor ke dalam sistem cetak 3D, yang merupakan fokus utama penelitian ini.
Untuk lebih meningkatkan akurasi, validasi tambahan harus dilakukan dalam kondisi kultivasi aktual, karena komposisi media pertumbuhan akan berbeda dari buffer kalibrasi dalam beberapa aspek termasuk konsentrasi garam, kapasitas antioksidan, atau keberadaan agregat protein terlarut. Faktor-faktor ini bahkan dapat berubah selama kultivasi. Misalnya, agregat protein terlarut atau protein besar–yang dapat hadir dalam kaldu kultur sampel–menyebarkan cahaya dan menyebabkan peningkatan sinyal absorbansi, terutama pada panjang gelombang di wilayah spektral UV. [ 29 , 30 ] Dengan demikian, efek ini dapat mengganggu pengukuran offline di mana NADPH–produk sampingan dari konversi glukosa enzimatik oleh heksokinase dan glukosa-6-fosfat dehidrogenase–dideteksi secara fotometrik oleh absorbansinya pada 340 nm (A 340 ). [ 31 ]
Kinerja (bio)sensor elektrokimia secara umum dapat dipengaruhi oleh kapasitas antioksidan dan komposisi media pertumbuhan. [ 32 ] Secara khusus, untuk biosensor glukosa elektrokimia berdasarkan enzim glukosa oksidase–mirip dengan yang digunakan untuk pengukuran online dalam penelitian ini–Pontius et al. melaporkan bahwa konsentrasi garam yang lebih tinggi (NaCl) dalam media pertumbuhan mengurangi sinyal sensor. [ 33 ]
Efek-efek ini dapat menjelaskan konsentrasi glukosa yang lebih tinggi yang diamati selama pemantauan luring fotometrik dibandingkan dengan pengukuran elektrokimia daring. Beberapa derajat penyimpangan antara kedua metode tersebut dapat diterima, karena bahkan sistem CEDEX Bio–yang dianggap sebagai metode standar untuk pemantauan bioproses–memiliki tingkat pemulihan ±10%, yang didefinisikan sebagai rasio nilai yang diamati terhadap nilai aktual. [ 34 , 35 ]
Validasi dan kalibrasi lebih lanjut dalam kondisi kultur yang ditentukan akan diperlukan untuk meningkatkan akurasi pengukuran glukosa selama pengembangan sensor kuantitatif. Namun, memvalidasi dua uji glukosa yang tersedia secara komersial bukanlah fokus penelitian ini. Sebaliknya, karya ini menunjukkan bukti konsep untuk mengintegrasikan dan memanfaatkan sensor yang tersedia ke dalam platform multisensori untuk pemantauan bioproses.
Meskipun masih ada tantangan, kedua strategi pengukuran tersebut sudah memungkinkan pemantauan konsumsi glukosa dari waktu ke waktu dan memungkinkan penambahan substrat sebelum terjadi penipisan. Khususnya, pemantauan daring menawarkan keuntungan berupa pengukuran yang lebih sering, memungkinkan respons yang lebih cepat terhadap konsentrasi substrat yang sangat rendah dan memberikan wawasan proses saat pengambilan sampel luring tidak memungkinkan.
Percobaan kultivasi tabung goyang ini juga dilakukan untuk ragi S. cerevisiae , dan Gambar 3B mengilustrasikan bahwa viabilitas sel ragi tidak terpengaruh oleh platform sensor selama kultivasi 35 jam. Selain itu, pemantauan bioproses O 2 , pH, dan glukosa menunjukkan tren yang sama seperti pada kultivasi E. coli : kadar oksigen dan glukosa habis dalam waktu ≈8 jam, dan dO 2 meningkat lagi saat pertumbuhan dan kebutuhan oksigen yang sesuai berkurang setelah kultur bergeser dari fase eksponensial ke fase stasioner.
Nilai pH menurun selama proses kultivasi karena adanya sekresi asam organik, [ 36 ] , meskipun pada kasus ini, nilai pH tidak meningkat tajam setelah penipisan glukosa, namun tetap stabil pada nilai ≈6,3.
Platform sensor juga dihubungkan ke labu kocok kultivasi dengan sel CHO–sistem mamalia yang paling umum digunakan untuk produksi protein rekombinan [ 37 ] termasuk pemantauan CO 2 dan laktat. Sementara platform sensor secara umum berhasil dalam memantau berbagai parameter bioproses penting selama kultivasi sel CHO, beberapa tantangan masih harus diatasi, termasuk menjaga kelangsungan hidup sel dan menghindari masalah kontaminasi selama proses kultivasi beberapa hari. Untuk deskripsi hasil dan tantangan kultivasi dan bioproses terkait, lihat Gambar S8 (Informasi Pendukung).
2.3 Unit Pengambilan Sampel
Untuk analisis atline analit lebih lanjut (seperti asam amino atau antibodi rekombinan), unit pengambilan sampel dikembangkan yang hanya mengambil sejumlah kecil dari volume kultur. Unit pengambilan sampel ini dimaksudkan untuk menyediakan sampel bebas sel untuk analisis lebih lanjut dengan sistem µLC-MS, yang memungkinkan deteksi dan kuantifikasi berbagai macam analit (termasuk protein) dan hanya memerlukan volume sampel kecil serendah 1 hingga 60 µL. [ 38 – 41 ]
Gambar 4A mengilustrasikan prinsip pengoperasian unit pengambilan sampel ini, yang pada dasarnya merupakan penyaringan aliran tangensial dengan membran filter (0,2 µm untuk pengambilan sampel bebas sel) yang diposisikan secara tangensial terhadap aliran pintas dan memisahkan saluran pintas dari tutup yang berisi konektor untuk katup magnetik. Katup tersebut memungkinkan media kultur yang disaring untuk dipindahkan ke port pengambilan sampel yang terhubung ke sistem katup kedua dengan dua pompa jarum suntik. Salah satu pompa jarum suntik ini memindahkan sampel dari saluran pintas melalui membran filter, dan pompa jarum suntik kedua memindahkan sampel ke dalam tabung pengambilan sampel, tempat sampel akhirnya dilepaskan dan dikumpulkan.
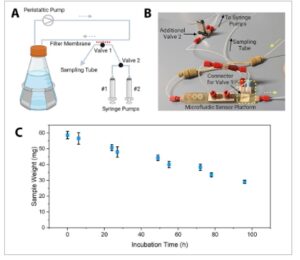
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Unit pengambilan sampel untuk mengumpulkan sejumlah kecil media untuk analisis luring. A) Ilustrasi skematis dari proses pengambilan sampel. B) Foto platform sensor yang telah dirakit termasuk perangkat katup tambahan 2. Persegi panjang kuning menunjukkan unit pengambilan sampel dan panah kuning menunjukkan arah aliran dari tabung pengocok ke platform sensor. C) Berat sampel yang dikumpulkan dari unit pengambilan sampel selama 96 jam pembudidayaan sel CHO. Batang galat menunjukkan deviasi standar dari pengukuran rangkap tiga (n = 3).
Gambar sistem yang telah dirakit (termasuk perangkat tambahan dengan katup magnetik kedua) disertakan pada Gambar 4B . Untuk perincian lebih lanjut, silakan lihat bagian eksperimen, yang menjelaskan perakitan unit ini, dan lihat Gambar S5 (Informasi Pendukung) untuk prosedur langkah demi langkah terperinci dari proses pengambilan sampel.
Sebagai bukti konsep, kultivasi labu goyang (96 jam) dengan sel CHO dilakukan, dan sampel ditarik selama kultivasi dan ditimbang. Seperti yang ditunjukkan pada Gambar 4C , berat sampel berkurang dari 60 hingga 30 mg pada akhir kultivasi, efek yang dapat dikaitkan dengan penyumbatan membran filter oleh sel CHO. Meskipun volume sampel berkurang (≈30 mg, ≈30 µL), diperkirakan cukup untuk analisis µLC-MS berikutnya. Selain itu, volume yang tersedia bahkan dapat memungkinkan partisi untuk analisis beberapa analit, seperti protein rekombinan atau kandungan asam amino sementara hanya mengurangi volume kultur secara minimal.
3 Kesimpulan
Dalam makalah ini, kami mendemonstrasikan platform sensor LOC mikrofluida cetak 3D bukti konsep yang mengintegrasikan beberapa sistem sensor skala kecil yang tersedia secara komersial dan memungkinkan pemantauan bioproses daring terhadap parameter kritis (seperti pH, gas terlarut, glukosa, dan laktat). Platform sensor ini bertindak sebagai bypass dan mengalirkan kembali media kultur ke dalam wadah kultur sehingga tidak ada volume yang hilang–keuntungan besar saat kultur dilakukan dalam sistem kultur miniatur seperti mikrobioreaktor. Selain itu, platform sensor juga mencakup unit pengambilan sampel yang didasarkan pada interaksi membran filter, katup magnetik, dan dua pompa jarum suntik, sehingga memungkinkan penarikan volume sampel bebas sel kecil dari media kultur–fitur yang dapat sangat bermanfaat untuk analisis atline dari reducts atau metabolit pakan (misalnya, asam amino, protein rekombinan), di mana pemantauan daring sulit dilakukan. Sebagai bukti konsep, kami telah menunjukkan pengambilan sampel setelah waktu inkubasi 96 jam dan telah berhasil menarik volume yang cukup untuk analisis selanjutnya (yaitu, menggunakan sistem µLC-MS).
Platform sensor ini juga berhasil diaplikasikan untuk pemantauan bioproses daring dari kultivasi labu goyang dengan spesies bakteri E. coli dan ragi S. cerevisiae . Sementara platform sensor didemonstrasikan untuk kultivasi labu goyang, ia juga dapat dihubungkan ke bioreaktor kecil seperti sistem Ambr 250 yang tersedia secara komersial (lihat Gambar S9 , Informasi Pendukung), dan berpotensi juga ke mikrobioreaktor yang dibuat khusus atau dicetak 3D yang lebih kecil. Dengan demikian, beberapa platform sensor LOC dapat digunakan untuk memantau bioreaktor kecil yang diparalelkan untuk meningkatkan hasil. Untuk meningkatkan akurasi platform sensor, khususnya dalam pengukuran glukosa, kalibrasi direkomendasikan tidak hanya dengan buffer kalibrasi yang ditunjuk tetapi juga dengan media pertumbuhan spesifik yang digunakan.
Untuk kultur dengan CHO mamalia, kami masih menghadapi tantangan dalam menjaga kelangsungan hidup sel dan mengurangi potensi kontaminasi. Secara umum, sel mamalia kurang kuat dan lebih sensitif terhadap geseran dibandingkan sel mikroba, [ 42 , 43 ] dan kultur sel mamalia juga lebih rentan terhadap kontaminasi karena mikroba tumbuh jauh lebih cepat daripada rekan-rekan mamalia mereka. [ 44 ] Pekerjaan di masa depan perlu diarahkan untuk mengatasi tantangan ini dengan meningkatkan proses sterilisasi dan dengan menguji jenis pompa lainnya, seperti sistem pemompaan yang digerakkan oleh tekanan.
4 Bagian Eksperimen
Strain dan Kondisi Budidaya
E. coli BL12 (DE3) (Thermo Fisher Scientific Inc., AS) yang mengandung plasmid pengekspresi protein fluoresen hijau (GFP) ditumbuhkan dalam kaldu lisogeni (LB) yang terdiri dari 5 g L −1 ekstrak ragi (Carl Roth GmbH, Jerman), 10 g L −1 pepton (Sigma–Aldrich, AS), 10 g L −1 NaCl (Carl Roth GmbH, Jerman) dan 3,6 g L −1 glukosa (Carl Roth GmbH, Jerman) dan disesuaikan ke pH 6,8. Kultur sel E. coli segar semalam digunakan untuk menginokulasi 50 mL media LB dalam labu kocok 250 mL (Fisher Scientific GmbH, Jerman) hingga kepadatan optik awal (OD 600 ) sebesar 0,1. Kultur ini kemudian diinkubasi pada suhu 37 °C (penurunan hingga 20 °C setelah 4 jam) dan 170 rpm.
Sel S. cerevisiae NCYC 1024 (National Collection of Yeast Cultures, Inggris Raya) dikulturkan dalam medium ekstrak ragi pepton dekstrosa (YPD), yang terdiri dari 10 g L −1 ekstrak ragi (Carl Roth GmbH, Jerman), 20 g L −1 pepton (Sigma-Aldrich, AS) dan 20 g L −1 glukosa (Carl Roth GmbH, Jerman) dan disesuaikan dengan pH 6,8. Kultur semalam digunakan untuk menginokulasi medium YPD hingga OD 600 sebesar 0,1 dalam volume akhir 50 mL dalam labu kocok 250 mL (Fisher Scientific GmbH, Jerman). Kultur ini kemudian diinkubasi pada suhu 30 °C dan 150 rpm.
Sel CHO-K1 dikulturkan dalam medium Xell TC-42 (Sartorius AG, Jerman) yang dilengkapi dengan glutamin 10 mM (Sigma-Aldrich, AS). Sel-sel ditumbuhkan dalam medium 50 mL dalam labu kocok berpenyekat 250 mL (Fisher Scientific GmbH, Jerman) pada jumlah sel awal ≈0,2 106 sel mL −1 dan diinkubasi pada suhu 37 ° C dan 5% CO 2 dalam atmosfer yang dilembabkan pada pengocok tahan CO 2 (Thermo Fisher Scientific Inc., AS) pada kecepatan 120 rpm. Jumlah sel dan viabilitas sel CHO ditentukan menggunakan CEDEX HiRes Analyser (Roche Diagnostics International, Jerman). Semua percobaan kultivasi dilakukan menggunakan pengocok tahan CO2 ( Thermo Fisher Scientific Inc., AS) yang ditempatkan dalam inkubator (HERAcell VIOS 160i, Thermo Fisher Scientific Inc., AS).
Desain dan Pembuatan Komponen Cetak 3D
Bagian-bagian platform sensor cetak 3D dibuat menggunakan perangkat lunak CAD SolidWorks 2022 (Dassault Systèmes SolidWorks Corp, AS), dan dibuat menggunakan printer 3D MultiJet MJP 2500 Plus berpresisi tinggi (3D Systems, AS). Semua bagian dicetak dari bahan model poliakrilat biokompatibel VisiJet M2S-HT90 Plus (3D Systems, AS) dan bahan pendukung lilin VisiJet M2-SUP Plus (3D Systems, AS).
Bagian yang dicetak dilepaskan dari platform pencetakan setelah inkubasi pada suhu -18 °C selama 10 menit. Bahan pendukung kemudian dicairkan dan dilepaskan menggunakan penangas uap dan penangas minyak parafin (sistem EasyClean, 3D Systems, AS) pada suhu 65 °C selama 45 dan 30 menit, berturut-turut. Semua struktur mikrofluida dibilas setidaknya tiga kali dengan minyak parafin panas menggunakan spuit. Untuk menghilangkan bahan pendukung yang tersisa, saluran mikrofluida diproses lebih lanjut dalam penangas minyak parafin ultrasonik (Elma Elmasonic S30, Schmidbauer GmbH, Jerman) pada suhu 65 °C selama 30 menit. Residu minyak kemudian dihilangkan dengan menginkubasi bagian-bagian tersebut dalam penangas ultrasonik dengan ddH 2 O dan deterjen 1% (v/v) (Fairy Ultra Plus, Procter and Gamble, AS) pada suhu 65 °C. Proses ini diulang tiga kali selama 30 menit setiap kali. Terakhir, bagian tersebut dibilas dengan ddH2O hanya untuk menghilangkan residu deterjen dan kemudian dikeringkan.
Perakitan Platform Sensor Mikrofluida dan Pemantauan Bioproses
Integrasi colokan sensor pH, O 2 , dan CO 2 (PreSens GmbH, Jerman) dicapai dengan memasang colokan secara tepat ke dalam slot yang dirancang khusus yang memungkinkan lapisan sensor di ujung colokan sensor ditempatkan dalam kontak dengan media di dalam saluran bypass. Colokan tersebut didudukkan dengan erat ke dalam slot ini dengan menggunakan tutup sekrup cetak 3D yang menekan colokan sensor ke dalam slot yang ditentukan. Colokan sensor yang terpasang dihubungkan ke unit pengukuran masing-masing (OXY1-ST; CO 2 1 SMA; pH-1 SMA HP5, PreSens GmbH, Jerman) melalui serat polimer optik. Yang terakhir kemudian dihubungkan ke komputer melalui USB, dan pengukuran dibaca dan direkam menggunakan perangkat lunak PreSens yang disertakan (PreSens Measurement Studio 2, Versi 4.0.0). Representasi grafis (termasuk penampang) dari unit penginderaan individual yang dikembangkan ditunjukkan pada Gambar S1 (Informasi Pendukung).
Untuk pengukuran konsentrasi glukosa dan laktat, alat ukur TRACE C2 (908 Devices Inc., AS) termasuk tabung pada panjang yang telah ditetapkan dan membran dialisis dengan ukuran yang telah ditetapkan (semuanya disediakan dalam sistem komersial) dihubungkan ke platform sensor mikrofluida. Secara khusus, membran dialisis pertama-tama ditempatkan di bagian bawah sistem mikrofluida, diikuti oleh tutup dengan fitting tanpa flensa untuk tabung yang selanjutnya dipasang. Perekat dua komponen yang biokompatibel Loctite EA M-31CL (Henkel AG & Co. KGaA, Jerman) diaplikasikan pada sambungan kedua bagian tersebut untuk memastikan sambungan kedap air. Lebih jauh, klem dengan blok aluminium digunakan untuk memberikan tekanan dan menyegel unit ini. Setelah integrasi membran, sistem dioperasikan menggunakan prosedur otomatis yang disediakan oleh produsen, [ 24 ] di mana saluran atas diisi dengan buffer transpor, dan glukosa dan laktat diberi waktu yang ditentukan untuk berdifusi dari saluran bawah dengan media kultur sel melalui membran dialisis ke dalam buffer transpor. Selanjutnya, saluran atas dibilas, dan buffer transpor yang berisi glukosa dan laktat dipindahkan ke sistem biosensor untuk dideteksi. Sebelum pengukuran glukosa, sistem dikalibrasi menggunakan buffer kalibrasi glukosa 4 dan 0,5 g L −1 yang disediakan oleh produsen dan akurasinya diuji dengan konsentrasi glukosa yang ditentukan dalam PBS (tablet PBS Gibco, Thermo Fisher Scientific Inc., AS), lihat Gambar S7 (Informasi Pendukung). Lihat juga Gambar S2 (Informasi Pendukung) untuk representasi grafis dari masing-masing unit pemantauan glukosa dan laktat.
Demikian pula, dalam unit pengambilan sampel, membran filter polieter sulfon (PES) 0,2 µm hidrofilik (Sartorius AG, Jerman) ditempatkan di antara dua bagian cetakan 3D untuk memisahkan saluran pintas dari port pengambilan sampel. Membran PES tersebut umumnya digunakan untuk aplikasi penyaringan seperti penyaringan aliran tangensial [ 45 – 47 ] dan memiliki keunggulan stabilitas termal yang tinggi (dapat diautoklaf), ketahanan kimia yang tinggi, daya tahan pH yang luas, dan juga memungkinkan laju aliran yang tinggi. [ 47 ] Untuk menyegel sistem, segel datar politetrafluoroetilen (PTFE) dipotong secara manual menggunakan panduan pemotongan cetakan 3D dari pita segel PTFE setebal 0,1 mm (W. Kirchhoff GmbH, Jerman) dan ditambahkan pada kedua sisi membran filter. Tepatnya, di bagian bawah sistem pengujian, paking datar ditempatkan terlebih dahulu, diikuti oleh membran filter dan paking datar kedua. Bagian cetakan 3D atas kemudian ditempatkan di atas dan diamankan dengan klem. Perekat dua komponen yang biokompatibel Loctite EA M-31CL kembali diaplikasikan di persimpangan bagian-bagian sistem untuk menciptakan segel kedap air di antara kedua bagian yang dicetak. Katup solenoida 3/2 arah (Bürkert GmbH & Co. KG, Jerman) digunakan untuk mengendalikan aliran fluida dan dipasang pada sistem pengambilan sampel menggunakan sekrup yang disediakan. Representasi CAD grafis dan gambar teknis terperinci dari unit pengambilan sampel digambarkan masing-masing pada Gambar S3 dan S4 (Informasi Pendukung).
Untuk penggunaan dalam kultivasi, platform sensor cetak-3D diautoklaf dalam kantong kedap udara dan colokan sensor (dikirim secara steril) dimasukkan dalam kondisi steril ke dalam platform sensor cetak-3D. Selanjutnya, sistem dihubungkan melalui pipa ke labu goyang menggunakan sambungan sekrup tanpa flensa dan ditempatkan ke dalam inkubator pada kondisi yang ditentukan. Sebagai referensi untuk pemantauan bioproses daring, glukosa dipantau dalam kaldu kultur yang diambil sampelnya secara manual menggunakan CEDEX Bio (Roche Diagnostics International, Jerman) berdasarkan uji enzimatik (heksokinase dan glukosa-6-fosfat dehidrogenase) yang secara fotometrik (absorbansi pada 340 nm) memantau jumlah NADPH setelah konversi glukosa menjadi glukonat-6-fosfat. [ 31 ] Sebelum pengukuran glukosa, sistem dikalibrasi menggunakan buffer kalibrasi yang ditentukan (Kalibrator A Bio) yang disediakan oleh produsen.
Analisis Statistik
Data yang disajikan dalam naskah ini belum diproses terlebih dahulu (misalnya, transformasi data atau normalisasi) sebelum membuat grafik masing-masing. Pengukuran berulang dilakukan sebanyak tiga kali (n = 3, lihat Gambar 4 ) dan disajikan sebagai rata-rata ± simpangan baku. Informasi ini terdapat dalam legenda gambar yang relevan.




Tinggalkan Balasan