Abstrak Grafis
Patch multipleks diusulkan berdasarkan pengukuran hamburan Raman yang ditingkatkan permukaan (SERS) dan analisis resolusi kurva multivariat (MCR). Perakitan nanorod emas (AuNR) yang dimodifikasi pada film polidimetilsiloksan (PDMS) memberikan patch sensitivitas tinggi terhadap deteksi SERS, dan dekomposisi MCR mewujudkan kuantifikasi H 2 O 2 dan nilai pH secara bersamaan dalam lingkungan mikro ekstraseluler.
Abstrak
Pemantauan lingkungan mikro seluler sangat penting untuk mempelajari proses sel, mengungkap status patologis, dan memprediksi penyakit dini. Di sini, patch hamburan Raman yang ditingkatkan permukaan (SERS) diusulkan untuk merasakan konsentrasi hidrogen peroksida (H 2 O 2 ) dan variasi pH lingkungan mikro ekstraseluler secara multipleks. Perakitan batang nano emas (AuNR) yang ditingkatkan skalanya dan dipesan diperkenalkan melalui perakitan antarmuka dan transfer penyerapan pada film polidimetilsiloksan (PDMS) yang fleksibel, yang menyediakan patch dengan peningkatan SERS yang besar untuk biosensing. Modifikasi molekul pelapor Raman yang responsif terhadap H 2 O 2 dan rentan terhadap pH memberikan patch SERS sensitivitas tinggi terhadap beberapa analit, dan konstruksi analisis resolusi kurva multivariat (MCR) memfasilitasi kuantifikasi H 2 O 2 dan nilai pH meskipun puncak karakteristiknya tumpang tindih. Lebih jauh, patch SERS digunakan untuk membandingkan lingkungan mikro ekstraseluler dari sel-sel hidup yang berbeda. Hasil penelitian menunjukkan bahwa sel yang sangat bermigrasi (yaitu, MDA-MB-231) mengeluarkan lebih banyak H 2 O 2 di bawah stimulasi phorbol 12-myristate 13-acetate (PMA), dan lingkungan mikro ekstraseluler lebih asam daripada sel dengan kemampuan migrasi yang lemah (yaitu, MCF-7), yang menunjukkan hubungan antara migrasi sel dan lingkungan mikro. Strategi ini mengintegrasikan deteksi H 2 O 2 dan penentuan pH dalam satu patch, yang dapat menawarkan pendekatan untuk biosensor multipleks baru dan investigasi migrasi sel.
1 Pendahuluan
Homeostasis lingkungan mikro sel, termasuk molekul sinyal, nilai pH, metabolit, dan sebagainya, memainkan peran penting dalam perilaku sel. [ 1 – 3 ] Misalnya, hidrogen peroksida (H 2 O 2 ), produk metabolisme aerobik, bertindak sebagai molekul sinyal apoptosis sel, yang kelainannya dikaitkan dengan stres oksidatif dan berbagai penyakit degeneratif. [ 4 – 6 ] Dan nilai pH juga merupakan mediator fungsi sel, yang disregulasinya telah terbukti memfasilitasi proliferasi sel, migrasi, dan adaptasi metabolik, yang berfungsi sebagai indikator perkembangan kanker. [ 7 , 8 ] Namun, fluktuasi H 2 O 2 biasanya disertai dengan variasi pH dalam keadaan fisiologis atau patologis sel, [ 9 ] dan peran saling memengaruhi dari kedua faktor tersebut kurang jelas. Oleh karena itu, deteksi simultan H 2 O 2 dan nilai pH akan memfasilitasi penyelidikan proses patologis sel, dan menyediakan jalur untuk diagnosis penyakit dan skrining obat, yang sangat dibutuhkan. [ 10 ]
Berbagai strategi telah diusulkan untuk mengukur konsentrasi H 2 O 2 dan variasi pH secara bersamaan, termasuk biosensing elektrokimia, [ 11 , 12 ] pencitraan fluoresensi [ 9 ] dan hamburan Raman yang ditingkatkan permukaan (SERS). [ 13 , 14 ] Deteksi multipleks elektrokimia dapat diwujudkan dengan fungsionalisasi yang berbeda dari susunan elektroda kerja, yang menunjukkan keuntungan dari sensitivitas tinggi, respons cepat, dan biaya rendah, [ 15 , 16 ] tetapi mengalami tantangan resolusi spasial. Dikombinasikan dengan mikroskop confocal, beberapa analit dapat divisualisasikan pada tingkat subseluler oleh probe fluoresensi molekuler tertentu, [ 17 , 18 ] tetapi photobleaching dan fotodegradasi menghambat pemantauan jangka panjang H 2 O 2 dan nilai pH. Biosensor berbasis SERS, teknik multipleks lain dengan resolusi spasial tinggi, mengatasi keterbatasan fluoresensi, yang dapat berfungsi sebagai strategi alternatif untuk mendeteksi beberapa analit dalam lingkungan mikro seluler. [ 19 , 20 ] Sidik jari molekuler dalam spektrum SERS dikaitkan dengan struktur molekuler, menyediakan teknik dengan kemampuan memantau reaksi kimia. [ 19 , 21 ] Sementara itu, kopling plasmonik yang dibuat oleh nanopartikel dapat membentuk medan elektromagnetik yang ditingkatkan, menawarkan sensitivitas tinggi SERS hingga satu molekul, [ 21 , 22 ] yang cocok untuk bioanalisis dengan konsentrasi rendah dan telah diterapkan dalam memantau indikator diferensiasi sel, [ 23 , 24 ] pelacakan difusi obat dalam lingkungan seluler [ 25 ] dan pembuatan profil komponen vesikel ekstraseluler. [ 26 , 27 ] Namun, sedikit penelitian telah dilaporkan pada deteksi simultan H 2 O 2 dan nilai pH dalam lingkungan mikro sel oleh biosensor berbasis SERS.
Dalam karya ini, patch multipleks berbasis SERS diusulkan untuk memantau konsentrasi H 2 O 2 dan variasi pH dalam lingkungan mikro sel. Nanorod emas digunakan sebagai blok penyusun untuk patch SERS karena stabilitas kimianya, sifat optik yang dapat disesuaikan, dan persiapan yang mudah. Dengan memodifikasi film nanorod emas pada struktur polidimetilsiloksan (PDMS) yang fleksibel melalui perakitan antarmuka dan pemindahan penyerapan, patch dapat menawarkan hotspot yang stabil dan dapat ditingkatkan skalanya untuk peningkatan SERS. Sementara itu, pengukuran H 2 O 2 dan penentuan pH diimplementasikan dengan fungsionalisasi molekul pelapor Raman yang responsif terhadap H 2 O 2 dan peka terhadap pH pada patch SERS. Selain itu, analisis resolusi kurva multivariat (MCR) diperkenalkan untuk memecahkan masalah tumpang tindih spektrum selama deteksi multipleks. Dan konsentrasi H 2 O 2 dan nilai pH sel dengan kemampuan migrasi yang berbeda dibandingkan dengan patch SERS dan dekomposisi MCR, yang mengungkapkan hubungan antara gerakan sel dan lingkungan mikro ekstraseluler.
2 Hasil dan Pembahasan
2.1 Pembuatan dan Karakterisasi Patch SERS
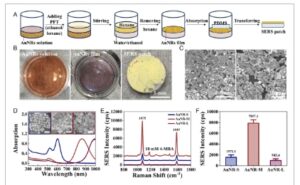
Patch SERS diperoleh dengan menggabungkan perakitan AuNRs dengan struktur PDMS fleksibel, seperti yang ditunjukkan pada Gambar 1A . Perfluorodecanethiol (PFT), sebuah molekul dengan gugus perfluorinasi ( CF 3 ), digunakan untuk meningkatkan sifat hidrofobisitas dan mengurangi hambatan penyerapan kinetik AuNRs. [ 28 ] Dengan menambahkan campuran PFT, etanol dan heksana ke dalam larutan berair AuNRs yang baru disiapkan, modifikasi PFT pada AuNRs melalui interaksi kovalen Au-thiolate dan antarmuka air-heksana terbentuk dengan cepat. Dengan demikian, AuNRs yang dimodifikasi berpindah ke antarmuka organik-air dan perakitan cepat film emas dapat diamati. Setelah menghilangkan heksana supernatan dengan hati-hati, film perakitan AuNRs yang berdiri sendiri dapat ditransfer langsung pada struktur PDMS segera melalui interaksi van der Waals. [ 28 ] Gambar larutan AuNRs yang telah disiapkan, film perakitan AuNRs, dan struktur PDMS yang dimodifikasi AuNRs (Gambar 1B ) menunjukkan pencapaian perakitan antarmuka dan pemindahan AuNRs. Gambar mikroskop elektron pemindaian (SEM) dari film AuNRs yang terbentuk akhir pada PDMS menunjukkan susunan AuNRs yang berskala ke atas, bertingkat tunggal, dan berdampingan (Gambar 1C ).
Gambar 1
Buka di penampil gambar
Pembuatan dan karakterisasi patch plasmonik berbasis SERS kami. A) Proses pembuatan patch plasmonik dengan memodifikasi AuNR pada film PDMS melalui perakitan antarmuka dan pemindahan penyerapan. B) Gambar larutan AuNR, film AuNR pada antarmuka air-heksana, dan patch plasmonik dari film PDMS yang dimodifikasi AuNR. C) Gambar SEM patch plasmonik. D) Spektrum penyerapan UV–Vis AuNR dengan AR yang berbeda. E) Spektrum SERS, dan F) intensitas pada 1075 cm −1 dari 4-MBA (10 mM) pada patch plasmonik yang dibuat oleh AuNR yang berbeda. AuNR-S (biru): AR adalah 1,6. AuNR-M (merah): AR adalah 3,4. AuNR-L (coklat): AR adalah 5,0.
Selain itu, strategi ini menunjukkan penerapan universal pada AuNR dengan rasio aspek (AR) yang berbeda, yang ditandai sebagai AuNR-S (pendek, AR: 1,6), AuNR-M (sedang, AR 3,4) dan AuNR-L (panjang, AR:5,0). Spektrum serapan UV–Vis dan gambar SEM dari AuNR ditunjukkan pada Gambar 1D , yang menunjukkan bahwa puncak resonansi plasmon permukaan terlokalisasi longitudinal bergeser merah dengan meningkatnya AR nanorod. [ 29 ] Untuk mendapatkan peningkatan SERS tertinggi, AR AuNR dioptimalkan melalui perbandingan spektrum SERS 4-MBA (10 mM) yang dimodifikasi pada patch (Gambar 1E ). Semua spektrum SERS telah menunjukkan puncak karakteristik yang jelas pada 1075 dan 1587 cm −1 , yang menunjukkan perakitan AuNR pada patch PDMS telah sangat meningkatkan sinyal Raman, yang mengonfirmasi kegunaan patch untuk pengukuran SERS. Patch SERS dengan intensitas sinyal tertinggi dipilih untuk percobaan berikutnya, yang dibuat oleh AuNRs-M dengan AR sedang (3,4) dan puncak serapan pada 860 nm (Gambar 1F ). Faktor peningkatan patch SERS diperkirakan sebesar 1,8 × 105 , dan perhitungan terperinci ditunjukkan pada Informasi Pendukung. Keseragaman patch SERS dievaluasi dengan pemetaan intensitas 4-MBA pada area 28 × 28 μm2 , yang menunjukkan deviasi standar relatif sebesar 8,60% (Gambar S2, Informasi Pendukung). Dan stabilitas diuji dengan menempatkan patch SERS di udara selama seminggu dan membandingkan intensitas 4-MBA pada 1075 cm −1 . Intensitas SERS setelah seminggu penyimpanan tidak menunjukkan perbedaan signifikan dari yang baru disiapkan (Gambar S3, Informasi Pendukung), yang mengonfirmasi stabilitas patch yang tinggi.
2.2 Deteksi H 2 O 2 dan pH dengan Patch SERS
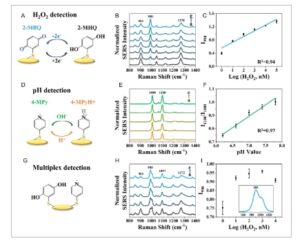
Patch SERS difungsionalkan oleh molekul reporter Raman yang sensitif terhadap H 2 O 2 , 2-merkaptohidrokuinon (2-MHQ), yang dapat dengan mudah diimobilisasi pada permukaan AuNR melalui pembentukan ikatan Au tiolat. Mekanisme reaksi 2-MHQ dengan H 2 O 2 ditunjukkan pada Gambar 2A , di mana gugus hidroksil ( OH) dari 2-MHQ dioksidasi menjadi gugus karbonil (O), menghasilkan pembentukan 2-merkaptobenzokuinon (2-MBQ) dan perubahan spektrum SERS ketika oksidan H 2 O 2 ada. [ 30 , 31 ] Puncak karakteristik Raman pada 482 cm −1 dari 2-MHQ dilaporkan tidak rentan terhadap H 2 O 2 , [ 30 ] sehingga berfungsi sebagai standar internal intrinsik untuk normalisasi spektrum. Gambar 2B menunjukkan spektrum SERS 2-MHQ yang dinormalisasi setelah bereaksi dengan H 2 O 2 , di mana konsentrasi meningkat secara bertahap dari bawah ke atas (kurva ag). Puncak karakteristik yang terkait dengan peregangan CO muncul pada 990 cm −1 dan intensitas meningkat dengan penambahan H 2 O 2 , yang menunjukkan transformasi 2-MHQ menjadi 2-MBQ. [ 32 ] Hubungan antara I 990 dan konsentrasi logaritmik H 2 O 2 , log(H 2 O 2 ) singkatnya, menunjukkan kurva kalibrasi linear (Gambar 2C , R 2 = 0,94), yang menunjukkan kelayakan patch SERS 2-MHQ yang dimodifikasi untuk deteksi H 2 O 2 . Batas deteksi H 2 O 2 ditentukan sebesar 0,14 nM dengan rasio intensitas sinyal terhadap 3,3 δ , [ 33 ] dan perhitungan terperinci ditunjukkan dalam Informasi Pendukung. Demikian pula, patch SERS juga dapat berfungsi sebagai sensor pH dengan memodifikasi molekul pelapor Raman yang peka terhadap pH, 4-MPy, yang strukturnya berubah dalam lingkungan asam atau basa (Gambar 2D ). Gambar 2E mengilustrasikan spektrum SERS yang dinormalisasi dari 4-MPy ketika patch direndam dalam larutan PBS dengan nilai pH yang berbeda mulai dari 6 hingga 8 (kurva a–e). Intensitas puncak pada 1008 cm −1 dan 1100 cm −1bervariasi selama proses protonasi atau deprotonasi, yang berhubungan dengan vibrasi pernapasan cincin piridina dan ikatan karbon–sulfur, masing-masing. [ 34 , 35 ] Plot nilai I 1100 / I 1008 dan pH menunjukkan hubungan linear (Gambar 2F ), yang memverifikasi bahwa patch SERS fungsional 4-MPy cocok untuk penginderaan pH.
Gambar 2
Buka di penampil gambar
Deteksi H 2 O 2 dan pH dengan intensitas relatif spektrum menggunakan patch SERS. A) Skema deteksi H 2 O 2 dengan oksidasi 2-MHQ. B) Spektrum SERS 2-MHQ yang dinormalkan setelah bereaksi dengan H 2 O 2 dalam berbagai konsentrasi (a–g: 0 nM, 1 nM, 10 nM, 100 nM, 1 μM, 10 μM, 100 μM). C) Hubungan antara I 990 dan log(H 2 O 2 ) yang sesuai dengan B. D) Skema deteksi pH dengan protonasi dan deprotonasi 4-MPy. E) Spektrum SERS 4-MPy yang dinormalkan dalam larutan PBS dengan berbagai nilai pH (a–e: 6,2, 6,6, 7,0, 7,4, 7,8). F) Hubungan antara I1100 / I1008 dan nilai pH yang sesuai dengan E. G ) Skema deteksi multipleks dengan memodifikasi 2-MHQ dan 4-MPy pada patch SERS. H) Spektrum SERS yang dinormalkan dari patch dalam larutan PBS dengan berbagai konsentrasi H2O2 ( a – e: 1 nM, 10 nM, 100 nM, 1 μM, 10 μM ) dan nilai pH konstan (6,9). I) I990 versus log(H2O2 ) yang sesuai dengan H. Data ditunjukkan sebagai rata-rata ± simpangan baku ( n = 6). Sisipan adalah spektrum H yang diperbesar.
Setelah mengonfirmasi kemampuan patch SERS untuk pengukuran H 2 O 2 atau pH secara individual, deteksi multipleks diuji dengan menggabungkan 2-MHQ dengan 4-MPy pada patch yang sama, seperti yang ditunjukkan pada Gambar 2G . Spektrum SERS dari campuran tersebut menunjukkan puncak karakteristik Raman pada 903 dan 1097 cm −1 , yang berkontribusi pada getaran pernapasan simetris kerangka karbon dari 2-MHQ dan ikatan karbon sulfur dari 4-MPy, yang mengungkapkan keberadaan dua molekul pelapor Raman (Gambar 2H ). Spektrum SERS dari patch dalam berbagai konsentrasi H 2 O 2 dan nilai pH tetap (6,9) diharapkan menunjukkan intensitas puncak yang lebih tinggi pada 990 cm −1 seperti yang dilakukan sensor H 2 O 2 individual pada Gambar 2B . Namun, tumpang tindih spektrum antara 990 dan 1008 cm −1 menghalangi hubungan linear antara I 990 versus log(H 2 O 2 ) (Gambar 2I ), yang menunjukkan bahwa kuantifikasi H 2 O 2 sulit dicapai dalam deteksi multipleks dengan analisis intensitas tradisional.
2.3 Deteksi Multiplex dengan Analisis MCR
Untuk memecahkan masalah tumpang tindih spektrum dalam deteksi multipleks, strategi MCR diperkenalkan, yang menjelaskan metode untuk menghitung model bilinear aditif yang bermakna secara kimia dari spektrum komponen murni dan kontribusi yang sesuai dari spektrum campuran. [ 36 , 37 ] Model MCR sering dinyatakan dalam bentuk matriks sebagai: D = C S T + E , di mana D mewakili matriks spektrum campuran, C menunjukkan profil kontribusi semua komponen murni, S T terdiri dari spektrum komponen murni, dan E adalah kesalahan antara spektrum asli dan model.
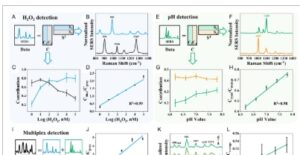
Selama deteksi H 2 O 2 , spektrum SERS yang ditunjukkan pada Gambar 2B mungkin merupakan campuran 2-MHQ dan produk oksidatifnya 2-MBQ, yang menunjukkan adanya dua komponen murni. Oleh karena itu, analisis MCR dilakukan dengan model dua komponen ( Gambar 3A ). Spektrum komponen murni yang terpecahkan (Gambar 3B ) serupa dengan hasil pengukuran aktual 2-MHQ dan 2-MBQ murni dalam literatur, [ 31 ] dan kontribusi komponen murni yang sesuai (kurva biru atau abu-abu) bervariasi menurut konsentrasi H 2 O 2 (Gambar 3C ). Jumlah kuadrat residual relatif (RRSSQ) oleh model MCR adalah 4,7%. Gambar 3D mengilustrasikan hubungan linear antara rasio kontribusi C biru / C abu-abu dan log (H 2 O 2 ) ( R 2 = 0,99), yang memverifikasi peningkatan deteksi H 2 O 2 dengan analisis MCR dibandingkan dengan metode tradisional (Gambar 2C ).
Gambar 3
Buka di penampil gambar
Deteksi H 2 O 2 dan pH dengan spektrum komponen murni dan distribusi dekomposisi MCR. A) Skema, B) spektrum komponen murni dan C) profil kontribusi spektrum SERS yang sesuai dengan gambar 2B dengan dekomposisi MCR. D) Hubungan antara rasio kontribusi C biru / C abu-abu dan log (H 2 O 2 ). E) Skema, F) spektrum komponen murni dan G) profil kontribusi spektrum SERS yang sesuai dengan gambar 2E dengan dekomposisi MCR. H) Hubungan antara rasio kontribusi C cyan / C oranye dan nilai pH. I) Skema deteksi multipleks dengan analisis MCR. J) Hubungan antara rasio kontribusi C biru / C abu-abu dan log (H 2 O 2 ) dalam campuran dengan modifikasi ganda. K) Spektrum SERS yang dinormalisasi dari patch dalam larutan PBS dengan nilai pH yang bervariasi (a–d: 6,48, 6,90, 7,34, 7,71) dan konsentrasi H 2 O 2 konstan (1 μM). L) Hubungan antara rasio kontribusi C cyan / C orange dan nilai pH dalam campuran dengan modifikasi ganda. Data dinyatakan sebagai rata-rata ± simpangan baku ( n = 6).
Selain itu, spektrum SERS dari 4-MPy pada Gambar 2E juga dapat didekomposisi oleh model MCR dua-komponen, seperti yang dijelaskan dalam Gambar 3E . Spektrum komponen murni akhir yang diestimasikan menunjukkan puncak karakteristik yang jelas pada 1007 cm −1 atau 1100 cm −1 (Gambar 3F ), yang menunjukkan perubahan dominan spektrum SERS selama variasi pH. Kontribusi kurva cyan dalam spektrum campuran meningkat dengan nilai pH (Gambar 3G ), dan RRSSQ dalam analisis MCR adalah 4,4%. Rasio kontribusi C cyan / C orange menunjukkan korelasi linear terhadap nilai pH ( R 2 = 0,98), yang mengonfirmasi pencapaian deteksi pH dengan dekomposisi MCR.
Dalam deteksi multipleks, hasil pengukuran dianggap sebagai kombinasi linear dari empat spektrum komponen murni pada Gambar 3B dan Gambar 3F , sehingga kendala kesetaraan spektrum yang diketahui ditambahkan (Gambar 3I ). Spektrum SERS pada Gambar 2H dihitung dengan analisis MCR empat komponen, yang berisi informasi tentang konsentrasi H 2 O 2 yang bervariasi dan nilai pH yang tetap. Rasio kontribusi yang diestimasikan C blue / C gray menunjukkan korelasi positif dengan log(H 2 O 2 ) (Gambar 3J , R 2 = 0,98), mirip dengan deteksi individual. Sementara itu, spektrum SERS dalam konsentrasi H 2 O 2 tetap dan nilai pH yang berbeda juga diukur dan didekomposisi oleh model MCR. Puncak karakteristik yang terkait dengan variasi pH (1008 cm −1 ) dikaburkan oleh puncak pada 990 cm −1 (Gambar 3K ), tetapi rasio kontribusi terhitung C cyan / C orange menunjukkan hubungan linear versus nilai pH, yang memverifikasi peningkatan kuantifikasi multipleks dengan analisis MCR. Dengan cara ini, deteksi multipleks H 2 O 2 dan nilai pH dapat dicapai dengan satu patch SERS.
2.4 Deteksi Multipleks Sel Hidup
Di sini, patch SERS fungsional ganda selanjutnya diaplikasikan ke sel hidup untuk pemantauan in situ pelepasan H 2 O 2 dan variasi pH secara multipleks, seperti yang ditunjukkan pada Gambar S5, Informasi Pendukung. PMA, inisiator spesies oksigen reaktif yang diketahui, [ 5 ] digunakan untuk menstimulasi stres oksidatif seluler, dan spektrum SERS intrinsik PMA dapat diabaikan dibandingkan dengan molekul reporter Raman (Gambar S6, Informasi Pendukung). MCF-7 dan MDA-MB-231, dua fenotipe sel kanker payudara, dibandingkan dengan strategi multipleks berbasis SERS. Gambar 4A dan 4B mengilustrasikan spektrum SERS yang dinormalisasi dari dua sel sebelum dan setelah stimulasi PMA, di mana puncak karakteristik pada 990 cm −1 meningkat banyak, yang menunjukkan pelepasan H 2 O 2 ke dalam lingkungan mikro ekstraseluler. Lebih jauh lagi, variasi H 2 O 2 atau pH ditentukan dengan menguraikan spektrum SERS melalui model MCR empat komponen, yang bertujuan untuk mengungkapkan hubungan antara fenotipe sel dan lingkungan mikro ekstraseluler. Dibandingkan dengan MCF-7, sel MDA-MB-231 menunjukkan rasio kontribusi terkait H 2 O 2 yang lebih tinggi C blue / C gray (Gambar 4C ), yang menunjukkan bahwa MDA-MB-231 mungkin menghasilkan lebih banyak H 2 O 2 di bawah stimulasi PMA. Sementara itu, rasio kontribusi terindeks pH C cyan / C orange dari MDA-MB-231 lebih rendah daripada MCF-7 (Gambar 4D ), yang menggambarkan lingkungan mikro ekstraseluler yang lebih asam dari MDA-MB-231. Gambar pemetaan rasio kontribusi terkait H 2 O 2 atau pH juga mengungkapkan heterogenitas lingkungan mikro seluler (Gambar S7 dan S8, Informasi Pendukung). Pada saat yang sama, migrasi sel dievaluasi dengan uji gores seperti pada pekerjaan sebelumnya. [ 38 ] Seperti yang ditunjukkan pada Gambar 4G , lebar goresan MDA-MB-231 menurun secara signifikan, yang menyebabkan penyembuhan luka lengkap dalam waktu 48 jam (Gambar 4F ). Hasil menunjukkan bahwa MDA-MB-231 memiliki kemampuan migrasi yang lebih tinggi, sekresi H 2 O 2 lebih banyak , dan nilai pH ekstraseluler yang lebih rendah daripada MCF-7, yang mengungkapkan korelasi antara migrasi sel dan perubahan lingkungan mikro ekstraseluler. Fenomena ini konsisten dengan model yang ditetapkan bahwa H 2 O 2 yang dihasilkan di ujung tombak mengoksidasi protein perancah dan meningkatkan migrasi sel.[ 39 ] Sementara itu, nilai pH yang lebih rendah mempercepat rekombinasi sel-matriks dan pembentukan lamellipodia, yang selanjutnya memfasilitasi migrasi sel. [ 40 ] Penyebaran rasio kontribusi terkait dua faktor (yaitu, C biru / C abu-abu dan C cyan / C oranye ) menunjukkan kelompok titik data yang terpisah (Gambar 4E ), yang menunjukkan klasifikasi dua subpopulasi sel. Oleh karena itu, strategi patch multipleks berbasis SERS ini dapat memberikan jalur untuk membedakan fenotipe sel dengan membandingkan lingkungan mikro ekstraseluler.
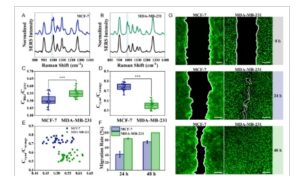
Gambar 4
Buka di penampil gambar
Deteksi multipleks sel hidup dengan kemampuan migrasi berbeda menggunakan patch SERS dan analisis MCR. A) Spektrum SERS MCF-7 yang dinormalisasi sebelum (hitam) dan setelah stimulasi PMA (biru). B) Spektrum SERS MDA-MB-231 yang dinormalisasi sebelum (hitam) dan setelah stimulasi PMA (hijau). C) C biru / C abu-abu dan D) C cyan / C oranye dari sel yang berbeda sesuai dengan spektrum SERS dalam A dan B. ANOVA dengan Tukey: *** P < 0,001. E) Hamburan rasio kontribusi C biru / C abu-abu (ditetapkan sebagai x) dan C cyan / C oranye (ditetapkan sebagai y) ditentukan oleh dekomposisi MCR. F) Laju migrasi sel diperkirakan dengan uji gores. Data ditunjukkan sebagai mean ± simpangan baku ( n = 5). G) Gambar fluoresensi sel MCF-7 dan sel MDA-MB-231 dalam uji gores. Skala batang adalah 200 μm.
3 Kesimpulan
Singkatnya, karya ini mengembangkan patch penginderaan multipleks untuk memantau konsentrasi H 2 O 2 dan tingkat pH sel hidup berdasarkan pengukuran SERS dan dekomposisi MCR. Gambar patch PDMS mengonfirmasi pengaturan skala-atas dan berdampingan AuNR, dan spektrum 4-MBA menunjukkan sensitivitas tinggi patch SERS dengan AR AuNR yang optimal. Fungsionalisasi 2-MHQ dan 4-MPy memberi patch SERS kemampuan untuk mendeteksi H 2 O 2 dan nilai pH, masing-masing, tetapi tumpang tindih spektrum menghalangi kuantifikasi kedua analit ketika analisis intensitas tradisional digunakan. Metode MCR, yang mempertimbangkan spektrum campuran sebagai kombinasi linear dari spektrum komponen murni, menawarkan solusi untuk menentukan analit. Rasio kontribusi komponen murni dalam H 2 O 2 (yaitu, C biru / C abu-abu ) menunjukkan korelasi linear dengan konsentrasi logaritmik H 2 O 2 dalam deteksi multipleks. Demikian pula, rasio kontribusi terkait pH C cyan / C orange menggambarkan hubungan linear dengan nilai pH meskipun terdapat tumpang tindih puncak yang khas. Sementara itu, konsentrasi H 2 O 2 dan nilai pH dari berbagai subpopulasi sel diperkirakan dengan analisis patch SERS dan MCR, yang menunjukkan korelasi positif antara kemampuan migrasi sel dan sekresi H 2 O 2 di bawah stimulasi PMA dan korelasi negatif dengan nilai pH ekstraseluler. Analisis patch SERS dan MCR memberikan strategi untuk penginderaan multipleks dalam lingkungan mikro ekstraseluler, yang dapat memfasilitasi pendekatan baru untuk diagnosis penyakit.
4 Bagian Eksperimen
Pembuatan Patch SERS
Patch SERS dibuat dengan memperkenalkan nanorod emas (AuNRs) pada struktur PDMS yang fleksibel melalui perakitan antarmuka dan pemindahan penyerapan. [ 28 , 41 ] Pertama-tama, AuNRs dengan AR yang berbeda disintesis seperti pekerjaan sebelumnya [ 29 ] dan didispersikan kembali dalam air ultramurni. Struktur PDMS disiapkan dengan pencetakan replika pada wafer silikon datar dan diawetkan pada 80 °C selama 30 menit. Selanjutnya, larutan AuNRs (2 nM, 900 μL) ditempatkan ke dalam pelat 12 sumur, diikuti dengan menambahkan campuran perfluorodecanethiol (PFT, 114,5 μL), etanol (5 mL) dan n-heksana (5 mL). Setelah diaduk selama 3 menit dan direbus selama 5 menit, film perakitan AuNRs yang padat muncul di antarmuka air-heksana. Kemudian lapisan heksana dihilangkan dengan hati-hati, membuat film AuNRs terpapar udara. Ketika struktur PDMS yang disiapkan bersentuhan dengan film AuNRs, modifikasi AuNRs pada struktur PDMS dicapai melalui transfer penyerapan. Struktur pembentuk akhir dapat digunakan sebagai patch SERS setelah perawatan plasma (PDC-002, Harrick Plasma) untuk meningkatkan sifat hidrofilisitas, dan patch tersebut dikarakterisasi dengan mikroskop elektron pemindaian (FEI FP 2031/12 Inspect F50).
Fungsionalisasi Patch SERS
Untuk memperkirakan kinerja patch SERS, molekul pelapor Raman 4-merkaptobenzoic acid (4-MBA) dimodifikasi pada AuNR melalui pembentukan ikatan Au–thiolate. Pertama, patch SERS direndam dalam larutan etanol 4-MBA (10 mM) selama 10 menit. Kemudian patch SERS yang dimodifikasi dibilas dengan etanol dan air ultramurni untuk menghilangkan molekul yang berlebih, diikuti dengan pengeringan dengan nitrogen. Modifikasi 2-merkaptohidrokuinon (2-MHQ, 50 mM) atau 4-merkaptopiridina (4-MPy, 10 mM) mengikuti proses yang sama. Untuk deteksi multipleks, dua molekul pelapor Raman 2-MHQ dan 4-MPy dimodifikasi pada patch SERS secara berurutan.
Pengukuran SERS
Semua spektrum SERS dikumpulkan melalui sistem mikroskop Renishaw Raman (laser 785 nm, 3,2 mW, mikroskop tegak, lensa objektif 50 ×) dan perangkat lunak WiRE. Setiap pengukuran dilakukan dengan waktu integrasi 2 detik dan 2 akumulasi. Asam sitrat (CA) dan natrium hidroksida (NaOH) digunakan untuk mengubah tingkat pH larutan PBS, dan nilai pH akhir dikalibrasi dengan pH meter (Alalis, PH510). Selama deteksi H 2 O 2 atau pH berbasis SERS, patch direndam dalam larutan PBS dengan berbagai konsentrasi H 2 O 2 (1 nM hingga 1 mM) atau nilai pH yang berbeda (6–8). Selama deteksi multipleks, volume H 2 O 2 yang sesuai ditambahkan ke dalam larutan PBS dengan nilai pH yang diketahui dan kemudian pH diukur lagi untuk mengonfirmasi kebetulan. Untuk setiap kondisi, setidaknya 6 sampel uji dipilih untuk dirata-ratakan.
Analisis Data
Spektrum yang dinormalisasi diuraikan dengan analisis MCR menggunakan PLS Toolbox, di mana faktor koreksi derau ditetapkan sebesar 3. Setelah spektrum komponen murni diselesaikan dengan model kemurnian, metode kuadrat terkecil tertimbang dilakukan untuk menghitung koefisien nonnegatif dari komponen murni (yaitu, kontribusi) dalam spektrum campuran.
Percobaan Sel
Sel MCF-7 dan sel MDA-MB-231 dikulturkan dalam medium Dulbecco’s modified eagle (DMEM) yang diberi 10% fetal bovine serum (FBS) dalam inkubator yang dilembabkan (Thermo Scientific Cell Locker, 37 °C, 5% CO 2 ). Sel MCF-7 (1 × 10 5 /mL) atau sel MDA-MB-231 (1 × 10 5 /mL) disemai pada penutup kaca yang disterilkan dengan sinar ultraviolet selama 2 hari sebelum percobaan.
Selama akuisisi spektrum SERS, media kultur sel diganti dengan larutan PBS atau PMA (5 μg mL −1 ), yang dapat merangsang sel untuk mengeluarkan H 2 O 2 . Patch SERS ditempatkan pada sel hidup, dan laser difokuskan pada AuNR yang bersentuhan dengan sel. Kontribusi komponen murni diperkirakan dengan dekomposisi MCR, dan analisis varians dilakukan dengan signifikansi pada P < 0,001 untuk membandingkan H 2 O 2 dan nilai pH sel yang berbeda.
Kemampuan migrasi sel dievaluasi dengan uji gores. Celah kosong pada lapisan sel tunggal dibuat dengan ujung pipet p200 dan dicuci dengan larutan PBS untuk menghilangkan serpihan. Kemudian sel diwarnai dengan Calcein-AM (1 μL mL −1 ) selama 10 menit dan divisualisasikan dengan mikroskop pemindai laser confocal (Leica TCS SP8) setiap 24 jam. Efisiensi migrasi sel diperkirakan berdasarkan jarak celah. Semua percobaan dilakukan sedikitnya tiga kali, dan hasilnya dilaporkan sebagai rata-rata ± simpangan baku.





Tinggalkan Balasan